Contenu
- 1 Fonction
- 2 Lactate Déshydrogénase humaine
- 2.1 Structure
- 2.2 Catalyse
- 2.3 Cinétique
- 2.4 Régulation
- 3 Structures 3D de la lactate déshydrogénase
Fonction
L-lactate déshydrogénase (L-LDH) catalyse l’interconversion du pyruvate et du NADH+ en L-lactate et en NAD+.
Lactate déshydrogénase H (H-LDH) catalyse l’interconversion du D-lactate et du ferricytochrome c en pyruvate et ferrocytochrome c.
Lactate déshydrogénase (LDH) est une enzyme importante chez l’homme. Elle est présente dans différentes régions du corps, chaque région ayant une conformation unique de différentes sous-unités. La LDH est une enzyme clé de la respiration anaérobie. La respiration anaérobie se fait en l’absence d’oxygène. Cette voie est importante pour la glycolyse de deux manières principales. La première est que si le pyruvate s’accumulait, la glycolyse et donc la production d’ATP ralentiraient. La seconde est que la respiration anaérobie permet la régénération du NAD+ à partir du NADH. Le NAD+ est nécessaire lorsque la glycéraldéhyde-3-phosphate déshydrogénase oxyde le glycéraldéhyde-3-phosphate dans la glycolyse, ce qui génère du NADH. La lactate déshydrogénase est responsable de la conversion anaérobie du NADH en NAD+. dans la Lactate déshydrogénase de Cryptosporidium parvum (4nd4).
Lactate déshydrogénase humaine
Structure
est une protéine quaternaire formée de la combinaison de deux sous-unités, M et H (Muscle et Cœur) en une structure de quatre des sous-unités. Les différentes combinaisons trouvées dans le corps humain sont :
- (4H) Cœur
- (3H1M) Réticuloendothélial
- (2H2M) Poumons
- (1H3M) Reins
- (4M) Muscle et Foie
La de LDH telle qu’elle est représentée ici est composée de 40% d’hélices alpha et de 23% de feuillets bêta. Les données du SCOP classent cette forme de lactate déshydrogénase comme mixte bêta-alpha-bêta, avec principalement des feuillets bêta parallèles.
Voir aussi
- Lactate déshydrogénase humaine
- Jasper Lactate Final
- pli de Rossmann.
Catalyse
Des études ont montré que le mécanisme réactionnel de la LDH suit une séquence ordonnée.
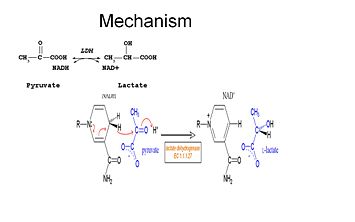
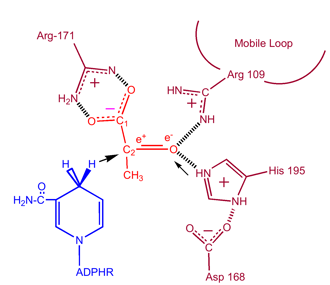
Pour que le lactate soit oxydé, le NADH doit d’abord se lier à l’enzyme, suivi du lactate. . Une fois que le NADH est lié à l’enzyme, il est alors possible pour le lactate de se lier (le substrat oxamate est représenté ; le groupe -CH3 est remplacé par -NH2 pour former l’oxamate). Le lactate se lie à l’enzyme entre le cycle nicotinamide et plusieurs résidus de la LDH. Le transfert d’un ion hydrure se fait ensuite rapidement dans les deux sens donnant un mélange des deux complexes tertiaires, enzyme-NAD+-lactate et enzyme-NADH-pyruvate .Enfin le pyruvate se dissocie de l’enzyme suivi du NAD+.
Cinétique
Des études cinétiques de la lactate déshydrogénase avec l’oxalate et l’oxamate (analogues structuraux du lactate et du pyruvate)ont prouvé le mécanisme énoncé ci-dessus. L’étape limitant la vitesse de cette réaction est la vitesse de dissociation du NAD+ et du NADH. La conversion du pyruvate en lactate avec la régénération ultérieure du NAD+ est très favorable.
Régulation
Comme le mécanisme est un mécanisme d’équilibre, Il ne semble pas y avoir de régulation spécifiquement conçue pour la lactate déshydrogénase, au lieu de cela, elle dépend de l’activation de la réparation anaérobie et de la présence de pyruvate et de NADH, ou de lactate et de NAD+.
Structures 3D de la lactate déshydrogénase
Structures 3D de la lactate déshydrogénase
.
