- Tableau des géométries
- OBjectifs d’apprentissage
- PERSPECTIVES CLÉS
- Points clés
- Termes clés
- Modèle VSEPR
- Géométries moléculaires
- Comment déterminer la géométrie moléculaire – YouTube : Cette vidéo décrit une méthode pour trouver rapidement les principales formes géométriques des molécules simples.
- Géométries moléculaires
- OBjectifs d’apprentissage
- Prises clés
- Points clés
- Termes clés
- Méthode AXE
- Géométries principales (sans paires d’électrons solitaires):
- Trigonal Planaire
- Tétraédrique
- Octahedral
- Interactif : Géométrie des électrons : Les molécules prennent des formes différentes en raison des modèles d’électrons partagés et non partagés. Dans ces exemples, tous les électrons affectant la forme des molécules sont partagés dans les liaisons covalentes maintenant les atomes ensemble pour former les molécules.
- Paires d’électrons seuls
- OBjectifs d’apprentissage
- ACQUISITION CLÉS
- Points clés
- Termes clés
- Géométries moléculaires avec paires d’électrons solitaires
- Nombre de coordination et atome central
- L’effet répulsif des électrons de la paire solitaire
- Interactif : Les électrons non partagés et la forme « courbée » : Utilisez le modèle 3D pour voir comment les électrons non partagés repoussent ceux qui sont partagés dans les liaisons entre l’hydrogène et l’oxygène, ce qui donne à la molécule une forme « courbée ».
- Licences et attributions
- Contenu sous licence CC, partagé antérieurement
- CC LICENSED CONTENT, SPECIFIC ATTRIBUTION
Tableau des géométries
La théorie VSEPR détermine les géométries moléculaires (linéaire, trigonal, trigonal bipyramidal, tétraédrique et octaédrique).
OBjectifs d’apprentissage
Appliquer le modèle VSEPR pour déterminer la géométrie d’une molécule qui ne contient aucune paire d’électrons solitaires sur l’atome central.
PERSPECTIVES CLÉS
Points clés
- Fondamentalement, le modèle VSEPR théorise que les régions de charge électrique négative se repoussent, ce qui fait qu’elles (et les liaisons chimiques qu’elles forment) restent aussi éloignées que possible.
- Les géométries moléculaires tiennent compte du nombre d’atomes et du nombre d’électrons de paires solitaires.
- Les principales géométries sans électrons de paires solitaires sont : linéaire, trigonal, tétraédrique, trigonal bipyramidal et octaédrique.
Termes clés
- Théorie VSEPR : modèle de chimie utilisé pour prédire la forme des molécules individuelles sur la base de la répulsion électrostatique des paires d’électrons
Modèle VSEPR
Le modèle de répulsion des paires d’électrons de la coquille de valence (VSEPR) se concentre sur les paires d’électrons liantes et non liantes présentes dans la coquille la plus externe (de valence) d’un atome qui se connecte à deux ou plusieurs autres atomes.
Fondamentalement, le modèle VSEPR théorise que ces régions de charge électrique négative se repoussent mutuellement, ce qui les amène (ainsi que les liaisons chimiques qu’elles forment) à rester aussi éloignées que possible. Par conséquent, les deux nuages d’électrons contenus dans une simple molécule triatomique ![]() s’étendront dans des directions opposées. Une séparation angulaire de 180° place les deux orbitales de liaison aussi loin l’une de l’autre que possible ; nous nous attendons donc à ce que les deux liaisons chimiques s’étendent dans des directions opposées, produisant une molécule linéaire.
s’étendront dans des directions opposées. Une séparation angulaire de 180° place les deux orbitales de liaison aussi loin l’une de l’autre que possible ; nous nous attendons donc à ce que les deux liaisons chimiques s’étendent dans des directions opposées, produisant une molécule linéaire.

 . Les deux atomes X (en blanc) sont distants de 180° l’un de l’autre.
. Les deux atomes X (en blanc) sont distants de 180° l’un de l’autre.Si l’atome central contient également une ou plusieurs paires d’électrons non liants, ces régions supplémentaires de charge négative se comporteront comme celles associées aux atomes liés. Les orbitales contenant les diverses paires de liaison et de non-liaison dans la coquille de valence s’étendront à partir de l’atome central dans des directions qui minimisent leurs répulsions mutuelles. Si l’atome central possède des orbitales d partiellement occupées, il peut être en mesure d’accueillir cinq ou six paires d’électrons, formant ce que l’on appelle parfois un « octuor élargi ».
Géométries moléculaires
Les géométries moléculaires (linéaire, trigonale, tétraédrique, trigonal bipyramidal et octaédrique) sont déterminées par la théorie VSEPR. Un tableau des géométries utilisant la théorie VSEPR peut faciliter le dessin et la compréhension des molécules. Le tableau des géométries moléculaires se trouve dans la première figure. La deuxième figure sert d’aide visuelle pour le tableau.


Comment déterminer la géométrie moléculaire – YouTube : Cette vidéo décrit une méthode pour trouver rapidement les principales formes géométriques des molécules simples.
Géométries moléculaires
La théorie VSEPR décrit cinq formes principales de molécules simples : linéaire, planaire trigonal, tétraédrique, bipyramidal trigonal et octaédrique.
OBjectifs d’apprentissage
Appliquer le modèle VSEPR pour déterminer la géométrie des molécules où l’atome central contient une ou plusieurs paires d’électrons solitaires.
Prises clés
Points clés
- Linéaire : molécule triatomique simple de type
 ; ses deux orbitales de liaison sont distantes de 180°.
; ses deux orbitales de liaison sont distantes de 180°. - Trigonal plan : triangulaire et dans un plan, avec des angles de liaison de 120°.
- Tétraédrique : quatre liaisons sur un atome central avec des angles de liaison de 109,5°.
- Bipyramidal trigonal : cinq atomes autour de l’atome central ; trois dans un plan avec des angles de liaison de 120° et deux aux extrémités opposées de la molécule.
- Octaédrique : six atomes autour de l’atome central, tous avec des angles de liaison de 90°.
Termes clés
- Théorie VSEPR : le modèle de répulsion des paires d’électrons de la coquille de Valence (VSEPR) est utilisé pour prédire la forme des molécules individuelles en fonction de l’importance de la répulsion électrostatique des paires d’électrons
Méthode AXE
Une autre façon d’examiner les géométries moléculaires est à travers la « méthode AXE » de comptage des électrons. A dans AXE représente l’atome central et a toujours un indice implicite un ; X représente le nombre de liaisons sigma entre les atomes centraux et extérieurs (les liaisons covalentes multiples – doubles, triples, etc – comptent pour un X) ; et E représente le nombre de paires d’électrons solitaires entourant l’atome central. La somme de X et E, connue sous le nom de nombre stérique, est également associée au nombre total d’orbitales hybridées utilisé par la théorie des liaisons de valence. VSEPR utilise le nombre stérique et la distribution des X et des E pour prédire les formes géométriques moléculaires.

Notez que les géométries sont nommées en fonction des positions atomiques uniquement, et non de l’arrangement des électrons.

Géométries principales (sans paires d’électrons solitaires):
Dans un modèle linéaire, les atomes sont reliés en ligne droite, et un angle de liaison est simplement l’angle géométrique entre deux liaisons adjacentes. Une molécule triatomique simple du type ![]() a ses deux orbitales de liaison séparées de 180°. Des exemples de molécules triatomiques pour lesquelles la théorie VSEPR prédit une forme linéaire comprennent
a ses deux orbitales de liaison séparées de 180°. Des exemples de molécules triatomiques pour lesquelles la théorie VSEPR prédit une forme linéaire comprennent ![]() (qui ne possède pas suffisamment d’électrons pour se conformer à la règle de l’octuple) et
(qui ne possède pas suffisamment d’électrons pour se conformer à la règle de l’octuple) et ![]() . Lorsque vous écrivez la formule du point d’électrons pour le dioxyde de carbone, remarquez que les liaisons C-O sont des liaisons doubles ; cela ne fait aucune différence pour la théorie VSEPR. L’atome de carbone central est toujours relié à deux autres atomes. Les nuages d’électrons qui relient les deux atomes d’oxygène sont séparés de 180°.
. Lorsque vous écrivez la formule du point d’électrons pour le dioxyde de carbone, remarquez que les liaisons C-O sont des liaisons doubles ; cela ne fait aucune différence pour la théorie VSEPR. L’atome de carbone central est toujours relié à deux autres atomes. Les nuages d’électrons qui relient les deux atomes d’oxygène sont séparés de 180°.

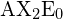 dans le tableau.
dans le tableau.Trigonal Planaire
Les molécules de forme trigonale planaire sont triangulaires et dans un plan, ou surface plane. Une molécule ![]() telle que la
telle que la ![]() possède trois régions de densité électronique s’étendant à partir de l’atome central. La répulsion entre celles-ci sera minimale lorsque l’angle entre deux d’entre elles est de 120o.
possède trois régions de densité électronique s’étendant à partir de l’atome central. La répulsion entre celles-ci sera minimale lorsque l’angle entre deux d’entre elles est de 120o.
Tétraédrique
Tétra- signifie quatre, et -hedral se rapporte à une face d’un solide ; « tétraédrique » signifie littéralement « ayant quatre faces ». « On trouve cette forme lorsqu’il y a quatre liaisons sur un seul atome central, sans paires d’électrons solitaires. Conformément à la théorie VSEPR, les angles de liaison entre les liaisons électroniques sont de 109,5o. Un exemple de molécule tétraédrique est le méthane ![]() . Les quatre liaisons équivalentes pointent dans quatre directions géométriquement équivalentes en trois dimensions, correspondant aux quatre coins d’un tétraèdre centré sur l’atome de carbone.
. Les quatre liaisons équivalentes pointent dans quatre directions géométriquement équivalentes en trois dimensions, correspondant aux quatre coins d’un tétraèdre centré sur l’atome de carbone.

Une forme bipyramidale trigonale se forme lorsqu’un atome central est entouré de cinq atomes dans une molécule. Dans cette géométrie, trois atomes sont dans le même plan avec des angles de liaison de 120° ; les deux autres atomes sont aux extrémités opposées de la molécule. Certains éléments du groupe 15 du tableau périodique forment des composés du type ![]() ; les exemples incluent
; les exemples incluent ![]() et
et ![]() .
.

Octahedral
Octa- signifie huit, et -hedral se rapporte à une face d’un solide, donc « octahedral » signifie littéralement « ayant huit faces ». Les angles de liaison sont tous de 90°, et tout comme quatre paires d’électrons subissent une répulsion minimale lorsqu’elles sont dirigées vers les coins d’un tétraèdre, six paires d’électrons essaient de pointer vers les coins d’un octaèdre. Un exemple de molécule octaédrique (![]() ) est l’hexafluorure de soufre (
) est l’hexafluorure de soufre (![]() ).
).
https://lab.concord.org/embeddable.html#interactives/jsmol/electron-geometry.json
Interactif : Géométrie des électrons : Les molécules prennent des formes différentes en raison des modèles d’électrons partagés et non partagés. Dans ces exemples, tous les électrons affectant la forme des molécules sont partagés dans les liaisons covalentes maintenant les atomes ensemble pour former les molécules.
Paires d’électrons seuls
Les électrons non liants sont dans des orbitales qui occupent l’espace, repoussent les autres orbitales et changent la forme d’une molécule.
OBjectifs d’apprentissage
Reconnaître l’effet des paires d’électrons solitaires sur les géométries des molécules.
ACQUISITION CLÉS
Points clés
- Les orbites contenant les diverses paires liantes et non liantes de la coquille de valence s’étendront à partir de l’atome central dans des directions qui minimisent leurs répulsions.
- Une orbitale non liante n’a pas de noyau atomique à son extrémité éloignée pour attirer le nuage d’électrons vers elle ; la charge dans une telle orbitale sera donc concentrée plus près de l’atome central.
- Les orbitales non liantes exercent plus de répulsion sur les autres orbitales que les orbitales liantes.
Termes clés
- Nombre de coordination : en chimie et en cristallographie, le nombre de voisins d’un atome central dans une molécule ou un cristal
- paire solitaire : un ensemble de valence de deux électrons qui existe sans liaison ou partage avec d’autres atomes
Géométries moléculaires avec paires d’électrons solitaires
Jusqu’à présent, nous n’avons discuté que des géométries sans aucune paire d’électrons solitaires. Comme vous l’avez probablement remarqué dans le tableau des géométries et la méthode AXE, l’ajout de paires solitaires modifie la forme d’une molécule. Nous avons mentionné précédemment que si l’atome central contient également une ou plusieurs paires d’électrons non liés, ces régions supplémentaires de charge négative se comporteront de la même manière que celles associées aux atomes liés. Les orbitales contenant les différentes paires liantes et non liantes dans la coquille de valence s’étendront à partir de l’atome central dans des directions qui minimisent leurs répulsions mutuelles.

Nombre de coordination et atome central
Le nombre de coordination désigne le nombre de paires d’électrons qui entourent un atome donné, souvent appelé atome central. Les géométries des molécules avec paires solitaires seront différentes de celles sans paires solitaires, car la paire solitaire ressemble à un espace vide dans une molécule. Les deux classes de géométrie sont nommées d’après les formes des figures géométriques imaginaires (la plupart du temps des polygones solides réguliers) qui seraient centrées sur l’atome central et auraient une paire d’électrons à chaque sommet.
Dans la molécule d’eau (![]() ), l’atome central est
), l’atome central est ![]() , et la formule du point électronique de Lewis prédit qu’il y aura deux paires d’électrons non liants. L’atome d’oxygène sera donc coordonné de manière tétraédrique, ce qui signifie qu’il se trouve au centre du tétraèdre. Deux des positions de coordination sont occupées par les paires d’électrons partagées qui constituent les liaisons O-H, et les deux autres par les paires non liantes. Par conséquent, bien que l’atome d’oxygène soit coordonné de façon tétraédrique, la géométrie de liaison (forme) de la molécule
, et la formule du point électronique de Lewis prédit qu’il y aura deux paires d’électrons non liants. L’atome d’oxygène sera donc coordonné de manière tétraédrique, ce qui signifie qu’il se trouve au centre du tétraèdre. Deux des positions de coordination sont occupées par les paires d’électrons partagées qui constituent les liaisons O-H, et les deux autres par les paires non liantes. Par conséquent, bien que l’atome d’oxygène soit coordonné de façon tétraédrique, la géométrie de liaison (forme) de la molécule ![]() est décrite comme étant courbée.
est décrite comme étant courbée.

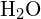 est décrite comme étant courbée.
est décrite comme étant courbée.L’effet répulsif des électrons de la paire solitaire
Il existe une différence importante entre les orbitales électroniques liantes et non liantes. Parce qu’une orbitale non liante n’a pas de noyau atomique à son extrémité pour attirer le nuage d’électrons vers elle, la charge dans une telle orbitale sera concentrée plus près de l’atome central ; par conséquent, les orbitales non liantes exercent plus de répulsion sur les autres orbitales que les orbitales liantes. Dans ![]() , les deux orbitales non liantes poussent les orbitales liantes plus près les unes des autres, rendant l’angle H-O-H de 104,5° au lieu de l’angle tétraédrique de 109,5°.
, les deux orbitales non liantes poussent les orbitales liantes plus près les unes des autres, rendant l’angle H-O-H de 104,5° au lieu de l’angle tétraédrique de 109,5°.
La structure en points d’électrons de ![]() place une paire d’électrons non liants dans la coquille de valence de l’atome d’azote. Cela signifie qu’il y a trois atomes liés et une paire solitaire pour un nombre de coordination de quatre autour de l’azote, comme cela se produit dans
place une paire d’électrons non liants dans la coquille de valence de l’atome d’azote. Cela signifie qu’il y a trois atomes liés et une paire solitaire pour un nombre de coordination de quatre autour de l’azote, comme cela se produit dans ![]() .
.

 … : Le couple solitaire attaché à l’azote central crée des angles de liaison qui diffèrent du tétraèdre 109,5 °.
… : Le couple solitaire attaché à l’azote central crée des angles de liaison qui diffèrent du tétraèdre 109,5 °.On peut donc prédire que les trois atomes d’hydrogène se trouveront aux coins d’un tétraèdre centré sur l’atome d’azote. L’orbitale de la paire solitaire pointera vers le quatrième coin du tétraèdre, mais comme cette position sera vacante, la molécule ![]() elle-même ne peut pas être tétraédrique ; elle prend plutôt une forme pyramidale, plus précisément, celle d’une pyramide trigonale (une pyramide à base triangulaire). Les atomes d’hydrogène sont tous dans le même plan, l’azote se trouvant à l’extérieur du plan. Les électrons non liants repoussent légèrement les orbitales de liaison, ce qui fait que les angles de liaison H-N-H sont d’environ 107°.
elle-même ne peut pas être tétraédrique ; elle prend plutôt une forme pyramidale, plus précisément, celle d’une pyramide trigonale (une pyramide à base triangulaire). Les atomes d’hydrogène sont tous dans le même plan, l’azote se trouvant à l’extérieur du plan. Les électrons non liants repoussent légèrement les orbitales de liaison, ce qui fait que les angles de liaison H-N-H sont d’environ 107°.
Dans les molécules à 5 coordinations contenant des paires solitaires, ces orbitales non liantes (qui sont plus proches de l’atome central et donc plus susceptibles d’être repoussées par d’autres orbitales) résideront de préférence dans le plan équatorial. Cela les placera à des angles de 90° par rapport à un maximum de deux orbitales de liaison orientées axialement. Nous pouvons donc prédire qu’une molécule ![]() (une molécule dans laquelle l’atome central A est coordonné à quatre autres atomes X et à une paire d’électrons non liants) telle que
(une molécule dans laquelle l’atome central A est coordonné à quatre autres atomes X et à une paire d’électrons non liants) telle que ![]() aura une forme en « see-saw ».
aura une forme en « see-saw ».

Substituer des paires non liantes aux atomes liés réduit la coordination bipyramide triangulaire à des formes moléculaires encore plus simples.
https://lab.concord.org/embeddable.html#interactives/jsmol/unshared-electrons.json
Interactif : Les électrons non partagés et la forme « courbée » : Utilisez le modèle 3D pour voir comment les électrons non partagés repoussent ceux qui sont partagés dans les liaisons entre l’hydrogène et l’oxygène, ce qui donne à la molécule une forme « courbée ».
Licences et attributions
Contenu sous licence CC, partagé antérieurement
- Curation et révision. Fourni par : Boundless.com. Licence : CC BY-SA : Attribution-ShareAlike
CC LICENSED CONTENT, SPECIFIC ATTRIBUTION
- Théorie VSEPR. Fourni par : Wikipédia. Situé à : http://en.wikipedia.org/wiki/VSEPR_Theory. Licence : CC BY-SA : Attribution-ShareAlike
- Géométrie moléculaire. Fourni par : Wikipédia. Situé à : http://en.wikipedia.org/wiki/Molecular_geometry. Licence : CC BY-SA : Attribution-ShareAlike
- Théorie VSEPR. Fourni par : Wikipédia. Situé à : http://en.wikipedia.org/wiki/VSEPR%20Theory. Licence : CC BY-SA : Attribution-ShareAlike
- Géométrie moléculaire. Fourni par : Wikipédia. Situé à : http://en.wikipedia.org/wiki/Molecular_geometry. Licence : Public Domain : Aucun droit d’auteur connu
- Géométries VSEPR. Fourni par : Wikimedia. Situé à : http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Licence : CC BY-SA : Attribution-ShareAlike
- Comment déterminer la géométrie moléculaire – YouTube. Situé à : http://www.youtube.com/watch?v=pA9ML0HVOYE. Licence : Domaine public : Aucun droit d’auteur connu. Termes de la licence : Licence standard YouTube
- Linear-3D-balls. Fourni par : Wikipédia. Situé à : http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Licence : CC BY : Attribution
- Géométrie moléculaire. Fourni par : Wikipédia. Situé à : http://en.wikipedia.org/wiki/Molecular_geometry. Licence : CC BY-SA : Attribution-ShareAlike
- Théorie VSEPR. Fourni par : Wikipédia. Situé à : http://en.wikipedia.org/wiki/VSEPR_Theory. Licence : CC BY-SA : Attribution-ShareAlike
- Théorie VSEPR. Fourni par : Wikipédia. Situé à : http://en.wikipedia.org/wiki/VSEPR%20Theory. Licence : CC BY-SA : Attribution-ShareAlike
- Géométrie moléculaire. Fourni par : Wikipédia. Situé à : http://en.wikipedia.org/wiki/Molecular_geometry. Licence : Public Domain : Aucun droit d’auteur connu
- Géométries VSEPR. Fourni par : Wikimedia. Situé à : http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Licence : CC BY-SA : Attribution-ShareAlike
- Comment déterminer la géométrie moléculaire – YouTube. Situé à : http://www.youtube.com/watch?v=pA9ML0HVOYE. Licence : Domaine public : Aucun droit d’auteur connu. Termes de la licence : Licence standard YouTube
- Linear-3D-balls. Fourni par : Wikipédia. Situé à : http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Licence : CC BY : Attribution
- Théorie VSEPR. Fourni par : Wikipedia. Situé à : http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Licence : Public Domain : Aucun droit d’auteur connu
- Théorie VSEPR. Fourni par : Wikipedia. Situé à : http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Licence : Public Domain : Aucun droit d’auteur connu
- numéro de coordination. Fourni par : Wiktionnaire. Situé à : http://en.wiktionary.org/wiki/coordination_number. Licence : CC BY-SA : Attribution-ShareAlike
- John Hutchinson, Études de développement de concepts en chimie. 18 septembre 2013. Fourni par : OpenStax CNX. Situé à : http://cnx.org/content/m12594/latest/?collection=col10264/latest. Licence : CC BY : Attribution
- Sans limites. Fourni par : Boundless Learning. Situé à : http://www.boundless.com//chemistry/definition/lone-pair. Licence : CC BY-SA : Attribution-ShareAlike
- Géométrie moléculaire. Fourni par : Wikipedia. Situé à : http://en.wikipedia.org/wiki/Molecular_geometry. Licence : Public Domain : Aucun droit d’auteur connu
- Géométries VSEPR. Fourni par : Wikimedia. Situé à : http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Licence : CC BY-SA : Attribution-ShareAlike
- Comment déterminer la géométrie moléculaire – YouTube. Situé à : http://www.youtube.com/watch?v=pA9ML0HVOYE. Licence : Domaine public : Aucun droit d’auteur connu. Termes de la licence : Licence standard YouTube
- Linear-3D-balls. Fourni par : Wikipedia. Situé à : http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Licence : CC BY : Attribution
- Théorie VSEPR. Fourni par : Wikipedia. Situé à : http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Licence : Public Domain : Aucun droit d’auteur connu
- Théorie VSEPR. Fourni par : Wikipedia. Situé à : http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Licence : Public Domain : Aucun droit d’auteur connu
- Théorie VSEPR. Fourni par : Wikipedia. Situé à : http://en.wikipedia.org/wiki/VSEPR_Theory. Licence : Domaine public : Aucun droit d’auteur connu
- Tétraèdre_Structure_de_l’eau.png. Fourni par : Wikimedia. Situé à : https://commons.wikimedia.org/wiki/File:Tetrahedral_Structure_of_Water.png. Licence : Domaine public : Aucun droit d’auteur connu
un modèle de chimie utilisé pour prédire la forme des molécules individuelles sur la base de la répulsion électrostatique des électrons.paire électrostatique
le nombre total d’atomes directement voisins d’un atome central dans une molécule ou un ion
deux (une paire de) électrons de valence qui ne sont pas utilisés pour former une liaison covalente
.