Comment la vie a-t-elle commencé sur Terre ? Sur une planète jeune et rocheuse, comment les produits chimiques ont-ils pu s’assembler de la bonne façon pour former les toutes premières cellules ? Comment ces cellules primitives ont-elles commencé à se comporter comme la vie : elles ont grandi, se sont divisées et ont transmis des caractéristiques avantageuses à la génération suivante ?
Les origines de la vie sont particulièrement obscures car le dossier géologique – les couches de roche et les fossiles intégrés qui contiennent des indices sur l’histoire de la Terre et de la vie – disparaît il y a environ 3,9 milliards d’années, effacé par les mouvements de la croûte terrestre. En conséquence, les scientifiques manquent de preuves directes des conditions de la Terre primitive, y compris des preuves des molécules qui auraient pu tourbillonner dans les mares primordiales et former les éléments constitutifs de la vie.
Cela pose une foule de questions, précisément le genre de grandes questions vers lesquelles Jack Szostak est attiré. Avec d’autres, il pense pouvoir reconstituer en laboratoire le long chemin qui a mené des produits chimiques de l’espace à la formation de la Terre, à la chimie de la pré-vie sur la planète, aux premières protocellules, et enfin aux cellules avancées avec métabolisme et synthèse des protéines. Des explorations tentaculaires comme celles-ci nécessitent des compétences dans de nombreux domaines, notamment la chimie et la biochimie, la géologie et la géophysique, ainsi que l’astronomie.
Szostak (prononcé shah-stak) pourrait être la personne idéale pour rechercher des réponses. Lauréat du prix Nobel, professeur de génétique à la faculté de médecine de Harvard, professeur de chimie et de biologie chimique à la faculté des arts et des sciences, Rich Distinguished Investigator au Massachusetts General Hospital (MGH) et chercheur au Howard Hughes Medical Institute, il est décrit par d’autres comme un scientifique brillant et motivé. Mais il est également connu pour son humilité douce, y compris sa volonté de se plonger profondément dans des sujets qui sont nouveaux pour lui, et pour sa collégialité, pour aider à favoriser le partage d’idées qui fait avancer la science.
Ses propres recherches se concentrent sur un segment du chemin vers la vie : la protocellule, « une cellule primordiale vraiment, vraiment simple qui pourrait s’assembler à partir de produits chimiques qui étaient présents très tôt, à la surface de la Terre », explique Szostak. Il espère comprendre comment elle a pu croître, se diviser, commencer à se répliquer et finalement évoluer. « Nous ne saurons peut-être pas ce qui s’est réellement passé, mais nous pouvons peut-être imaginer différents chemins possibles », dit-il. « Tout ce que nous pouvons faire, c’est essayer d’assembler en laboratoire des choses qui semblent plausibles. »
« Évolution dirigée »
Ce mois d’août a marqué la quarantième année de Szostak à Harvard et la trente-cinquième au MGH (où se trouve son laboratoire), un mandat marqué par des découvertes importantes dans une variété surprenante de domaines. Dans les années 1980, son laboratoire a mené des expériences sur des levures afin de comprendre la génétique et la biochimie de la recombinaison de l’ADN. Ces travaux ont abouti au modèle de réparation de la cassure double brin, qui décrit comment de longs brins d’ADN se cassent, échangent des segments, puis se rejoignent. Cela a suscité des recherches ultérieures sur le mécanisme de recombinaison pendant la méiose, la division cellulaire qui donne naissance aux spermatozoïdes et aux ovules.
Au cours de la même période, son équipe a également fait d’importantes découvertes sur les télomères – les capuchons protecteurs, présents aux extrémités des chromosomes, qui garantissent que l’ADN se réplique correctement lors de la division des cellules. Pour ces recherches, Szostak a reçu plus tard le prix Nobel 2009 de physiologie ou de médecine, qu’il a partagé avec les chercheurs Elizabeth Blackburn, Sc.D. ’06, maintenant emerita à l’UC, San Francisco, et Carol Greider de Johns Hopkins.
Au moment où Szostak a reçu l’appel téléphonique matinal de Suède en octobre 2009, il avait déjà passé plus de 20 ans à faire des contributions fondamentales dans d’autres domaines de la science. Après les découvertes sur les télomères au milieu des années 1980 (la recherche a établi un lien entre les télomères raccourcis et de nombreuses maladies du vieillissement), de nombreux scientifiques sont entrés dans le domaine et Szostak a choisi de changer de direction. « Les expériences suivantes étaient assez claires, et nous avions l’impression que tout ce que nous faisions serait fait de toute façon », se souvient-il. « Je n’ai jamais pensé qu’il y avait un intérêt à faire des choses qui allaient être faites de toute façon. Cela m’a donc poussé à regarder autour de moi et à réfléchir aux autres types de questions scientifiques que je pourrais commencer à aborder. » En 1984, il a accepté l’offre de transférer son laboratoire de ce qui était alors le Sidney Farber Cancer Institute au MGH, pour rejoindre les chercheurs qui y travaillaient sur la science fondamentale. « C’était une offre incroyable : toutes mes recherches seraient entièrement financées pendant dix ans », se souvient Szostak. « C’était parfait pour moi, car cela me permettait de changer d’orientation sans me soucier de rédiger des subventions dans un nouveau domaine. »
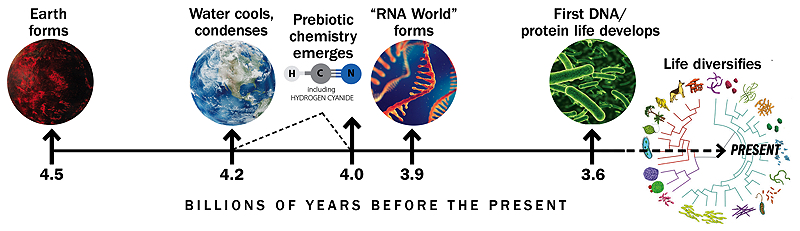
Timeline basée sur un graphique similaire de Gerald Joyce
Après avoir examiné ses options, il s’est fixé sur les enzymes ARN connues sous le nom de ribozymes, un domaine qu’il considérait comme « intéressant, tractable et pas très compétitif ». Lui et ses étudiants diplômés ont commencé à développer des outils pour faire évoluer l’ARN, les molécules monocaténaires des cellules qui copient l’information génétique contenue dans l’ADN. Dans des tubes à essai, son équipe a poussé l’ARN à assumer de nouveaux rôles, comme celui de reconnaître des molécules cibles et de catalyser des réactions. Connu sous le nom d' »évolution dirigée », ce processus a consisté à introduire des mutations dans les brins d’ARN, à rechercher des variantes susceptibles de remplir des fonctions utiles et à permettre à ces nouvelles molécules de se reproduire. Ils ont également effectué des travaux similaires avec l’ADN, les peptides et les protéines.
En 1994, Szostak a reçu le prix de l’Académie nationale des sciences en biologie moléculaire, avec le chercheur Gerald Joyce, aujourd’hui de l’Institut Salk pour les études biologiques, pour avoir développé simultanément mais indépendamment l’évolution in vitro de l’ARN. « Il s’agit d’une technologie permettant de fabriquer des molécules qui vous obéissent », a expliqué Joyce lors d’une interview, en la décrivant comme similaire à la façon dont les agronomes élèvent les vaches pour qu’elles produisent plus de lait, ou développent des cultures qui résistent à la sécheresse. « C’est la version moléculaire de ces méthodes. Et c’est quelque chose qui est maintenant très largement pratiqué », ajoute-t-il (voir « Exploiter l’évolution », janvier-février 2017, page 15), une façon de développer de nouvelles molécules pour une série d’utilisations, y compris des médicaments.
Pour Szostak, le travail sur l’évolution dirigée a soulevé de nouvelles questions. « Je me suis de plus en plus intéressé à la façon dont l’évolution a pu démarrer toute seule sur la Terre primitive », se souvient-il. « C’est une chose d’imposer des pressions sélectives et de faire de l’évolution darwinienne en laboratoire, où vous avez des enzymes, des étudiants et des instruments. Mais d’une certaine manière, l’évolution darwinienne a démarré toute seule. » Étant donné que la capacité à évoluer est une caractéristique clé de la vie, Szostak posait l’une des questions fondamentales de la science : Comment la vie a-t-elle commencé ?
Origines : « Trois grandes questions fondamentales »
Le Canadien-Américain Szostak est né à Londres, où son père étudiait pour obtenir un diplôme en ingénierie aéronautique. La famille est finalement revenue au Canada, où elle a vécu à Ottawa puis à Montréal, et son père a travaillé pour l’armée de l’air canadienne. (Sa mère a travaillé pendant de nombreuses années à des postes administratifs pour une entreprise de produits chimiques industriels, et Szostak y a occupé son premier emploi d’été lorsqu’il était adolescent, en testant la solidité des couleurs dans le laboratoire de teinture de l’entreprise. « Ce travail était répétitif et ennuyeux, mais il m’a donné un premier aperçu de l’importance de tester et de retester les produits pour une utilisation dans le monde réel », se souvient-il. À cette époque, il était « sérieusement intéressé » par les sciences, les mathématiques et l’ingénierie. Il a obtenu son doctorat en biochimie à 25 ans à Cornell, et considère son conseiller, Ray Wu, comme un mentor important : « Il a créé un environnement de laboratoire formidable, mais m’a aussi montré comment obtenir de l’aide sur un projet lorsque je suis confronté à des problèmes. »
Bien que Szostak ait mené quelques recherches pratiques et appliquées au cours de sa carrière – l’une des sociétés qu’il a lancées, Ra Pharma, a découvert un médicament pour la maladie de la myasthénie grave qui doit commencer les essais cliniques de phase III – il est surtout passionné par la science fondamentale.
« C’est une période passionnante pour se lancer dans les neurosciences, car on peut aborder aujourd’hui des problèmes auxquels on ne pouvait même pas penser il y a 30 ans. »
« À mon sens, il y a trois grandes questions scientifiques fondamentales qui sont super intéressantes : l’origine de la vie, l’origine de l’univers et l’origine de l’esprit ou de la conscience », propose-t-il, assis dans son bureau calme et presque vide du laboratoire Mallinckrodt sur Oxford Street à Cambridge. (Le bureau sert à des réunions occasionnelles ; Szostak travaille principalement dans son laboratoire au MGH). Après l’origine de la vie, c’est l’origine de l’esprit qui l’intéresse le plus. Dans les années 1980, alors qu’il réfléchissait à ce qu’il allait faire après ses recherches sur les télomères, il a envisagé de se tourner vers l’étude des neurosciences et a même assisté à des séminaires de Harvard sur le sujet. « C’était fascinant, mais aussi déprimant, car la technologie était si primitive », se souvient-il. Depuis, il a observé avec intérêt les progrès réalisés dans ce domaine. « C’est une période passionnante pour les jeunes qui se lancent dans les neurosciences, car avec toutes les nouvelles technologies, il est possible de traiter aujourd’hui des problèmes auxquels on ne pouvait même pas penser il y a 30 ans », explique-t-il. « Pourtant, le problème global est toujours aussi énorme et quelque peu décourageant. À mon avis, je travaille sur le plus facile de ces grands problèmes. » Parce que les questions sur les origines de la vie sont bien adaptées aux technologies de recherche actuelles, ajoute-t-il, il pense qu’il s’agit d’un « problème soluble ». »
Proto-cellules modèles et ARN « désordonné »
L’équipe de Szostak fabrique des proto-cellules modèles depuis le début des années 2000, cherchant à comprendre comment elles ont pu s’assembler et évoluer à l’origine. Ces structures primitives étaient « extrêmement simples » par rapport à la bactérie unicellulaire la plus simple sur Terre aujourd’hui, explique-t-il. Les protocellules comprenaient probablement une membrane grasse minimale et, à l’origine, un seul gène qui conférait un avantage à la cellule. Les bactéries modernes, en revanche, « ont au moins des centaines et généralement des milliers de gènes ».
Malgré certaines théories selon lesquelles la vie primitive est apparue près des cheminées hydrothermales dans les profondeurs de l’océan, Szostak est plus convaincu par les recherches montrant que les premières cellules se sont développées sur terre dans des étangs ou des bassins, peut-être dans des régions volcaniquement actives. La lumière ultraviolette et les éclairs ont pu aider à convertir les molécules de l’atmosphère en cyanure et autres matériaux utiles pour générer les éléments constitutifs de la vie. L’eau peu profonde donnerait à ces matériaux un endroit pour s’accumuler à des concentrations élevées, et l’activité volcanique pourrait créer des fluctuations de température chaudes et froides utiles pour certaines réactions chimiques.
Une histoire de la Terre et des débuts de la vie
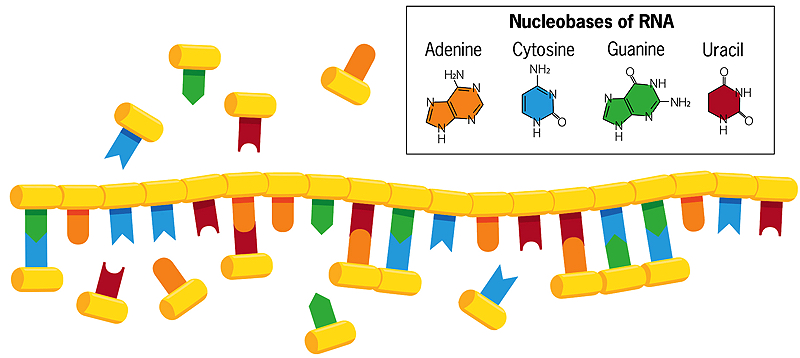
Contrairement à l’ADN double brin, dans lequel les bases cytosine et thymine s’apparient avec la guanine et l’adénine sur le brin opposé, les bases d’un brin simple hélicoïdal d’ARN dans l’eau peuvent former des associations avec des nucléobases flottantes (montrées dans l’image ci-dessus). Si ces bases flottantes fusionnent ensuite entre elles, une nouvelle copie miroir du brin d’ARN est créée, qui se sépare de l’original lorsque l’eau est chauffée. Lorsque ce nouveau brin se réplique à son tour, il crée une copie miroir de lui-même qui correspond au brin d’ARN original. Des erreurs se produisent parfois dans ce processus de copie, et les erreurs bénéfiques se perpétuent. Chaque chaîne, agissant comme un modèle pour sa propre réplication, évolue ainsi et interagit avec son environnement.
Certains scientifiques, dont Gerald Joyce, suggèrent que la vie pourrait avoir commencé en dehors des cellules, avec des molécules flottantes se rencontrant et formant des liens qui leur permettraient d’agir comme la vie. Mais Szostak soutient que la membrane cellulaire était nécessaire, en partie parce qu’elle garderait ensemble les molécules génétiques bénéfiques et empêcherait les métabolites utiles fabriqués par les ribozymes codés génétiquement de flotter dans l’eau environnante ou d’être accrochés par d’autres protocellules qui passent.
Les expériences menées dans son laboratoire ont montré comment une telle membrane pourrait se développer et se diviser. Les chercheurs ont combiné des acides gras tels que l’acide oléique avec de l’eau et un tampon (pour maintenir le pH de la solution stable), puis ont secoué la solution. Au microscope, les ingrédients se sont assemblés en vésicules : des structures circulaires remplies de liquide et dotées de membranes bicouches. L’ajout d’acides gras supplémentaires à l’environnement – pour servir de nutriments – a fait pousser dans les vésicules de longs filaments ressemblant à des cheveux, si fragiles que même un léger souffle d’air sur la lame du microscope les faisait se briser en morceaux. L’équipe de Szostak a obtenu des résultats similaires avec différentes molécules formant la membrane et dans différents environnements, ce qui suggère qu’il s’agit d’une manière plausible pour la membrane d’une protocellule de se développer et de se diviser. Mais comment cette structure pourrait-elle transmettre du matériel génétique bénéfique à la prochaine génération de cellules filles ? « C’est le matériel génétique qui semble en fait un problème beaucoup plus difficile », dit-il.
Pour partager les traits hérités avec les générations successives, les cellules d’aujourd’hui s’appuient sur l’ADN – la molécule à double hélice composée des bases nucléiques adénine, cytosine, guanine et thymine – pour stocker et transmettre l’information génétique. Mais la réplication de l’ADN dans les cellules nécessite à la fois la molécule monocaténaire ARN et des enzymes protéiques, et les protéines codées génétiquement sont bien trop complexes pour s’être formées spontanément sur la Terre primitive. Parce que l’ARN peut à la fois stocker et transmettre des informations génétiques (comme l’ADN) et catalyser des réactions chimiques (comme les enzymes protéiques), de nombreux chercheurs pensent que les cellules primitives ont utilisé des molécules d’ARN pour remplir à la fois des rôles génétiques et enzymatiques.
À la fin des années 1960, le scientifique britannique Leslie Orgel a proposé que l’ARN, ou quelque chose de similaire, aurait pu être la première molécule sur Terre à se répliquer et à évoluer ; cette hypothèse est devenue connue sous le nom de « Monde ARN ». Orgel et d’autres chercheurs ont travaillé pendant des décennies pour comprendre comment des chaînes d’ARN auraient pu s’assembler et se répliquer, mais leurs efforts n’ont pas été entièrement couronnés de succès. « Il y a eu beaucoup de progrès au début, puis tout s’est arrêté parce qu’il y avait une douzaine de problèmes différents et qu’à l’époque, il n’y avait pas de réponse évidente à aucun d’entre eux », explique Szostak. « Presque tout le monde a été frustré et s’est dit : « Peut-être que la vie n’a pas commencé avec l’ARN. Peut-être qu’il y a quelque chose de plus simple, plus facile à fabriquer, plus facile à répliquer.' »
« Nous en savons tellement plus maintenant, et juste en décomposant les choses en problèmes individuels, plus petits, nous avons été en mesure de résoudre certains d’entre eux. »
Les chercheurs ont cherché des alternatives à l’ARN, « et cela a conduit à 10 à 20 ans de chimie vraiment intéressante, aboutissant à beaucoup de molécules intéressantes », note Szostak. « Mais jusqu’à présent, rien de plus simple ou de meilleur que l’ARN qui fonctionne vraiment n’a vu le jour ». Certains chercheurs soutiennent une hypothèse de « métabolisme d’abord », suggérant que la vie aurait pu commencer sans matériel génétique, par une série de réactions auto-entretenues, mais Szostak et d’autres restent peu convaincus. Il y a environ sept ans, il a commencé à réexaminer les obstacles auxquels Orgel et ses contemporains étaient confrontés pour comprendre la synthèse de l’ARN. « Nous en savons tellement plus maintenant », explique-t-il, « et rien qu’en décomposant les choses en problèmes individuels plus petits, nous avons pu en résoudre certains. »
Le laboratoire de Szostak se concentre maintenant presque entièrement sur la façon dont l’ARN primordial aurait pu se copier lui-même. L’ARN moderne s’assemble de manière très régulière et prévisible, avec des blocs de nucléotides qui s’emboîtent comme une chaîne. Chaque bloc contient un sucre (ribose), un phosphate et l’une des quatre bases nucléiques (également appelées bases azotées) – adénine, cytosine, guanine et uracile (généralement appelées A, C, G et U). Les unités ribose-phosphate sont réunies pour former le « squelette » de l’ARN. Dans les cellules modernes, des enzymes protéiques catalysent la réaction qui unit les unités nucléotidiques en chaînes d’ARN.
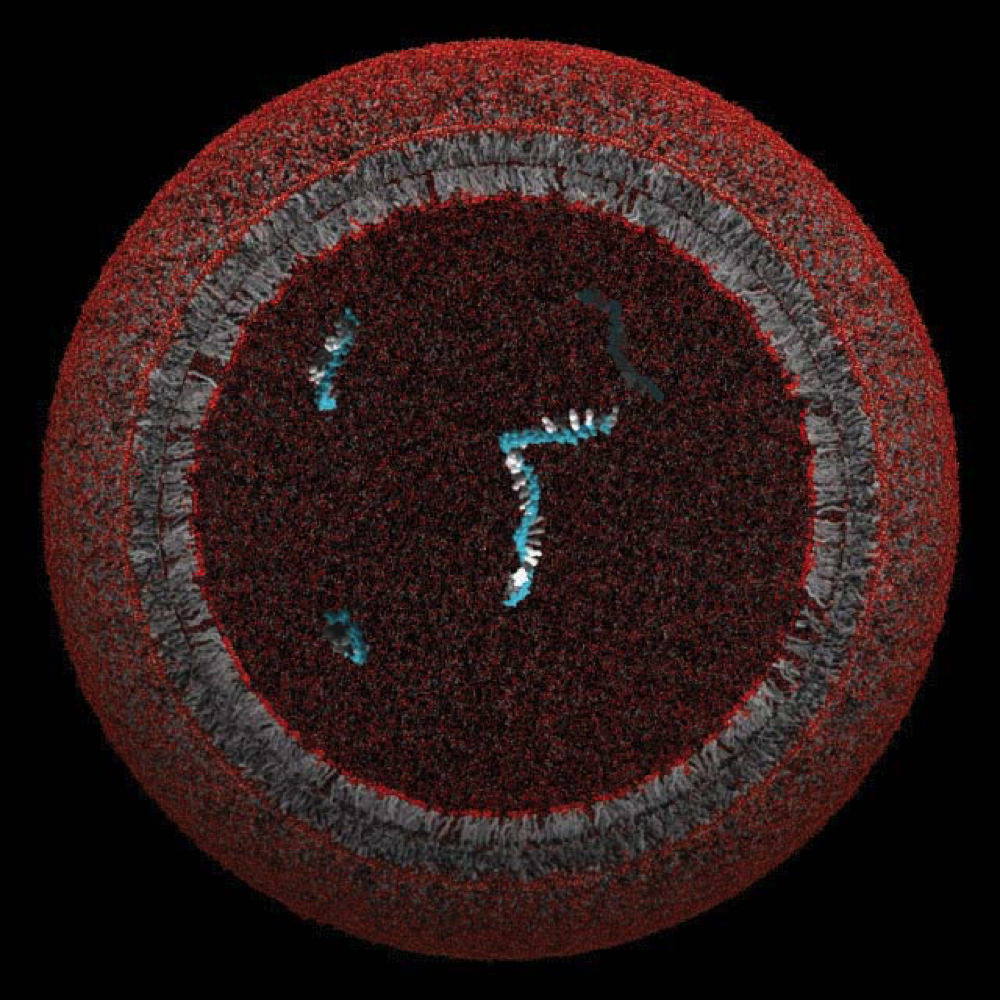
Un modèle de protocellule, dont la membrane lipidique aurait pu enfermer et protéger un seul gène
Image reproduite avec l’aimable autorisation du Szostak Laboratory
Dans les protocellules de la Terre primitive, la chaîne d’ARN aurait servi de matrice sur laquelle une nouvelle chaîne complémentaire de nucléotides s’est assemblée avant de se détacher pour devenir une matrice supplémentaire sur laquelle d’autres nucléotides flottant librement pourraient s’encliqueter. Mais contrairement à l’ARN moderne prévisible, l’ARN primitif ne bénéficiait pas de protéines pour catalyser le processus de construction. (Comme les protéines ne peuvent se former sans la machinerie cellulaire complexe et très évoluée nécessaire à leur synthèse, la plupart des chercheurs pensent qu’il était peu probable qu’elles existent sur la Terre primordiale). Par conséquent, l’ARN primitif était probablement plus désordonné, avec beaucoup plus de variations dans le squelette de sucre et les bases, explique Szostak. Son équipe mène actuellement des expériences « pour avoir une idée de la variabilité qui serait tolérée et de celle qui serait éliminée. Notre modèle actuel est que vous commencez avec quelque chose qui est désordonné et qui a beaucoup de variations différentes, et au fil des cycles de réplication, vous finissez par obtenir quelque chose qui est plus proche de l’ARN homogène moderne. »
Un article de 2018 de Szostak et de Seohyun Kim, étudiant diplômé, illustre la variabilité possible de l’ARN primitif, et de ses éléments constitutifs A, C, G et U. Les scientifiques ont progressé dans la compréhension de la façon dont C et U auraient pu être générés par des réactions chimiques prébiotiques, mais ils ont eu du mal avec A et G. Szostak et Kim suggèrent que l’ARN pourrait avoir commencé avec différentes nucléobases, et leurs expériences ont montré que le nucléoside inosine, qui peut être fabriqué à partir de A (adénine), fonctionne efficacement à la place de G (guanosine). « Cela simplifie le problème global », explique Szostak. « Il ne nous reste plus qu’à savoir comment fabriquer l’A. »
D’autres expériences récentes menées au laboratoire ont porté sur les ions métalliques nécessaires pour déclencher le processus de copie de l’ARN. Les chercheurs utilisent généralement le magnésium, « mais nous devons l’utiliser à des concentrations très élevées », ce qui a des effets secondaires négatifs, déclenchant la dégradation de l’ARN ou la destruction de la membrane cellulaire. « Avec un peu de chance, nous trouverons un moyen simple et plausible de tout faire fonctionner avec moins de magnésium, ou peut-être devrons-nous repenser l’ensemble du problème et l’aborder dans une autre direction », explique Szostak. « Nous tâtonnons dans l’obscurité, en essayant de voir où il pourrait y avoir un chemin vers une solution. »

Le réchauffement et le refroidissement attribuables au volcanisme, comme au Grand Prismatic Spring de Yellowstone, auraient facilité l’évolution précoce de l’ARN.
Photographie par Istock Images
Certaines des voies ne fonctionnent pas, et produisent même des erreurs. En 2016, le laboratoire de Szostak a publié un article dans Nature Chemistry qui montrait qu’un peptide aurait pu aider l’ARN à se répliquer sans enzymes. Peu de temps après, le chercheur Tivoli Olsen a rejoint le laboratoire et n’a pas pu reproduire ces résultats. Son examen de l’article a révélé que l’équipe avait mal interprété les données, et Szostak a rétracté l’article. « Nous travaillons sur des problèmes difficiles, et le plus difficile en science, comme l’a dit Feynman, je crois, c’est de ne pas se tromper soi-même », explique Szostak. La solution potentielle était passionnante, « et je pense que cela nous a aveuglés sur ce qui se passait ». Le « point positif », ajoute-t-il, est qu’ils ont découvert les erreurs par eux-mêmes, même s’il aurait souhaité que cela se produise « avant la publication de l’article plutôt qu’après. Je dirais que beaucoup de nos idées finissent par être fausses, mais en général, nous nous en rendons compte assez rapidement ».
Il est optimiste quant au potentiel des récentes découvertes faites dans d’autres laboratoires ; par exemple, John Sutherland, du Medical Research Council (MRC) Laboratory of Molecular Biology de Cambridge, en Angleterre, a récemment découvert une nouvelle technique d’activation des nucléotides – modifiant chimiquement ces éléments constitutifs pour alimenter le processus de réplication. Sutherland a partagé ces découvertes avec le laboratoire de Szostak avant qu’elles ne soient publiées, et Szostak dit qu’ils explorent des moyens d’incorporer cette technique dans leurs propres expériences.
Une fois que son équipe aura assemblé des protocellules fonctionnelles qui contiennent des morceaux d’ARN, ils s’attendent à ce que l’information dans certaines séquences d’ARN spécifiques confère un certain avantage à la protocellule qui l’entoure. Par exemple, des travaux antérieurs suggèrent que certaines séquences d’ARN pourraient se replier pour devenir un ribozyme capable de fabriquer des lipides légèrement plus évolués pour la membrane cellulaire. « Toute séquence d’ARN qui fait quelque chose qui aide ses propres cellules à survivre ou à se répliquer plus rapidement va commencer à prendre le contrôle de la population », explique Szostak. « C’est le début de l’évolution darwinienne. Et nous redevenons alors des biologistes. »
Après avoir remporté le prix Nobel, Szostak aurait pu quitter le laboratoire pour se consacrer aux voyages et aux invitations à des conférences, mais « il reste concentré sur la science », dit Gerald Joyce. « C’est ce que j’admire le plus chez lui ». Certains peuvent considérer la recherche fondamentale comme un luxe intellectuel, mais ses praticiens font valoir que toute science appliquée commence par des découvertes en science fondamentale. « Lorsque Crick et Watson se sont assis et ont commencé à faire des modèles en carton de la structure de l’ADN, ils n’avaient aucune idée que cela donnerait naissance à une industrie valant des milliards de dollars 70 ans plus tard », note John Sutherland.
Szostak reste déterminé à s’attaquer à ces grandes questions difficiles, en poursuivant le travail de plusieurs décennies. « J’espère pouvoir construire un système cellulaire évolutif avant de prendre ma retraite », dit-il. Il est optimiste quant à ses chances. « Je pense que nous sommes sur la bonne voie. Il reste encore quelques problèmes difficiles, puis je pense que tout sera résolu, je l’espère, d’ici quelques années. »