1Introduction
L’hépatite auto-immune (AIH) est une maladie hépatique chronique d’étiologie inconnue dont le mode de présentation est variable. La majorité des patients présentent un début chronique insidieux qui se manifeste par une élévation asymptomatique des enzymes hépatiques. Cependant, cette maladie peut se présenter sous forme d’hépatite aiguë, d’insuffisance hépatique fulminante, d’hépatite chronique insidieuse ou de cirrhose bien établie. Dans 20 à 30 % des cas, l’AIH provoque un ictère et un sous-ensemble de ces patients évolue vers une insuffisance hépatique fulminante ou subaiguë. Ce schéma n’a pas été décrit en détail dans la littérature médicale et représente un défi pour les médecins car il peut être très similaire à d’autres types d’hépatite aiguë ; de plus, il peut rapidement évoluer vers une insuffisance hépatique fulminante . Malheureusement, les critères du groupe international de l’hépatite A et les critères simplifiés ont un rôle limité dans la classification de ce sous-type d’hépatite A . Certains chercheurs ont suggéré que l’apparition aiguë de l’AIH pouvait être une séquence de poussées spontanées d’une maladie chronique préexistante. L’HTA aiguë touche tous les groupes d’âge, mais elle est plus fréquente chez les enfants et les jeunes adultes. L’insuffisance hépatique fulminante se développe plus souvent dans les groupes d’âge plus jeunes. Tokumoto et al. ont divisé l’AIH aiguë en deux types distincts sur la base des résultats cliniques et histologiques : le premier est une exacerbation aiguë d’une hépatite chronique et le second est une AIH aiguë avec des caractéristiques cliniques et histologiques d’hépatite aiguë sans signes de chronicité. Des taux élevés d’aminotransférases sériques et les caractéristiques histologiques classiques sont présents dans tous les types d’AIH. L’obstacle le plus urgent au traitement efficace de l’hépatite aiguë est l’obtention d’un diagnostic précis et la distinction de cette maladie des autres maladies hépatiques aiguës. Dans cette étude, nous visons à décrire la présentation clinique, la réponse au traitement et l’issue des patients atteints d’une IAH d’apparition aiguë.
2Matériels et méthodes
Cette étude de cohorte rétrospective, multicentrique, a inclus tous les patients adultes diagnostiqués avec une IAH dans trois hôpitaux de soins tertiaires à Riyad, en Arabie saoudite, entre janvier 1999 et décembre 2017. En l’absence de directives spécifiques ou de consensus sur le diagnostic de l’apparition aiguë de l’AIH, le diagnostic a été basé sur le système de notation révisé du groupe international AIH. Seuls les patients qui se sont présentés en phase aiguë avec une HALA certaine (score>15) ou une HALA probable (score 11-15) avec une réponse favorable aux stéroïdes ont été inclus. L’HTA aiguë a été définie comme l’apparition récente de symptômes d’hépatite (jaunisse, fatigue, douleur du quadrant supérieur droit et/ou anorexie) depuis moins de six mois et une augmentation minimale de 10 fois des transaminases sériques par rapport à la limite supérieure des valeurs normales chez une personne dont les tests de la fonction hépatique étaient sains depuis au moins six mois avant la présentation. Les patients atteints d’AIH qui ne remplissaient pas les critères d’AIH aiguë ont été qualifiés d’AIH classique et ont été exclus de cette analyse. Les patients dont on savait qu’ils souffraient d’autres maladies hépatiques aiguës ou chroniques, notamment d’hépatite virale (A, B, C), de maladies métaboliques, vasculaires ou d’autres maladies hépatiques auto-immunes (cholangite biliaire primaire ou cholangite sclérosante primaire) ont également été exclus. Les critères d’exclusion supplémentaires étaient l’exposition à des médicaments potentiellement hépatotoxiques dans les six mois précédant l’apparition des symptômes et une transplantation d’organe antérieure.
Données démographiques, antécédents médicaux, tests de laboratoire comprenant : tests de la fonction hépatique (TFH) : alanine transaminase (ALT), aspartate transaminase (AST), phosphatase alcaline (ALP), gamma-glutamyl transpeptidase, bilirubine totale (TB) et albumine sérique ; tests hématologiques : numération globulaire complète, rapport international normalisé (INR) ; tests immunologiques : anticorps antinucléaires (ANA), anticorps anti-muscle lisse (ASMA), anticorps anti-mitochondrial (AMA), anticorps microsomal foie-rein et immunoglobuline G (IgG) ont été collectés lors de la présentation initiale et à chaque visite de suivi. Les résultats histopathologiques, radiologiques et les médicaments prescrits ainsi que les résultats des tests de laboratoire ont été enregistrés lors des visites de suivi. Tous les patients ont subi une biopsie du foie avant le début du traitement. Le grade de l’inflammation et le stade de la fibrose de la biopsie du foie ont été rapportés selon le système de notation METAVIR. Le résultat du traitement a été rapporté en tant que réponse complète, partielle ou absence de réponse. La réponse complète était définie comme la normalisation des transaminases dans l’année suivant le traitement avec la disparition des symptômes, la réponse partielle était définie comme l’amélioration des transaminases d’au moins 50 % par rapport aux tests de base sans normalisation complète, et l’échec du traitement était utilisé pour indiquer l’absence d’amélioration de la TFL ou le fait que le patient était décédé ou avait dû subir une transplantation hépatique. Étant donné que notre objectif était d’analyser rétrospectivement la présentation clinique, la réponse biochimique et sérologique au traitement et les résultats des patients présentant une IAH d’apparition aiguë, des tests supplémentaires n’ont pas été tentés. En outre, en raison de la nature des essais rétrospectifs, il n’a pas été possible de calculer une taille d’échantillon avant l’étude, mais plutôt d’inclure tous les cas qui répondaient aux critères d’inclusion.
2.1Considérations éthiques
En raison de la nature rétrospective de cette étude, le consentement du patient n’était pas requis, cependant, l’étude a été approuvée par les conseils d’examen institutionnels des hôpitaux participants. Toutes les procédures ont été menées conformément à la Déclaration d’Helsinki de 1975.
2.2Analyses statistiques
Une analyse descriptive et inférentielle a été réalisée à l’aide du progiciel SPSS version 17 pour Windows (SPSS, Chicago, IL, USA). Les données catégorielles ont été décrites sous forme de fréquence et de pourcentage et comparées par le test du chi carré ou le test exact de Fisher. Les données numériques ont été décrites sous forme de moyenne et d’écart-type et comparées par le test t de Student pour les variables normalement distribuées ou sous forme de médiane et d’étendue et ont été comparées à l’aide du test U de Mann-Whitney si elles n’étaient pas normalement distribuées. Les variables pronostiques prédictives du résultat ont été déterminées à l’aide d’analyses de régression logistique univariées et multivariées. Les courbes de survie ont été estimées à l’aide de la méthode de Kaplan-Meier et les différences ont été comparées à l’aide du test du log-rank. Une valeur p de
0,05 a été considérée comme statistiquement significative.3Résultats
Pendant la période d’étude, 70 patients ont été diagnostiqués avec une HTA à début aigu. Les caractéristiques de base de ces patients sont présentées dans le tableau 1. L’âge moyen à la présentation était de 33,8±1,5 ans. Les femmes étaient les plus touchées et le ratio femmes/hommes était de 1,4:1. Les symptômes les plus courants étaient la jaunisse (94 %), suivie de la fatigue (44 %), des démangeaisons (31 %) et des douleurs abdominales (29 %). Un diabète sucré a été constaté chez sept patients (10 %) et une maladie thyroïdienne chez cinq patients (7,1 %). Des résultats positifs aux tests ANA et ASMA et une élévation des IgG ont été observés chez 61 %, 69 % et 86 % des patients respectivement. Les fréquences des marqueurs immunologiques positifs sont indiquées dans le tableau 2. Le taux moyen d’IgG était de 28,3±13,5, et le taux moyen d’IgM se situait dans la fourchette normale. Sur le plan biochimique, tous les patients présentaient une augmentation significative de leurs transaminases, 50 % avaient un INR élevé, et tous avaient une fonction rénale normale. Des taux normaux de TB ont été observés chez 5 % des patients atteints d’AIH aiguë, d’ALP chez 33 % et d’albumine chez plus de 40 %. Des biopsies hépatiques ont été réalisées chez tous les patients avant le début du traitement, mais les lames d’histopathologie n’étaient disponibles que pour 60 patients (86 %). Pour les 10 patients restants, le diagnostic s’est appuyé sur le rapport d’histopathologie disponible, qui décrivait tous une pathologie typique de l’AIH. Les résultats histologiques détaillés sont présentés dans le tableau 3. L’inflammation était sévère (grade 3) dans 70 % des cas et 38,7 % présentaient une fibrose avancée à la présentation (stade 3-4). Après un suivi médian de 85 mois (intervalle : 1-212), une réponse complète et une rémission clinique ont été obtenues chez 52 (74,3 %) patients et une réponse incomplète chez 10 (14,3 %). Seuls deux patients (2,86%) ont nécessité une transplantation hépatique et six (8,6%) sont décédés au cours de l’événement aigu.
Caractéristiques démographiques, cliniques et de laboratoire de base des patients présentés avec une hépatite aiguë auto-immune.
| Variables | HAI aiguë | |
|---|---|---|
| . n=70 | % | |
| Caractéristiques démographiques | ||
| Age (Moyenne±SD) | 33.8±1,5 | |
| Sexe | ||
| Femme | 41 | 58,6% |
| Homme | 29 | 41.4% |
| Présentation clinique | ||
| Jaunisse | 66 | 94.3% |
| Fatigue | 30 | 43.5% |
| Prurit | 22 | 31.4% |
| Douleurs abdominales | 20 | 28.6% |
| Fièvre | 12 | 17.1% |
| Hépatomégalie | 6 | 8.6% |
| Splénomégalie | 6 | 8.6% |
| Douleurs articulaires | 5 | 7,1% |
| Facteurs de laboratoire | ||
| Bilirubine (mmol/L) : Moyenne±SD | 210±181,8 | |
| Albumine (g/L) : Moyenne±SD | 32,5±7,0 | |
| AST (U/L) : Moyenne±SD | 699±423 | |
| ALT (U/L) : Moyenne±SD | 733±463.6 | |
| ALP (U/L) : Moyenne±SD | 258,8±194,6 | |
| GGT (U/L) : Moyenne±SD | 190,3±256,2 | |
| Taux d’IgG (g/L) : Moyenne±SD | 28,3±13,5 | |
| Leucocytes (109/L) : Moyenne±SD | 7,2±3,05 | |
| Hémoglobine (g/L) : Moyenne±SD | 12,7±2,0 | |
| Plaquettes (109/L) : Moyenne±SD | 272±99,9 | |
| INR (Moyenne±SD) | 1,6±0,6 | |
AIH : hépatite auto-immune. SD : écart-type. AST : aspartate aminotransférase. ALT : alanine aminotransférase. ALP : phosphatase alcaline. GGT : gamma-glutamyl-transférase. IgG : immunoglobuline G. INR : international normalized ratio.
Marqueurs immunologiques de tous les patients présentés avec une HTA à début aigu.
| Variables | n (%) |
|---|---|
| Positif ANA | 43 (61,4%) |
| Positif ASMA | 48 (68.6%) |
| Positif ANA/ASMA ou les deux | 62 (88,6%) |
| Positif Anti-LKM | 2 (2.9%) |
| Positif ANCA | 3 (4,3%) |
| Positif ANA+ASMA | 22 (31.4%) |
| Négatif ANA+ASMA | 8 (11,4%) |
| High IgG | 60 (85.7%) |
| Haute IgM | 3 (4,3%) |
AIH : hépatite auto-immune. ANA : anticorps antinucléaire. ASMA : anticorps anti-muscle lisse. Anti-LKM : anticorps microsomal foie/rénale. ANCA : anticorps cytoplasmiques antineutrophiles. IgG : immunoglobuline G. IgM : immunoglobuline M.
Caractéristiques histologiques sur la biopsie hépatique de 60 patients atteints d’IAH aiguë.
| Caractéristiques histologiques | Recherche | Fréquence (%) | |
|---|---|---|---|
| Infiltrat de cellules plasmatiques | Non présent | 3 | (5) |
| Peu nombreux | 7 | (11.7) | |
| Modérée | 30 | (50) | |
| Abondante | 20 | (33.3) | |
| Modifications inflammatoires | |||
| Hépatite d’interface | Présent. | 57 | (95) |
| Inflammation lobulaire | Présent | 23 | (38.3) |
| Nécrose centrolobulaire | Présent | 20 | (33.3) |
| Inflammation canalaire | Présent | 12 | (20) |
| Grades d’inflammation | Doux | 4 | (6.7) |
| Modérée | 14 | (23.3) | |
| Sévère | 42 | (70) | |
| Stades de fibrose | Stade 0-1 | 19 | (31.7) |
| Stage 2 | 18 | (30) | |
| Stage 3 | 14 | (23.3) | |
| Stade 4 | 9 | (15) | |
D’après l’analyse univariée, aucune variable statistiquement significative n’a été trouvée pour prédire la réponse au traitement dans cette cohorte, cependant, cela pourrait être une erreur de type II en raison de la petite taille de l’échantillon (tableau 4). D’autre part, l’âge plus élevé au moment de la présentation était un facteur prédictif de mauvais résultats dans l’analyse univariée et multivariée (tableaux 5 et 6). Nous avons étudié le taux de progression de la maladie et le mauvais résultat (transplantation hépatique ou décès) par rapport au stade de la fibrose hépatique et avons constaté une progression plus lente et un meilleur résultat chez les patients présentant une fibrose légère par rapport à ceux présentant une fibrose sévère (Fig. 1). Tous les patients ont reçu une induction avec des doses modérées de prednisolone orale (30-60 mg par jour) avec une diminution hebdomadaire progressive et un traitement ultérieur (généralement dans les 2-4 semaines) avec de l’azathioprine (50 mg par jour, dose ajustée en fonction de la réponse). Les deux patients qui n’ont pas obtenu de réponse complète sont passés au mycophénolate.
Prédicteurs de la réponse chez les patients atteints d’une IAH à début aigu par analyse univariée.
| Variables | Rémissionn=52 | Non rémissionn=18 | Valeur P |
|---|---|---|---|
| Age (Moyenne±SD) | 32.7±1,4 | 37,0±1,8 | 0,28 |
| Sexe (homme) (%) | 38.5% | 50% | 0,39 |
| Diabète sucré (%) | 7,7% | 16.7% | 0,27 |
| Maladie thyroïdienne (%) | 9,6% | 0% | 0,17 |
| Birubine totale : Médiane (plage) | 137 (14-623) | 204 (14-664) | 0,60 |
| ALT : Médiane (plage) | 573 (400-2368) | 548 (400-1312) | 0.79 |
| ANA (%) | 63,8% | 57,1% | 0,64 |
| ASMA (%) | 63.5% | 83,3% | 0,12 |
| IgG : Médiane (gamme) | 24.1 (10,0-74,7) | 31 (15,0-58,1) | 0,25 |
| Inflammation (grade) (1/2/3)a | 15,4/30,7/53,8% | 6,5/21,7/71,8% | 0.63 |
| Fibrose (stade) (0-2/3-4)a | 53,8/46,2% | 64,4/35,6% | 0,14 |
AIH : hépatite auto-immune. ALT : alanine aminotransférase. ANA : anticorps antinucléaire. ASMA : anticorps anti-muscle lisse. IgG : immunoglobuline G.
Le grade d’inflammation et le stade de fibrose ont été rapportés selon le système de notation METAVIR.
Variables prédictives associées à la mauvaise issue (Décès ou transplantation hépatique) dans l’AIH aiguë par analyse univariée.
| Variables | Extension favorableN=62 | Extension défavorableN=8 | Valeur P |
|---|---|---|---|
| Age (Moyenne±SD) | 32.2±1,3 | 46,1±2,0 | 0,01 |
| Sexe (homme) (%) | 43.5% | 25% | 0,32 |
| Diabète sucré (%) | 8,1% | 25% | 0.13 |
| Maladie thyroïdienne (%) | 8,1% | 0 | 0,41 |
| Birubine totale : Médiane (plage) | 134 (14-664) | 205 (38-461) | 0,47 |
| ALT : Médiane (plage) | 576 (400-2368) | 554 (400-776) | 0.96 |
| INR : Médiane (intervalle) | 1,4 (1-4,1) | 1,5 (1,1-3,1) | 0.82 |
| ANA | 62,3% | 66,7% | 0,88 |
| ASMA | 66.1% | 87,5% | 0,22 |
| IgG : Médiane (intervalle) | 23,7 (10-74.7) | 32 (13,0-58,2) | 0,44 |
| Inflammation (1/2/3)a | 9/19.6/71,4% | 12,5/37,5/50% | 0,41 |
| Fibrose (0-2/3-4)a | 30.6% | 75% | 0,01 |
AIH : hépatite auto-immune. ALT : alanine aminotransférase. ANA : anticorps antinucléaire. ASMA : anticorps anti-muscle lisse. IgG : immunoglobuline G.
Le grade d’inflammation et le stade de fibrose ont été rapportés selon le système de notation METAVIR.
Analyse multivariée des variables contribuant à la prédiction d’une issue défavorable (décès ou transplantation hépatique) dans l’IAH à début aigu.
| Variables | OR | 95% CI | Valeur P | |
|---|---|---|---|---|
| Age | 1.109 | 1,011 | 1,216 | 0,03 |
| Genre | 6,309 | 0.215 | 184,836 | 0,29 |
| Diabète sucré | 0,763 | 0,040 | 14,412 | 0,86 |
| Birubine totale | 1.000 | 0,994 | 1,007 | 0,92 |
| ALT | 0,999 | 0,994 | 1,007 | 0.55 |
| INR | 1.784 | 0.449 | 7.092 | 0.41 |
| IgG | 1.010 | 0.920 | 1.109 | 0,83 |
| Fibrose avancée | 7,988 | 0,630 | 101,292 | 0,11 |
OR : odds ratio. CI : intervalle de confiance. ALT : alanine aminotransférase. INR : rapport international normalisé. IgG : immunoglobuline G.
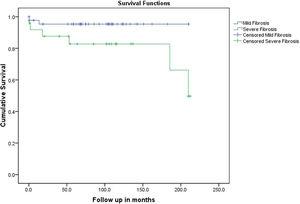
Le taux de progression vers un résultat médiocre (décès ou transplantation hépatique) en fonction du stade de fibrose.
4Discussion
Dans cette étude, nous avons analysé les caractéristiques cliniques, biochimiques et histologiques ainsi que les résultats du traitement et la mortalité chez les patients atteints d’AIH à début aigu. Cette présentation est unique et diffère de l’AIH classique. Dans une étude précédente, nous avons montré que près d’un tiers des patients atteints d’HAI présentaient un tableau aigu au moment du diagnostic. Ce chiffre était proche des 36,4 % rapportés pour l’Arabie saoudite occidentale. D’autre part, les rapports internationaux sur l’apparition aiguë de l’AIH ont révélé des taux différents selon les études. Par exemple, lorsque le diagnostic de la présentation aiguë était basé sur les paramètres biochimiques, l’apparition aiguë de l’AIH variait de 5,6 % à 26 % . Cependant, lorsque la définition de la présentation aiguë était basée sur les caractéristiques histologiques et la présence d’une nécrose centrolobulaire (NCL), le taux d’apparition de l’HTA aiguë augmentait à 31,7 % et jusqu’à 87 % dans certains rapports. Dans notre cohorte, l’âge de présentation de l’HTA aiguë n’était pas différent de celui rapporté pour l’HTA classique. Cependant, l’âge moyen de nos patients est beaucoup plus bas que celui de certaines études internationales qui ont rapporté un âge moyen de 42-58 ans . De plus, l’HTA aiguë touche un large éventail de groupes d’âge (de 13 à plus de 80 ans). La majorité de nos patients étaient des femmes, un profil typique des maladies auto-immunes, y compris l’AIH, et nous avons confirmé que la forme aiguë n’était pas une exception. Sur la base des paramètres biochimiques et histologiques, plusieurs rapports antérieurs sur l’apparition aiguë de l’AIH ont subdivisé la maladie en deux catégories : l’apparition aiguë véritable (authentique) de l’AIH et l’exacerbation aiguë d’une AIH chronique préexistante. Cela correspond à notre étude, dans laquelle 8,6 % des patients présentaient des signes de splénomégalie, ce qui suggère une hypertension portale, et les biopsies hépatiques de près de 40 % présentaient une fibrose avancée. Cette constatation n’est pas inhabituelle étant donné que l’AIH se caractérise par une évolution insidieuse avec des phases d’exacerbation et de rémission. Les systèmes d’évaluation diagnostique originaux et simplifiés de l’AIH sont moins précis pour le diagnostic de l’AIH aiguë. Cela représente traditionnellement un défi diagnostique qui entraîne des retards dans le diagnostic et, par conséquent, dans l’initiation de l’immunosuppression . De tels retards dans la prise en charge de la maladie peuvent permettre la progression de la maladie vers la forme fulminante de l’AIH, qui peut nécessiter une transplantation hépatique immédiate. Dans notre cohorte, le suivi relativement long nous a permis de prendre en compte la réponse au traitement et d’identifier des cas qui auraient pu être exclus sur la base de leurs scores initiaux. Nous avons utilisé des taux de transaminases élevés de plus de 10 fois la limite supérieure normale dans le cadre de la définition de l’hépatite aiguë. Des rapports précédents ont utilisé une définition similaire pour l’apparition de l’hépatite aiguë avec une ALT sérique de 5 à 10 fois la limite supérieure normale. Le profil auto-immun a montré que la positivité des ANA et ASMA était isolée ou les deux ensemble dans environ 90 % des cas. Ce chiffre est similaire aux rapports de Yamamoto et al. et de Fujiwara et al. mais supérieur à celui décrit par d’autres. Un taux élevé d’IgG sériques est un indicateur biochimique important utilisé dans le diagnostic de l’AIH. Dans la présente étude, les taux d’IgG étaient plus élevés que ce que nous avions précédemment rapporté pour l’AIH classique. Alors que Dohmen et al. ont rapporté une tendance similaire, certains auteurs ont rapporté des taux d’IgG sériques plus faibles par rapport à l’AIH chronique et des IgG normaux chez environ 30 à 47% des patients. L’analyse histologique a révélé que la majorité de nos patients présentaient une inflammation modérée à sévère, cependant, il n’était pas clair si cela avait un impact sur le pronostic global.
La fibrose était très répandue dans cette cohorte de patients malgré leur présentation aiguë et était associée à une faible survie. De même, des études antérieures sur l’AIH à début aigu ont trouvé une inflammation aiguë sévère avec CLN chez les patients atteints d’AIH à début aigu . Plusieurs chercheurs ont montré que 55 à 65 % des patients atteints d’une forme aiguë de l’HTA présentaient des signes de chronicité à l’examen histologique. La réponse globale initiale au traitement était excellente, avec un taux de réponse complète de 80 %. Plusieurs rapports ont montré que le taux de réponse au traitement de l’AIH aiguë était similaire à celui de l’AIH chronique, mais les taux de réponse rapportés varient de 36 à 100 %. Yamamoto et al. ont constaté que l’utilisation de stéroïdes pulsés n’influençait pas l’issue du traitement par rapport à un régime conventionnel de dosage des stéroïdes. Cette différence observée dans le taux de réponse peut provenir de définitions différentes de l’apparition aiguë de l’AIH employées pour le diagnostic.
L’échec du traitement peut entraîner une progression vers la forme fulminante de l’apparition aiguë de l’AIH, qui nécessite une transplantation hépatique urgente et entraîne la mortalité. Dans cette étude, 2,9 % des patients atteints d’une forme aiguë d’AIH ont dû subir une transplantation hépatique, un taux similaire à celui rapporté par Yamamoto et al. En revanche, Yeoman et al. ont rapporté un taux de transplantation hépatique de 48% dans leur cohorte, ce qui pourrait être dû au fait qu’ils ont inclus des patients atteints de formes graves (fulminantes) de l’AIH aiguë. Environ un cinquième de nos patients n’ont pas obtenu de rémission. Ces patients sont plus susceptibles d’évoluer vers une issue fulminante, voire vers la mortalité. Yamamoto et al. ont montré que la présentation aiguë sévère de l’AIH, mais pas l’exacerbation aiguë de l’AIH chronique, était plus susceptible d’évoluer vers la mort au cours du suivi. Malheureusement, dans le cas de l’AIH, il n’existe pas de biomarqueurs spécifiques et mesurables en corrélation avec la pathogenèse, la progression de la maladie, les rechutes, les rémissions ou la réponse au traitement. Cependant, certains biomarqueurs sont utilisés comme d’importants indicateurs thérapeutiques : les acides micro-ribonucléiques, la mort programmée soluble-1 (sPD-1), le facteur d’inhibition de la migration des macrophages (MIF), le CD163 soluble, le facteur d’activation des cellules B (BAFF) et les schémas métaboliques dans le sang. Il a été proposé que ces marqueurs possèdent des caractéristiques spécifiques qui potentialisent leur importance en tant que marqueurs de substitution du processus inflammatoire, qui peuvent être surveillés pendant le traitement. Nishikawa et al. ont signalé que les taux sériques de BAFF et de la protéine 10 inductible par l’interféron-γ (IP-10) sont utiles pour évaluer le degré d’inflammation du foie dans l’AIH . Aarslev et al. ont étudié des patients atteints d’AIH active, présentant une réponse partielle et une réponse complète au traitement standard. Ils ont constaté que les taux de sPD-1 étaient plus élevés chez les patients souffrant d’AIH active et chez les répondeurs partiels que chez les répondeurs complets. Assis et al. ont démontré qu’un polymorphisme du MIF est associé à la sévérité de la maladie dans l’AIH, comme indiqué par une ALT élevée, et nécessite une stéroïdothérapie continue.
La présente étude présente quelques limites. Nous n’avons pu tester aucun des biomarqueurs susmentionnés car ils n’étaient pas disponibles pour la pratique clinique quotidienne dans nos centres. Un profilage biochimique étendu devrait être inclus dans les études futures pour faciliter l’identification des biomarqueurs pronostiques. La nature rétrospective de cette étude et l’absence d’un protocole standardisé pour le traitement et le suivi limitent également notre capacité à établir des liens de causalité entre les données. De futures études prospectives, multicentriques et à long terme sont nécessaires pour mieux comprendre la maladie et éclairer son diagnostic, en particulier pour les patients atteints d’hépatite aiguë dont l’étiologie n’est pas claire. Les avantages de cette étude sont qu’il s’agit d’une étude multicentrique avec un nombre relativement élevé de patients, étant donné la nature peu commune de la maladie en question. En outre, la longue durée du suivi a permis une enquête sans précédent sur les résultats du traitement à long terme de l’hépatite aiguë. Cette étude a mis en lumière plusieurs aspects cliniquement pertinents d’une maladie relativement rare et peu étudiée dans le monde. Les résultats décrits ici confirment que le diagnostic précoce et le traitement en temps opportun sont essentiels pour arrêter la progression vers l’insuffisance hépatique, réduire le besoin de transplantation hépatique et augmenter la survie.
5Conclusion
L’apparition aiguë de l’AIH est une maladie qui nécessite un diagnostic et une prise en charge précoces pour garantir une issue favorable au patient. Dans cette étude, nous avons décrit les caractéristiques cliniques, biochimiques et histologiques de cette maladie en plus de la réponse à long terme au traitement et de la survie. Des transaminases et des IgG élevées avec des ANA et des ASMA positifs sont les signes distinctifs de l’apparition aiguë de l’AIH, cependant, l’absence de ces paramètres n’exclut pas totalement un diagnostic positif. Une grande proportion de nos patients présentait une fibrose et une cirrhose considérables malgré la présentation aiguë. Dans l’ensemble, nous avons observé une excellente réponse initiale au traitement ; cependant, la mortalité à long terme était plus élevée que dans la population générale des patients, en particulier pour les patients atteints de cirrhose.
Abréviations
AIH
hépatite auto-immune
LFTs
tests de la fonction hépatique
ALT
alanine transaminase
AST
aspartate transaminase
ALP
phosphatase alcaline
GGT
gamma-glutamyl transférase
TB
bilirubine totale
INR
rapport international normalisé
ANA
anticorps antinucléaire
ASMA
anticorps anti-muscle lisse
.muscle lisseAMA
anticorps anti-mitochondrial
IgG
immunoglobuline G
IgM
immunoglobuline M
Soutien financier
Les auteurs de ce manuscrit n’ont reçu aucune subvention ou financement d’organismes publics ou commerciaux.
Conflits d’intérêts
Aucun conflit d’intérêts à divulguer.