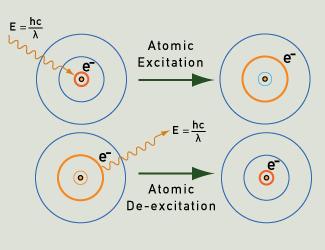
Les photons de la lumière sont émis lorsqu’un électron retombe dans son état fondamental après avoir été excité.
Les essais de flamme
Les essais de flamme sont utiles parce que les excitations gazeuses produisent un spectre d’émission de raies caractéristiques pour un élément. En comparaison, l’incandescence produit une bande continue de lumière dont le pic dépend de la température de l’objet chaud.
Lorsque les atomes d’un gaz ou d’une vapeur sont excités, par exemple par chauffage ou par l’application d’un champ électrique, leurs électrons sont capables de passer de leur état fondamental à des niveaux d’énergie plus élevés. Lorsqu’ils retournent à leur état fondamental, en suivant des trajectoires clairement définies selon des probabilités quantiques, ils émettent des photons d’une énergie très spécifique. Cette énergie correspond à des longueurs d’onde particulières de la lumière, et produit donc des couleurs particulières de la lumière. Chaque élément possède une « empreinte digitale » en termes de spectre d’émission de raies, comme l’illustrent les exemples ci-dessous.

Spectre de raies pour l’hydrogène.

Spectre de raies pour l’hélium.

Spectre de ligne pour le néon.
Parce que chaque élément a un spectre d’émission de ligne exactement défini, les scientifiques sont capables de les identifier par la couleur de la flamme qu’ils produisent. Par exemple, le cuivre produit une flamme bleue, le lithium et le strontium une flamme rouge, le calcium une flamme orange, le sodium une flamme jaune et le baryum une flamme verte.

Cette image illustre les couleurs distinctives produites par la combustion d’éléments particuliers.

Une flamme provenant d’un chalumeau oxyacétylénique brûle à plus de 3000 ?C, assez chaude pour être utilisée pour la soudure sous-marine.
Flamme
La couleur nous renseigne sur la température de la flamme d’une bougie. Le cœur interne de la flamme de la bougie est bleu clair, avec une température d’environ 1670 K (1400 °C). C’est la partie la plus chaude de la flamme. La couleur à l’intérieur de la flamme devient jaune, orange, et enfin rouge. Plus on s’éloigne du centre de la flamme, plus la température est basse. La partie rouge se situe autour de 1070 K (800 °C).
Les couleurs orange, jaune et rouge dans une flamme ne sont pas uniquement liées à la température de la couleur. Les excitations des gaz jouent également un rôle important dans la couleur de la flamme. L’un des principaux constituants d’une flamme brûlante est la suie, qui a une composition complexe et diverse de composés de carbone. La variété de ces composés crée une gamme pratiquement continue d’états quantiques possibles vers lesquels les électrons peuvent être excités. La couleur de la lumière émise dépend de l’énergie émise par chaque électron retournant à son état initial.