La production d’énergie renouvelable ne répond pas toujours à la demande. Ceci pour la simple raison que les consommateurs peuvent souhaiter utiliser de l’énergie lorsque le soleil ne brille pas ou que le vent ne souffle pas. Les batteries peuvent être utilisées pour équilibrer ce problème de production et de demande. Les batteries peuvent se charger lorsque l’énergie est produite et se décharger lorsque l’énergie est nécessaire.
Les batteries peuvent également faire beaucoup plus que simplement équilibrer la production et la demande d’énergie. Les batteries peuvent aider à une vaste gamme d’applications de réseau, y compris les services de secours, la génération d’inertie synthétique et la conversion de l’énergie non synchrone en énergie synchrone. Ce sont tous des services qui sont essentiels pour le fonctionnement fiable d’un réseau électrique.
Alors, comment fonctionnent les batteries ?
Les batteries comportent trois parties essentielles :
- une électrode positive ;
- une électrode négative ; et
- un électrolyte qui sépare les électrodes.
Des électrodes et des électrolytes différents produisent des réactions chimiques différentes qui affectent le fonctionnement de la batterie. C’est pourquoi il existe une grande diversité de batteries sur le marché et en cours de développement. Les différentes caractéristiques des batteries comprennent:
- la taille;
- la capacité de stockage;
- le taux de réponse;
- le taux de recharge;
- la durée de vie;
- la sécurité;
- les coûts ; et
- la recyclabilité.
La batterie redox au vanadium (VRB) est l’une des dernières batteries à émerger sur le marché commercial. Elle est particulièrement prometteuse en raison de sa très grande capacité de stockage. D’un point de vue environnemental, la VRB est également prometteuse. La VRB ne produit pas de déchets et a une longue durée de vie. Les produits chimiques contenus dans un VRB n’ont pas besoin d’être remplacés et peuvent être utilisés à l’infini. Seuls le boîtier et le matériel du VRB doivent être remplacés. La longue durée de vie signifie également que le VRB a le potentiel d’être une alternative à faible coût par rapport aux autres options.
Le VRB a une chambre positive et une chambre négative séparées par une membrane. La chambre positive comporte une électrode positive et la chambre négative comporte une électrode négative. Des électrolytes de vanadium circulent dans les deux chambres : – un électrolyte ou une espèce de vanadium positif dans la chambre positive, et une espèce négative dans la chambre négative. Les chambres sont reliées à des réservoirs de stockage afin que de grands volumes d’électrolytes au vanadium puissent être pompés et circuler dans les chambres. La membrane empêche les électrolytes positifs et négatifs de se mélanger, mais permet aux ions (atomes ayant une charge positive ou négative) de passer à travers.
Lorsque le VRB est chargé et déchargé, les espèces de vanadium subissent simultanément une oxydation et une réduction, transférant des électrons à travers la membrane. La réaction d’oxydation-réduction est connue comme une réaction d’oxydoréduction. La réduction consiste à gagner des électrons. L’oxydation implique la perte d’électrons. Pendant la charge, l’électrolyte de la chambre positive est oxydé et l’électrolyte de la chambre négative est réduit. Pendant la décharge, le processus est inversé et l’électrolyte de la chambre positive est réduit tandis que l’électrolyte de la chambre négative est oxydé.
La réaction d’oxydoréduction de la charge peut être utilisée pour stocker l’électricité lorsqu’elle est produite et la réaction d’oxydoréduction de la décharge peut fournir de l’électricité lorsqu’elle est demandée. La VRB a une efficacité de charge/décharge de 75% à 80%.
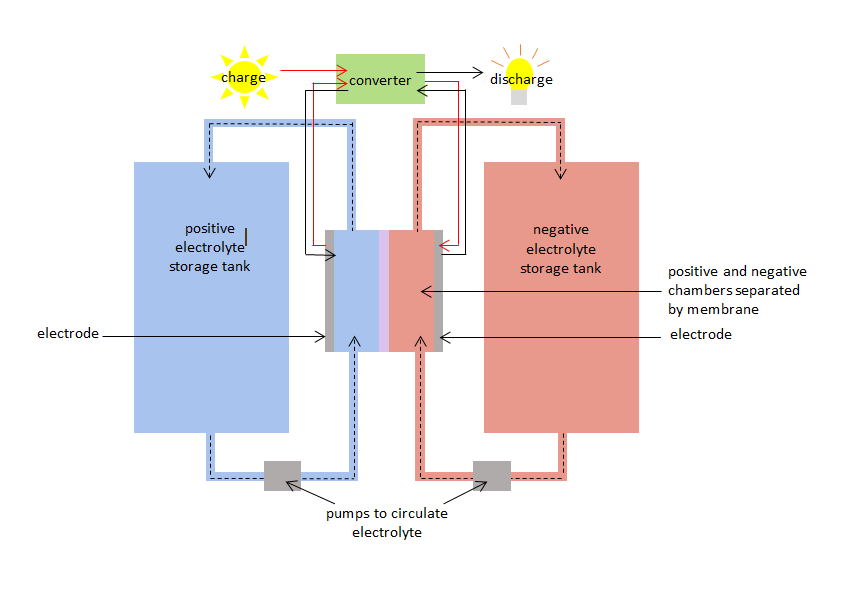
Diagramme de la batterie redox au vanadium
.