Les interactions entre le cerveau et le processus de coagulation ont une longue histoire, y compris l’observation que le mécanisme de coagulation au sein du système nerveux central a un certain nombre de différences par rapport à celui trouvé dans d’autres organes – l’endothélium du cerveau exprimant peu de thrombomoduline, par exemple.
Quel que soit le mécanisme, il est difficile d’éviter l’observation que le traitement par anticoagulation (par ex, avec de l’héparine de faible poids moléculaire) inverse souvent de façon spectaculaire les symptômes, y compris la migraine, les difficultés de mémoire et la chorée. De telles observations suggèrent que la pathologie cérébrale dans de nombreux cas ne serait pas tant l’infarctus, mais pourrait être davantage liée à une « boue » de l’apport sanguin et à une oxygénation altérée.
Migraine &Accident vasculaire cérébral
« Avez-vous souffert de maux de tête à l’adolescence ? »
« Oui, docteur. Ils étaient presque hebdomadaires pendant un certain temps. Ils ont disparu pendant quelques années, mais ils sont revenus avec une vengeance maintenant. Ils sont courants dans ma famille. »
C’est ainsi que parle la patiente de 30 ans atteinte d’un SAP (les membres masculins de la famille apparaissent moins souvent dans les cliniques de SAP).
C’est un indice diagnostique si important dans l’évaluation d’un patient atteint d’un possible SAP. Pourtant, malgré de nombreuses années d’expérience du SAPL, il existe étonnamment peu de données évaluant le véritable rôle du SAPL dans le monde plus large de la migraine. Il y a tant de raisons d’étudier l’association – la réponse à l’anticoagulation – généralement bonne, souvent frappante – l’étude des frères et sœurs et des autres membres de la famille des patients migraineux ou atteints de SAP. Et par-dessus tout, les liens qui sont maintenant signalés entre la migraine et l’accident vasculaire cérébral.
Le SAP/Hughes syndrome est très largement une affection neurologique. La fonction cérébrale semble en effet particulièrement visée – plus on voit de patients atteints du SAP, plus &les ondes neuropsychiatriques se propagent.
Comme la migraine, l’accident vasculaire cérébral est l’une des complications reconnues du SAP/Syndrome de Hughes. Des chiffres allant jusqu’à 1 sur 5 jeunes AVC (moins de 45 ans) ayant des tests positifs pour l’aPL ont été rapportés.14-19
Cependant, comme pour la migraine, la reconnaissance de l’aPL dans l’étiologie de l’AVC est, en général, encore faible. Par exemple, l’AVC chez l’enfant – bien reconnu cliniquement – est une cible de choix pour les études sur les aPL.
Il y a quelques années, le gouvernement britannique a lancé une initiative majeure sur l’AVC, en éduquant le public sur les symptômes, les signes et le traitement de l’AVC. Le syndrome des antiphospholipides ne figurait pas sur la liste.
Crises d’épilepsie
En 1985, nous avons observé que chez les patients atteints de lupus, les crises d’épilepsie étaient plus fréquentes chez les patients dont les tests aPL étaient positifs.20 Depuis, il est devenu clair que l’épilepsie, sous toutes ses formes, est un accompagnement important du SAP. À tel point que dans une étude sur l’épilepsie idiopathique chez les adolescents, 1 sur 5 s’est avéré être positif au test aPL.21

Le dépistage initial de la sage-femme ou de l’obstétricien devrait inclure un simple questionnaire pour exclure le STA.
Crédit image : SPL/Science Source
Les ramifications de ces observations sont nombreuses. Permettez-moi de donner deux exemples cliniques :
Premièrement, l’épilepsie du lobe temporal dans le STA peut être sous-reconnue. L’une de mes patientes, une femme atteinte de SPA classique, est devenue technicienne EEG. Pendant sa formation, elle a utilisé quatre de ses frères et sœurs comme cobayes. Trois d’entre eux présentaient une activité anormale du lobe temporal. Il est intéressant de voir combien de fois des antécédents familiaux d’épilepsie apparaissent dans l’anamnèse des patients atteints de SAP.
La deuxième anecdote clinique a été publiée ailleurs.22 Une patiente de 42 ans avait des antécédents de lupus léger. Cependant, son principal problème – qui avait un impact important sur sa vie active – était des crises récurrentes, à la fois de petit mal et de grand mal, ces dernières nécessitant des soins spécialisés et l’association de plusieurs médicaments antiépileptiques. Pendant son séjour à Londres, elle a développé une TVP (elle était aPL positive) et une anticoagulation de routine avec de la warfarine a été mise en place. Un bonus immédiat et inattendu a été une réduction marquée de la fréquence et de la gravité des crises, nécessitant un traitement antiépileptique beaucoup moins agressif.
‘THE STILLBIRTH SCANDAL : Chaque jour, pas moins de trois bébés au Royaume-Uni sont mort-nés alors qu’ils auraient pu vivre. Une naissance sur 200 chez les femmes britanniques sera mort-née. Il est temps pour le NHS d’adapter de nouvelles politiques et une nouvelle attitude’. -The Times (Londres), 28 nov. 2012
Perte de mémoire
La manifestation la plus courante de la SPA est probablement la perte de mémoire. Souvent, le problème ne voit la lumière du jour que lorsqu’on interroge le patient sur ce symptôme. Ainsi, de nombreux patients avouent s’inquiéter de la maladie d’Alzheimer. À ce jour, les études cliniques détaillées sont rares. De temps en temps, et, il faut bien le dire, de façon assez désultrative, nous avons effectué des tests psychométriques sur certains patients atteints de SPA, et les résultats ont souvent été surprenants. D’autant plus, étant donné l’amélioration frappante observée dans les tests de mémoire lorsque l’anticoagulation est commencée.23
Sclérose multiple
En raison de la proéminence des caractéristiques neurologiques, y compris les troubles visuels et la myélopathie fluctuante, observés dans le SAP, il n’est pas surprenant qu’un certain nombre de cas soient diagnostiqués comme étant une SEP.24,25
Le sujet est loin d’être simple. Certains en neurologie déclarent que des tests aPL positifs sont, en fait, parfois observés dans la SEP classique. Je préférerais inverser le tableau. Ces patients, du moins certains d’entre eux, peuvent être d’abord atteints de SPA et ensuite de SEP. Bien que, de manière anecdotique, un certain nombre de ces cas répondent à l’anticoagulation, dans d’autres cas, la réponse est, au mieux, limite. Uthman a récemment passé en revue la littérature assez substantielle sur le STA par rapport à la SEP.26
Autres caractéristiques neurologiques
Il s’agit notamment de troubles de l’équilibre (un certain nombre de cas se présentant comme une maladie de Ménière), de chorée (parfois grave),27,28 d’anosmie, de troubles du sommeil (y compris cataplexie et narcolepsie) et, récemment, de troubles autonomes avec une série de cas de POTS (syndrome de tachycardie orthostatique posturale).29
L’une des questions sur lesquelles il y a débat est la prévalence des manifestations psychiatriques.
J’ai toujours pensé que la psychose aiguë était plus une caractéristique du lupus que du SAP, mais en cela je peux me tromper. Une de mes patientes, une femme atteinte de STA et de TOC (trouble obsessionnel compulsif), s’est améliorée avec un traitement anticoagulant. Il est intéressant de noter que son fils adolescent, également un patient souffrant de TOC (et positif à l’aPL), a constaté que les manifestations neuropsychiatriques étaient beaucoup moins importantes lorsqu’un traitement à l’aspirine a été instauré.
Pas le cerveau
Articulations des os &-Avez-vous souffert de fractures ? Une question qui ne fait peut-être pas partie de l’anamnèse de routine chez les patients atteints de SPA. Et pourtant, les fractures osseuses spontanées commencent à être bien reconnues après le rapport de 27 fractures métatarsiennes spontanées par le Dr Shirish Sangle chez des patients atteints de SPA.30
Des rapports anecdotiques suggèrent que les fractures osseuses (ischémiques) peuvent être une manifestation importante de la maladie : Mon collègue, le professeur Munther Khamashta, a un patient atteint du syndrome de Hughes avec des études DEXA et parathyroïdiennes normales qui a subi 57 fractures spontanées. Il s’agit clairement d’un domaine important pour la recherche clinique.
De même, les douleurs de hanche dues à la nécrose avasculaire (AVN) ne sont pas rares chez nos patients atteints du SAP. L’IRM a montré une AVN précoce dans certains cas sans autres facteurs de risque, comme les stéroïdes. Mon impression clinique est que la douleur à la hanche s’améliore souvent lorsqu’on commence à administrer de l’héparine ou de la warfarine.
Cœur – Une préoccupation majeure est la présence d’angine et d’autres symptômes cardiaques dans le STA. Malgré quelques rapports précoces d’ischémie myocardique et de thrombose coronaire, ce n’est qu’au cours des dernières années que les publications révélant une fréquence élevée de ces complications ont augmenté.
Deux exemples sont les recherches de Greco et al montrant une prévalence relativement élevée de tests aPL positifs chez les patients souffrant d’ischémie cardiaque, et l’observation frappante que les femmes fumeuses sous pilule qui étaient aPL positives avaient un risque relatif de 22 fois pour le développement d’un infarctus du myocarde.31,32
Les liens cardiaques sont accrus par le signalement d’une association avec le syndrome cardiaque X, une angine avec des coronarographies normales.33 Il y a fort à parier que le test aPL deviendra une norme dans la clinique de cardiologie, en particulier chez les femmes symptomatiques de moins de 40 ans.
Comme la migraine, l’accident vasculaire cérébral est l’une des complications reconnues du syndrome APS/Hughes. Des chiffres allant jusqu’à 1 accident vasculaire cérébral sur 5 chez les jeunes (moins de 45 ans) ayant des tests aPL positifs ont été rapportés.
Trajet GI &foie-Depuis que nous avons fait nos observations sur les lésions sténotiques focales dans diverses artères, y compris les artères cœliaques et mésentériques, nous nous sommes davantage concentrés sur les symptômes d’angine abdominale chez les patients atteints d’aPL/APS34. Il s’agit d’une condition difficile à quantifier, mais nous avons vu un certain nombre de cas dans lesquels le clopidogrel ou l’héparine a entraîné une amélioration (parfois marquée) de la douleur post-prandiale.
Bien que l’atteinte hépatique dans le lupus soit rare, des tests de fonction hépatique anormaux dans le SAP sont fréquemment observés. Bien que ceux-ci puissent présager une thrombose hépatique grave, comme le syndrome de Budd-Chiari ou le syndrome HELLP dans la grossesse avertissant de l’imminence d’un STA catastrophique, le plus souvent, ils ont un pronostic plus bénin.35,36
Une histoire de cas très positive : Au début des années 1980, j’ai vu une adolescente souffrant d’une TVP, d’une aPL positive et du syndrome de Budd-Chiari.
Perte de pronostic ?
Trente ans plus tard, elle se porte toujours bien sous warfarine prudente à vie gérée par ses médecins au Portugal.
Maladie de Goldblatt, le rein & APS-La sténose de l’artère rénale, observée sur un fond clair d’artères par ailleurs normales, peut mimer les premières observations de Goldblatt sur le développement de l’hypertension chez les animaux dont les artères rénales sont expérimentalement occluses. La découverte de lésions localisées de sténose de l’artère rénale par Sangle a conduit à des constatations similaires dans d’autres vaisseaux, ce qui a donné lieu à des théories sur la pathologie thrombotique/endothéliale localisée.37
La peau : le livedo reticularis, une énigme – Bien que les ulcères cutanés, les veines dilatées et les hémorragies d’éclats sous-unguéaux soient des séquelles bien connues de la thrombose cutanée dans le SAP, le livedo reticularis a une aura de mystère38,39.
Diagnostiquement, sa présence est un indice important chez les patients suspectés d’être atteints du syndrome de Hughes – y compris le STA séronégatif.
En repensant à certaines des conditions mentionnées dans cet article -SM, migraine, fractures multiples, problèmes de mémoire- par exemple, on se demande si le fait de noter soigneusement la présence ou l’absence de livedo pourrait s’avérer significatif dans le diagnostic différentiel de ces conditions.
Une chose est certaine : La présence d’un livedo ajoute une dimension supplémentaire à la sévérité du tableau clinique.
Grossesse
Bien sûr, le gros titre du syndrome se situe au niveau de la grossesse, où le taux de réussite des accouchements en bonne santé dans les grossesses aPL-positives a grimpé de moins de 15% à plus de 90%. Sans aucun doute, le diagnostic et le traitement de ces cas ont constitué une avancée significative dans le monde de l’obstétrique.40
Malheureusement, tous ceux d’entre nous qui travaillent avec le SAP ont pris en charge des patientes aPL-positives (dont certaines avaient subi des fausses couches précoces) qui ont perdu un bébé en fin de grossesse. Mortinaissance.
Il y a deux ans, le Times de Londres a publié un article de tête intitulé » Le scandale de la mortinatalité « , soulignant les mauvais chiffres de la mortinatalité au Royaume-Uni.41 Pourtant, certains cas de mortinatalité chez les femmes aPL-positives auraient pu être évités. Par exemple, une étude récente de l’Utah a révélé que les grossesses aPL avaient un risque de mortinatalité trois à cinq fois plus élevé.42
Est-ce qu’un test aPL plus systématique pendant la grossesse serait utile ? Des considérations de coût s’appliquent. Les fausses couches sont fréquentes et leurs causes sont nombreuses. Ainsi, la recommandation actuelle est de réserver le test aux femmes ayant fait trois fausses couches ou plus. Cette recommandation semble sévère. Peut-être qu’un simple processus de dépistage pourrait aider.
J’ai suggéré qu’une partie du dépistage initial de la sage-femme ou de l’obstétricien devrait inclure un simple questionnaire en trois parties :
- Avez-vous eu une thrombose ?
- Etes-vous migraineuse ?
- Avez-vous des antécédents familiaux de maladie auto-immune (c’est-à-dire, lupus, PR, sclérose en plaques, maladie thyroïdienne) ?
Je suis sûr qu’un questionnaire aussi simple pourrait aider à identifier un petit groupe à risque.
Dans la plupart des centres, une fois que la mère et le bébé sont renvoyés chez eux en toute sécurité, il n’y a pas de suivi à long terme. Pourtant, il arrive souvent que les patients atteints de SPP se présentant, par exemple, à l’âge de 40 ans avec un problème thrombotique, donnent des antécédents de fausse couche 20 ans plus tôt. Dans un monde idéal, les femmes souffrant de fausses couches récurrentes méritent un suivi régulier à long terme. Mais le monde est loin d’être idéal.
Lupus &SPA
Les premières études cliniques sur le SAP ont été réalisées dans des cliniques de lupus, et auraient très bien pu inclure les « caractéristiques du lupus ». De manière peut-être surprenante, le temps a montré peu de différence entre le STA primaire et le STA associé au lupus. Il y a, sans aucun doute, certaines caractéristiques classiques du lupus (par exemple, l’endocardite de Libman Sachs, les accidents vasculaires cérébraux, les crises d’épilepsie) qui sont plus susceptibles d’être liées à l’aPL. Il semble également probable que la positivité de l’aPL dans le lupus confère un indice de chronicité plus élevé.
Le passage du temps a également révélé un résultat positif : Il est très inhabituel que les patients atteints de SAP primaire développent un lupus dans les années suivantes.
Les 3 grands
L’association entre le syndrome de Hughes, le syndrome de Sjögren et l’hypothyroïdie est si fréquente que j’ai pris l’habitude de les appeler les 3 grands. Cliniquement, c’est une association importante car les symptômes cliniques des trois affections – fatigue, circulation froide, courbatures, troubles de l’équilibre et de la mémoire – sont communs aux trois. De même, beaucoup de ces patients sont accablés par l’étiquette fibromyalgie.
Chacun des trois syndromes interconnectés peut bien répondre au traitement – par exemple, le Sjögren clinique à l’hydroxychloroquine et ainsi de suite. Beaucoup de ces patients sont sous mon traitement à deux arbres – le saule (aspirine) et le quinquina (quinine).
Seronegative APS
Je crois que l’un des avantages du temps passé par un clinicien stagiaire dans le laboratoire est la reconnaissance que de nombreux tests de laboratoire sont ouverts à la variation. De très nombreuses études ont tenté d’évaluer l’importance du titre, de la classe d’immunoglobuline, de la triple ou double positivité, de la pertinence d' »autres » aPL tels que l’anti-phosphatidyl-sérine, etc.43,44
En gros, tous ces éléments sont pertinents, mais en clinique, certains ne conviennent pas, comme ces patients présentant toutes les caractéristiques cliniques du SAPL dont les tests d’aPL restent obstinément négatifs.
Il y a quelques années, nous avons écrit un article introduisant le terme de STA séronégatif, attirant l’attention sur les patients présentant de fortes caractéristiques cliniques de STA mais avec des tests négatifs.45 Le concept remonte aux premiers jours de la PR séronégative et du lupus séronégatif – deux étiquettes qui, bien que basées sur la seule observation clinique, ont eu des conséquences thérapeutiques et pronostiques importantes.
Trois explications possibles pour le STA séronégatif sont : 1) le diagnostic est incorrect (peu probable dans tous les cas) ; 2) les tests précédemment positifs sont devenus négatifs avec le temps (peu fréquent dans mon expérience) ; ou 3) de nouveaux tests sont nécessaires.46
Peut-être que la raison la plus puissante pour l’ouverture d’esprit concernant le STA séronégatif provient des études familiales. Il y a quelques semaines, j’ai vu une paire de jumeaux identiques – le premier avec un STA séropositif classique, qui a ensuite amené sa sœur jumelle (absolument) identique. La seconde jumelle présentait un ensemble de symptômes identiques, mais contrairement à la première jumelle, elle avait des tests aPL négatifs. Les deux patients ont répondu au traitement.
Une fois par an, nous organisons une réunion de patients dans notre hôpital. Lors de la dernière réunion, nous avons organisé un simple questionnaire anonyme avec deux questions : Êtes-vous un patient atteint de SPA ou un ami/conjoint ? Avez-vous un parent féminin proche (sœur, mère, tante) atteint d’une maladie auto-immune (c’est-à-dire lupus, PR, thyroïde, sclérose en plaques, SAP) ? Le résultat : Soixante pour cent des patients avaient des antécédents positifs de maladies auto-immunes chez des parents proches. Moins de 20 % des amis/conjoints ont répondu positivement.
Il se peut que ma propre expérience soit faussée par le biais de référence des familles de patients atteints de STA – mais séropositifs ou non, la plupart des patients atteints de STA séronégatifs répondent tout aussi bien au traitement.
Si certaines de ces personnes dans l’étude familiale avaient, en fait, un STA séronégatif et étaient potentiellement sensibles au traitement, alors les possibilités sont intrigantes. Peut-être qu’un pourcentage plus élevé de nos patients migraineux, jeunes victimes d’accidents vasculaires cérébraux, jeunes angineux pourrait bénéficier d’un examen plus approfondi pour plus d’indices du SAP – le Schirmer sec, le livedo, les antécédents familiaux de maladie auto-immune – par exemple.
Aspects du traitement
À bien des égards, il est décevant d’avouer que 30 ans après, il y a peu de nouveaux traitements. L’introduction des nouveaux anticoagulants oraux dans le traitement du SAP a été prudente, comme on pouvait s’y attendre, et il est trop tôt pour généraliser.47
Les statines, l’IVIG et l’hydroxychlorquine ont été jetées dans le mélange et, bien sûr, la thérapie anti-cellules B a reçu des anecdotes favorables. Une étude récente de Paris a suggéré que le sirolimus, utilisé dans la transplantation rénale, pourrait avoir un effet protecteur sur la vasculopathie induite par le SPA.48
Ainsi, en 2016, le traitement actuel du SPA se limite encore largement à l’aspirine, au clopidogrel, à l’héparine et à la warfarine.
L’aspirine à faible dose, malgré ses détracteurs, est bien sûr le premier choix chez de nombreux patients atteints de SPA. Cependant, le clopidogrel reste une alternative utile chez les patients atteints de gastrite ou chez les asthmatiques. Mais il y a un troisième rôle pour le clopidogrel – important dans le monde réel de la médecine pratique – c’est-à-dire chez les patients qui, pour une raison quelconque, ont essayé l’aspirine, sans bénéfice clair.
Héparine-L’héparine de bas poids moléculaire a, dans la plupart des pays, largement remplacé l’ancienne héparine, et avec elle, les craintes de thrombocytopénie et d’ostéoporose ont largement disparu. C’est un point important à souligner, car de nombreux praticiens sont réticents à prolonger l’utilisation de l’héparine.
Deux observations : Premièrement, un certain nombre de patients s’améliorent considérablement sous héparine, pour se sentir moins bien sous warfarine.
Quoi faire ensuite ? Lorsque les problèmes de dosage, de résistance à la warfarine et d’observance sont (espérons-le) écartés, une option immédiate est un retour temporaire à l’héparine. Dans certains cas, le temporaire s’est transformé en semi-long terme. Dans notre clinique de SPA, nous avons une vingtaine de patients qui, par choix, sont restés sous héparine sous-cutanée pendant deux ans ou plus. Oui, ils ont eu des ecchymoses, mais jusqu’à présent, nous n’avons pas vu d’aggravation des scans DEXA.
La deuxième observation (et très clinique) concerne un essai d’héparine. On observe régulièrement que les patientes aPL/APS sous héparine pendant la grossesse n’ont souvent pas de maux de tête pendant les huit ou neuf mois complets. Cela nous a conduit à développer un outil clinique, un essai thérapeutique, qui nous a bien servi. Cet essai consiste en un traitement de trois ou quatre semaines d’héparine LMW.49
Laissez-moi vous donner un exemple de son utilisation : Chez le patient aPL/APS présentant des maux de tête de plus en plus sévères malgré l’aspirine/clopidogrel (et avec une IRM cérébrale normale), un essai de 10 000 unités de daltéparine (ou d’énoxaparine) pendant trois ou quatre semaines peut donner des résultats substantiels. Premièrement, il peut donner une indication étonnamment claire de la pertinence de l’anticoagulation. Deuxièmement, chez le patient traumatisé qui a emprunté le chemin familier des multiples consultations de spécialistes, avec un succès clinique limite, cela peut constituer un tournant majeur – le premier signe palpable d’amélioration.
Warfarine – Il n’y a pas grand-chose de nouveau à dire sur la warfarine. Elle a été vilipendée par les médias, mais elle reste l’un des médicaments les plus utiles de notre arsenal. La warfarine, pour le dire en termes simples, protège contre les accidents vasculaires cérébraux et les crises cardiaques chez les patients atteints du SAPL.
On a mentionné le besoin fréquent d’un INR plus élevé chez de nombreux patients atteints du SAPL, en particulier ceux qui présentent des caractéristiques neurologiques. Je crois fermement à l’utilisation d’appareils d’autodiagnostic de l’INR chaque fois que cela est possible chez nos patients.
Malheureusement, certaines cliniques d’anticoagulants s’opposent à l’utilisation d’appareils d’autodiagnostic. Pour moi, c’est une erreur. Regardez la liberté que les autotests pour les diabétiques insulino-dépendants ont atteint.
En tant que médecins, je crois que nous avons le devoir (jusqu’à ce que de meilleurs anticoagulants plus récents soient établis) de soutenir la warfarine comme un médicament largement sûr et efficace qui a sauvé plusieurs milliers de vies.
En 2015, le traitement actuel du syndrome de Hughes est encore largement limité à l’aspirine, au clopidogrel, à l’héparine &à la warfarine.
Miscellanées
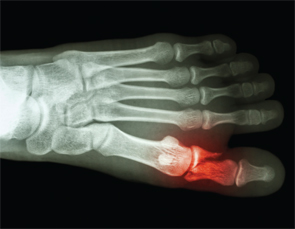
La fracture osseuse spontanée commence à être bien reconnue après le rapport de 27 fractures métatarsiennes spontanées par le Dr. Shirish Sangle chez des patients atteints de SPA.
Crédit image : Puwadol Jaturawutthichai/.com
La famille-Il n’est pas surprenant que les antécédents familiaux soient un indice important dans le syndrome de Hughes. Les maladies auto-immunes (en particulier la thyroïde) reviennent régulièrement comme diagnostic chez les parents de nos patients. Mais à quelle fréquence ces cas familiaux sont-ils diagnostiqués ? On peut citer par exemple la fille de 17 ans d’un patient atteint du SPP souffrant de maux de tête et de fièvre glandulaire, le frère ou la sœur atteint de sclérose en plaques ou la mère et la tante d’un patient atteint du SPP nouvellement diagnostiqué qui ont subi un accident vasculaire cérébral au début de la quarantaine.
Il n’est pas inconcevable que le SPP ait changé le cours de l’histoire, comme dans le cas rapporté par mon ami, le Dr. Gerald Weissmann, de la reine Anne d’Angleterre qui a eu 17 grossesses ratées et est morte sans enfant, mettant ainsi fin au règne des Stuart et au début des Hanovriens – avec George III, les impôts des colonies américaines, la révolution et la naissance des États-Unis50.
La progéniture – Jusqu’à présent, la plupart des études ont suggéré que la progéniture des mères aPL-positives n’a pas d’effets indésirables majeurs (autre que, peut-être, le développement ultérieur de caractéristiques héréditaires de la SPA chez certains). Cependant, certains rapports de cas inquiétants de problèmes fœtaux et néonataux indiquent la nécessité de poursuivre les études. Les études en cours des Drs Anne Parke, Angela Tincani, Maria Claire Boffa et d’autres fourniront, avec le temps, certaines de ces données manquantes.51,52
Classification vs. diagnostic-
Cher Docteur, je vous serais reconnaissant si vous pouviez me conseiller sur cette patiente. Elle a développé une thrombose sous pilule contraceptive orale. Elle a eu un test positif pour l’aPL, mais n’a pas eu de nouveau test 12 semaines plus tard.
Comme dans le cas du lupus, les critères de classification se confondent parfois avec le diagnostic. De nombreux patients ne viennent pas armés de tests » à 12 semaines d’intervalle » (ce critère a été introduit pour couvrir le risque qu’une infection intercurrente ait pu conduire à un test aPL positif transitoire – ce qui n’était pas un facteur majeur dans notre évaluation de ce patient).
Il y a aussi des considérations financières, comme dans l’étude suivante de Beyrouth, au Liban.
» Seuls 50,5 % ont eu un test aCL et LA. … Le coût de chaque test était d’environ 50 $US pour le patient. … Il reste à voir si le coût des tests pourrait expliquer en partie le très faible pourcentage de patients qui ont subi un test de confirmation de suivi. »
Le passage du temps a également révélé un résultat positif : Il est très inhabituel que les patients atteints d’un SAP primaire développent un lupus à un âge plus avancé.
La reconnaissance des nombreuses manifestations non thrombotiques du SAP a ajouté à l’importance de séparer le diagnostic de la classification. Peut-être que les progrès des laboratoires dans la mesure des marqueurs de risque potentiels viendront, avec le temps, à notre secours.44
La peur de voler – Cette anecdote clinique apparaît régulièrement dans ma clinique. A tel point que je pense qu’elle nécessite une étude plus approfondie. Un certain nombre de mes patients atteints de SPA, notamment avant le début du traitement, souffrent gravement du décalage horaire prolongé après un vol long-courrier, avec fatigue, maux de tête et confusion, parfois pendant plusieurs jours.
Intéressant, une fois le traitement à l’héparine ou à la warfarine commencé avec succès, ce phénomène disparaît. On ne sait pas si ces symptômes sont liés à une légère hypoxie cérébrale secondaire à une pression de cabine légèrement réduite. Néanmoins, certains de mes patients atteints de SAPL complètent leur traitement à l’aspirine avant un vol long-courrier par une injection d’héparine LMW. Bien que l’effet placebo puisse être considérable, je suis suffisamment impressionné par l’expérience clinique de ces patients (observateurs) pour croire que le phénomène de décalage horaire prolongé chez nombre de nos patients est bien réel.
L’avenir – Lors du 14e Congrès international sur les anticorps antiphospholipides qui s’est tenu à Rio de Janeiro en 2013, on m’a demandé mes prédictions sur l’avenir du STA23. En résumé, je crois :
- Le test aPL deviendra mondial et de routine;
- Des kits de test aPL en vente libre seront disponibles;
- Un sous-ensemble substantiel de migraineux aura un nouvel espoir ;
- L’aPL sera reconnu comme le principal lien entre la migraine et les accidents vasculaires cérébraux;
- Les crises cardiaques chez les jeunes femmes (en particulier celles de moins de 45 ans) seront réduites;
- Les accidents vasculaires cérébraux chez les moins de 45 ans seront réduits ;
- Certains cas d’artériopathie accélérée seront reconnus comme étant associés à l’aPL (non traitée);
- Certains cas de perte de mémoire sont traitables;
- L’aPL continuera d’avoir un effet profond sur notre évaluation clinique et notre traitement du lupus ; et
- Enfin, pour revenir au thème d’ouverture, l’incidence de la mortinatalité sera réduite, grâce, en partie, à une approche plus proactive du test de l’aPL pendant la grossesse.
Pour répéter une phrase tirée de l’article de 1983 :1
Pour ceux d’entre nous endurcis dans le nihilisme par des années d’étude de divers auto-anticorps dans le LED, il y a un rare sentiment d’excitation devant les implications des associations maintenant rapportées.
Trente ans après, cette excitation clinique reste intacte.
 Graham R.V. Hughes, MD, FRCP, est consultant en rhumatologie et directeur du London Lupus Centre. Il s’est formé à l’hôpital de Londres, et a passé deux ans à New York à travailler sur l’introduction du test de liaison à l’ADN, sous la direction du Dr Charles Christian. En 1971, il a ouvert une clinique spécialisée à Londres, s’occupant uniquement du lupus et des maladies connexes. Il est le fondateur et l’éditeur de la revue internationale Lupus. En 1983, il a décrit le syndrome des antiphospholipides et, en 1991, il a reçu le prix ILAR (recherche mondiale) pour ce travail. Il est également docteur honoris causa des universités de Marseille et de Barcelone, et maître de l’ACR.
Graham R.V. Hughes, MD, FRCP, est consultant en rhumatologie et directeur du London Lupus Centre. Il s’est formé à l’hôpital de Londres, et a passé deux ans à New York à travailler sur l’introduction du test de liaison à l’ADN, sous la direction du Dr Charles Christian. En 1971, il a ouvert une clinique spécialisée à Londres, s’occupant uniquement du lupus et des maladies connexes. Il est le fondateur et l’éditeur de la revue internationale Lupus. En 1983, il a décrit le syndrome des antiphospholipides et, en 1991, il a reçu le prix ILAR (recherche mondiale) pour ce travail. Il est également docteur honoris causa des universités de Marseille et de Barcelone, et maître de l’ACR.
- Hughes GR. Thrombose, avortement, maladie cérébrale, et l’anticoagulant lupique. Br Med J (Clin Res Ed). 1983 Oct 15;287(6399):1088-1089.
- Harris EN, Gharavi AE, Boey ML, et al. Anticardiolipine dans les anticorps : Détection par dosage radio-immunologique et association avec la thrombose dans le SLE. Lancet. 1983 Nov 26;2(8361):1211-1214.
- Boey ML, Colaco CB, Gharavi AE, et al. Thrombosis in SLE : Striking association with the presence of circulating lupus anticoagulant. Br Med J (Clin Res Ed). 1983 Oct 8;287:1021-1023.
- Hughes GR. L’oraison Prosser White 1983 : La maladie du tissu conjonctif et la peau. Clin Exp Dermatol. 1984 Nov;9(6):535-544.
- Asherson RA, Mackworth-Young CG, Boey ML, Hughes GRV. L’hypertension pulmonaire dans le lupus érythémateux systémique. Br Med J (Clin Res Ed). 1983 Oct 8;287(6398):1024-1025.
- Derue GJ, Englert HJ, Harris EN, et al. Fetal loss in systemic lupus : Association avec les anticorps anticardiolipine. J Obstet Gynaecol. 1985;5(4):207-209.
- Hughes GR, Harris NN, Gharavi AE. Le syndrome des anticardiolipines. J Rheumatol. 1986 Jun;13(3):486-489.
- Hughes GR. Le syndrome de Hughes : Le syndrome des anticardiolipines. A historical view. Lupus. 1998;7 Suppl 2:S1-S4.
- Carecchio M, Cantello R, Comi C. Revisiter le mécanisme moléculaire dans le syndrome des antiphospholipides : au-delà des dommages vasculaires. J Immunol Res. 2014;2014:239398.
- Bluestein HG, Zvaifler NJ. Anticorps lymphocytotoxiques réactifs au cerveau dans le sérum des patients atteints de SLE. J Clin Invest. 1976 Feb;57(2):509-516.
- Bresnihan B, Oliver N, Grigor R, Hughes GR. Réactivité cérébrale des anitibodies lymphocytotoxiques dans le lupus érythémateux systémique avec et sans atteinte cérébrale. Clin Exp Immunol. 1977 Dec;30(3):333-337.
- Bresnihan B, Hohmeister R, Cutting J, et al. The neuropsychiatric disorder in SLE : Evidence for both vascular and immune mechanisms. Ann Rheum Dis. 1979 Aug;38(4):301-306.
- Denburg SD, Behmann SA, Carbotte RM, et al. Lymphocyte antigens in neuropsychiatric systemic lupus erythematosus. Relations entre les spécificités des anticorps lymphocytaires et la maladie clinique. Arthritis Rheum. 1994 Mar;37(3):369-375.
- Harris EN, Gharavi AE, Asherson RA, et al. Cerebral infarction in SLE. Association avec les anticorps anticardiolipine. Clin Exp Rheumatol. 1984 Jan-Mar;2(1):47-51.
- Navarrete MG, Brey RL, Levine SR. « Cerebral disease in the antiphospholipid syndrome » in Hughes Syndrome-Antiphospholipid Syndrome. Khamashta MA, ed. Springer, London : 2000.
- Sanna G, Bertolaccini ML, Cuadrado MJ, et al. Central nervous system involvement in the antiphospholipid (Hughes) syndrome. Rhumatologie (Oxford). 2003 Feb;42(2):200-213.
- Etminan M, Takkouche B, Isorna FC, Samii A. Risk of ischaemic stroke in people with migraine : Revue systémique et méta-analyse des études observationnelles. BMJ. 2005 Jan 8;330(7482):63.
- Nencini P, Baruffi MC, Abbate R, et al. Anticorps anticoagulants et anticardiolipine du lupus chez les jeunes adultes atteints d’ischémie cérébrale. Stroke. 1992 Feb;23(2):189-193.
- Hughes GR. Syndrome des antiphospholipides, migraine et accident vasculaire cérébral. Lupus. 2010 Apr;19(5):555-556.
- Mackworth-Young CG, Hughes GR. Epilepsie : Un symptôme précoce du lupus érythémateux systémique. J Neurol Neurosurg Psychiatry. 1985 Feb;48(2):185.
- Cimaz R, Meroni PL, Shoenfeld Y. Epilepsie dans le cadre du lupus érythémateux systémique et du syndrome systémique des antiphospholipides (syndrome de Hughes). Lupus. 2006;15(4):191-194.
- Hughes GR. « Diplomatic epilepsy » in Understanding Hughes Syndrome. Springer-Verlag, Londres : 2009.
- Hughes GR. Syndrome de Hughes/APS. 30 ans après, qu’avons-nous appris ? Discours d’ouverture du 14e Congrès international sur les anticorps antiphospholipides. Rio de Janeiro, octobre 2013. Lupus. 2014;23:400-406.
- Cuadrado MJ, Khamashta MA, Ballesteros A, et al. Les manifestations neurologiques du syndrome de Hughes (antiphospholipides) peuvent-elles être distinguées de la sclérose en plaques ? Analyse de 27 patients et revue de la littérature. Médecine (Baltimore). 2000 Jan;79(1):57-68.
- Hughes GR. Migraine, perte de mémoire et « sclérose en plaques ». Caractéristiques neurologiques du syndrome des antiphospholipides (Hughes). Postgrad Med J. 2003 Feb;79(928):81-83.
- Uthman I, Noureldine MH, Berjawi A, et al. Syndrome de Hughes et sclérose en plaques. Lupus. 2015 Feb;24(2):115-121.
- Cervera R, Asherson RA, Font J, et al. La chorée dans le syndrome des antiphospholipides. Caractéristiques cliniques, radiologiques et immunologiques de 50 patients de nos cliniques et de la littérature récente. Médecine (Baltimore). 1997 May;76(3):203-212.
- Baizabal-Carvallo JF, Bonnet C, Jankovic J. Movement disorders in systemic lupus erythematosus and the antiphospholipid syndrome. J Neural Transm (Vienne). 2013 Nov;120(11):1579-1589.
- Schofield JR, Blitshteyn S, Shoenfeld Y, et al. Postural tachycardia syndrome (POTS) and other autonomic disorders in antiphospholipid (Hughes) syndrome (APS). Lupus. 2014 Jun;23(7):697-702.
- Sangle S, D’Cruz DP, Khamashta MA, et al. Anticorps antiphospholipides, lupus érythémateux systémique et fractures métatarsiennes non traumatiques. Ann Rheum Dis. 2004 Oct;63(10):1241-1243.
- Greco TP1, Conti-Kelly AM, Greco T Jr., et al. Newer antiphospholipid antibodies predict adverse outcomes in patients with acute coronary syndrome. Am J Clin Catholic. 2009 Oct;132(4):613-620.
- Urbanus RT, Siegerink B, Roest M, et al. Antiphospholipid antibodies and risk of myocardial infarction and ischaemic stroke in young women in the RATIO study : A case-control study. Lancet Neurol. 2009 Nov;8(11):998-1005.
- Nair S, Khamashta MA, Hughes GR. Syndrome X et syndrome de Hughes. Lupus. 2002;11(5):332.
- Sangle SR, Jan W, Lau IS, et al. Sténose de l’artère cœliaque et syndrome des antiphospholipides (Hughes) / anticorps antiphospholipides. Clin Exp Rheumatol. 2006 May-Jun;24(3):349.
- Mackworth-Young CG, Melia WM, Harris EN, et al. The Budd-Chiari syndrome. Rôle pathogénétique possible des anticorps anti-phospholipides. J Hepatol. 1986;3(1):83-86.
- Hanouna G, Morel N, Le Thi Huong D, et al. Syndrome catastrophique des antiphospholipides et grossesse : Une expérience de 13 cas. Rhumatologie (Oxford). 2013 Sep;52(9):1635-1641.
- Sangle SR, D’Cruz DP, Jan W, et al. Sténose de l’artère rénale dans le syndrome des antiphospholipides (Hughes) et l’hypertension. Ann Rheum Dis. 2003 Oct;62(10):999-1002.
- Englert HJ, Loizou S, Derue GG, et al. Caractéristiques cliniques et immunologiques du livedo reticularis dans le lupus. Am J Med. 1989 Oct;87(4):408-410.
- Sangle SR, D’Cruz DP. Livedo reticularis : Une énigme. Isr Med Assoc J. 2015 Feb;17(2):104-107.
- Ateka-Barrutia O, Khamashta MA. Le défi de la grossesse pour les patientes atteintes de LED. Lupus. 2013 Oct;22(12):1295-1308.
- Hughes GR. Le scandale de la mortinatalité. Lupus. 2013 Jul;22(8):759-760.
- Silver RM, Parker CB, Reddy UM, et al. Anticorps antiphospholipides dans la mortinatalité. Obstet Gynecol. 2013 Sep;122(3):641-657.
- Rodriguez-Garcia JL, Bertolaccini ML, Cuadrado MJ, et al. Manifestations cliniques du syndrome des antiphospholipides (SAP) avec et sans anticorps antiphospholipides (le soi-disant ‘SAP séronégatif’). Ann Rheum Dis. 2012 Feb;71(2):242-244.
- Meroni PL, Chighizab CB, Rovelli F, et al. Le syndrome des antiphospholipides en 2014 : Davantage de manifestations cliniques, de nouveaux acteurs pathogènes et de biomarqueurs émergents. Arthritis Res Ther. 2014;16(2):209.
- Hughes GR, Khamashta MA. Le syndrome des antiphospholipides séronégatif. Ann Rheum Dis. 2003 Dec;62(12):1127.
- Rodguez-Garcia JL, Bertolaccini ML, Cuadrado MJ, et al. Manifestations cliniques du syndrome des antiphospholipides (SAP) avec et sans anticorps antiphospholipides. Ann Rheum Dis. 2012 Feb;71(2):242-244.
- Giles I, Khamashta M, D’Cruz D, et al. A new dawn of anticoagulation for patients with antiphospholipid syndrome. Lupus. 2012 Oct;21(12):1263-1265.
- Canuad G, Bienaimé C, Taborin F, et al. Inhibition de la voie mTORC dans le syndrome des antiphospholipides. New Eng J Med. 2014 Jul 24;371(4):303-312.
- Hughes GR. L’héparine, les anticorps antiphospholipides et le cerveau. Lupus. 2012 Sep;21(10):1039-1040.
- Weissmann G. Le lupus de la reine Anne : Les phospholipides et le cours de l’empire. FASEB J. 2014 avr;28(4):1527-1530.
- Mekinian A, Lachassinne E, Nicaise-Roland P, et al. Registre européen des bébés nés de mères atteintes du syndrome des antiphospholipides. Ann Rheum Dis. 2013 Feb;72(2):217-222.
- Nalli C, Iodice A, Andreoti L, et al. Enfants nés de mères atteintes du LED et du SAP. Lupus. 2014 Oct;23(12):1246-1248.
- Major S, Pashayan N, Atweh S, et al. Modes de pratique du syndrome des antiphospholipides dans un hôpital universitaire tertiaire au Liban. Lupus. 2002;11(11):759–764.