Les atomes peuvent gagner ou perdre des électrons afin de former des ions dans un processus appelé ionisation (les composés formés de cette façon sont appelés composés ioniques). Lorsque les composés ioniques se dissolvent dans l’eau, leurs ions se séparent les uns des autres dans un processus appelé dissociation. Une caractéristique intéressante de l’eau et de nombreux autres composés covalents est qu’ils peuvent également se dissocier en ions. Contrairement aux composés ioniques, comme le chlorure de sodium, ils ne sont pas ionisés avant de se dissocier ; ils accomplissent l’ionisation et la dissociation en même temps.
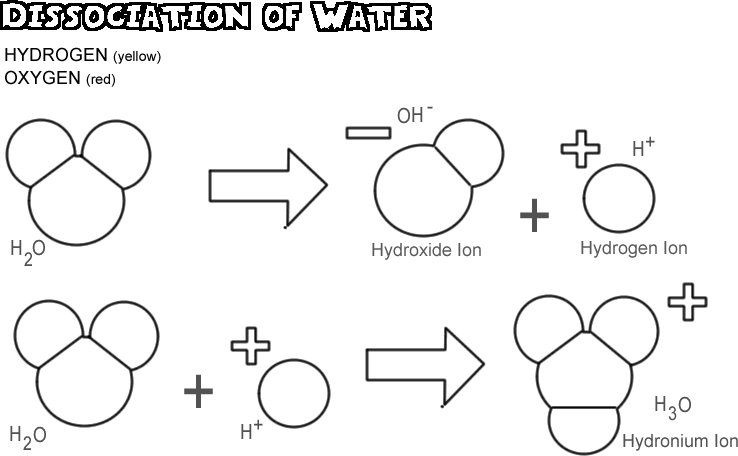
Dissociation de l’eau
Lorsque l’eau se dissocie, l’un des noyaux d’hydrogène laisse son électron derrière lui avec l’atome d’oxygène pour devenir un ion hydrogène, tandis que l’oxygène et les autres atomes d’hydrogène deviennent un ion hydroxyde. Comme l’ion hydrogène n’a pas d’électron pour neutraliser la charge positive de son proton, il a une unité complète de charge positive et est symbolisé par H+. L’ion hydroxyde conserve l’électron laissé derrière lui et possède donc une unité complète de charge négative, symbolisée par OH-. L’ion hydrogène (proton) n’erre pas longtemps par lui-même avant de se fixer à l’atome d’oxygène d’une seconde molécule d’eau non ionisée pour former un ion hydronium (H3O +)
Dans tout échantillon d’eau, très peu de molécules sont dissociées à un moment donné : en fait, seulement une sur 550 millions environ. Il y a cependant un changement constant ; alors qu’un ion hydrogène se rattache à un ion hydroxyde pour former une molécule d’eau, une autre molécule d’eau se dissocie pour remplacer l’ion hydrogène et l’ion hydroxyde en solution.
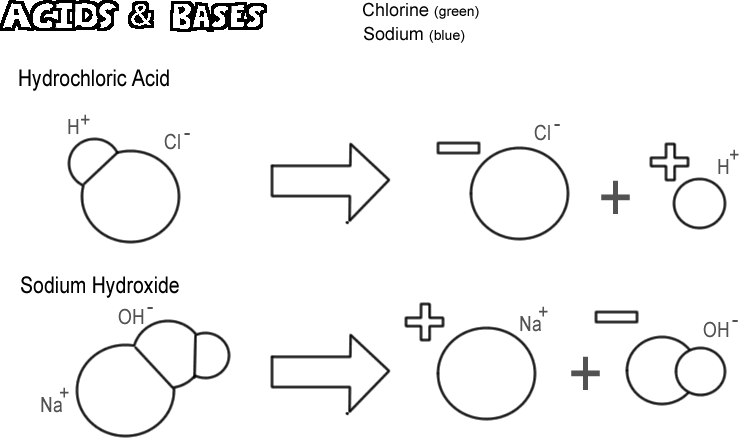
Acide chlorhydrique
Certaines molécules, ioniques et covalentes, se dissocient de telle sorte qu’elles libèrent un ion hydrogène sans libérer d’ion hydroxyde. Ces substances sont appelées acides. Étant donné qu’un ion hydrogène n’est en fait qu’un seul proton dans la plupart des cas, le chimiste définit un acide comme un « donneur de protons ». Si de très nombreux protons (ions hydrogène) sont « donnés », l’effet peut être très profond, comme par exemple brûler votre peau ou dissoudre du métal. L’acide illustré est l’acide chlorhydrique. L’acide chlorhydrique pur est un gaz, mais il se dissout facilement dans l’eau pour produire une solution d’ions hydrogène et d’ions chlorure. Comme il est presque entièrement dissocié dans l’eau, on l’appelle un acide fort. Les acides qui ne se dissocient pas complètement sont appelés acides faibles.
Hydroxyde de sodium
L’opposé d’un acide est une base, également appelée alcali. Une base forte typique est l’hydroxyde de sodium, le principal composant de la lessive. L’hydroxyde de sodium se dissocie pour former un ion sodium et un ion hydroxyde. Une base est définie comme un « accepteur de protons ». Les bases les plus courantes produisent un ion hydroxyde lorsqu’elles se dissocient, et c’est l’ion hydroxyde qui accepte le proton. Une base forte peut donner à votre peau une brûlure bien pire qu’un acide.
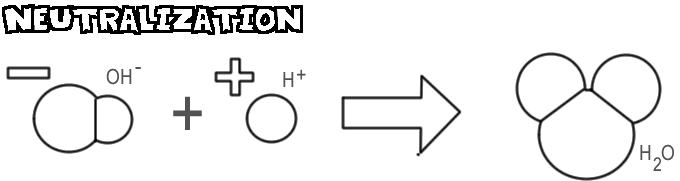
Neutralisation
Lorsqu’une base et un acide sont mélangés, l’ion hydroxyde et la base se combinent avec l’ion hydrogène de l’acide pour former de l’eau. Ce processus est appelé neutralisation.
Questions:
1. Que se passe-t-il lorsqu’un atome gagne ou perd un électron ?
.