Electrons de base et de valence
A mesure que nous continuons à parcourir le tableau périodique de cette manière, en écrivant les configurations électroniques d’atomes de plus en plus grands, il devient fastidieux de continuer à copier les configurations des sous-coquilles intérieures remplies. En pratique, les chimistes simplifient la notation en utilisant un symbole de gaz noble entre crochets pour représenter la configuration du gaz noble de la ligne précédente, car toutes les orbitales d’un gaz noble sont remplies. Par exemple, représente la configuration électronique 1s2 2s2 2p6 du néon (Z = 10), donc la configuration électronique du sodium, avec Z = 11, qui est 1s2 2s2 2p6 3s1, s’écrit 3s1
| Configuration électronique complète | Nobel Gas Shorthand | ||
| Neon | Z = 10 | Ne : 1s2 2s2 2p6 | Ne : 2s2 2p6 |
| Sodium | Z = 11 |
Na : 1s2 2s2 2p6 3s1 |
Na : 3s1 |
Les électrons dans les orbitales internes remplies sont plus proches du noyau et plus étroitement liés à lui, ils sont donc rarement impliqués dans les réactions chimiques. Nous les appellerons les électrons du noyau. Pour les éléments représentatifs (colonnes 1, 2 et 13-18 du tableau périodique), les électrons centraux sont tous des électrons dont la valeur n est inférieure à la valeur n maximale de la configuration électronique. Par exemple, dans l’atome de sodium, la valeur n la plus élevée est 3. Ainsi, les électrons centraux sont ceux des orbitales atomiques avec n < 3, à savoir ceux des orbitales 1s, 2s et 2p. Ainsi, le sodium possède 10 électrons de noyau. Nous reviendrons plus tard sur cette définition des électrons de noyau pour les métaux de transition.
Cela signifie que la chimie d’un atome dépend surtout des électrons de sa coquille la plus externe, ceux qui ont la valeur n la plus élevée, que l’on appelle les électrons de valence. Cette notation simplifiée nous permet de visualiser plus facilement la configuration des électrons de valence. En utilisant cette notation pour comparer les configurations électroniques du sodium et du lithium, nous avons :
| Sodium | 1s2 2s2 2p6 3s1 | 3s1 |
| Lithium | 1s2 2s1 | 2s1 |
Il est évident que le sodium et le lithium ont tous deux un électron S dans leur couche de valence. Nous pourrions donc prédire que le sodium et le lithium ont une chimie très similaire, ce qui est effectivement le cas.
A mesure que nous continuons à construire les huit éléments de la période 3, les orbitales 3s et 3p sont remplies, un électron à la fois. Cette rangée se termine par le gaz noble argon, qui a la configuration électronique 3s2 3p6, correspondant à une coquille de valence remplie.
Exemple 2.2.2
Dessinez un diagramme orbital et utilisez-le pour dériver la configuration électronique du phosphore, Z = 15. Quelle est sa configuration électronique de valence ?
Donné : numéro atomique
Demandé : diagramme orbital et configuration électronique de valence du phosphore
Stratégie:
- Localisez le gaz noble le plus proche précédant le phosphore dans le tableau périodique. Soustrayez ensuite son nombre d’électrons de ceux du phosphore pour obtenir le nombre d’électrons de valence du phosphore.
- En vous référant à la figure 2.1.1, dessinez un diagramme orbital pour représenter ces orbitales de valence. En suivant la règle de Hund, placez les électrons de valence dans les orbitales disponibles, en commençant par l’orbitale dont l’énergie est la plus faible. Écrivez la configuration électronique de votre diagramme orbital.
- Ignorez les orbitales internes (celles qui correspondent à la configuration électronique du gaz noble le plus proche) et écrivez la configuration électronique de valence du phosphore.
Solution:
A Parce que le phosphore est dans la troisième rangée du tableau périodique, nous savons qu’il a une coquille fermée avec 10 électrons. Nous commençons par soustraire 10 électrons des 15 du phosphore.
B Les cinq électrons supplémentaires sont placés dans les prochaines orbitales disponibles, qui Figure 2.1.1 nous indique sont les orbitales 3s et 3p :
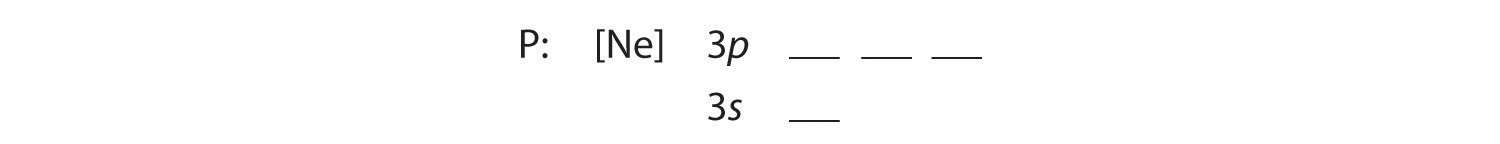
Parce que l’orbitale 3s est de plus faible énergie que les orbitales 3p, on la remplit en premier :
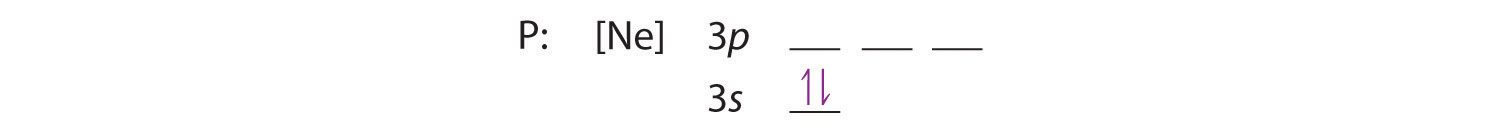
La règle de Hund nous dit que les trois électrons restants occuperont les orbitales 3p dégénérées séparément mais avec leurs spins alignés:
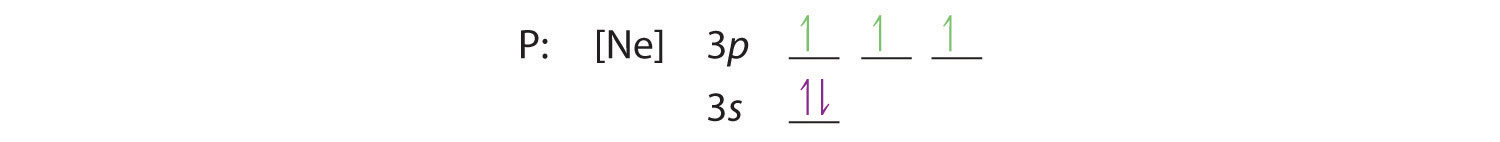
La configuration électronique est 3s2 3p3.
C Nous obtenons la configuration des électrons de valence en ignorant les orbitales internes, ce qui signifie pour le phosphore que nous ignorons la coquille fermée. Cela donne une configuration des électrons de valence de 3s2 3p3.
Exercice 2.2.2
Dessinez un diagramme orbital et utilisez-le pour dériver la configuration électronique du chlore, Z = 17. Quelle est sa configuration électronique de valence ?
Réponse : 3s2 3p5
Configuration électronique de valence : 3s23p5
L’ordre général dans lequel les orbitales sont remplies est représenté sur la figure 2.2.1. Les sous-coquilles correspondant à chaque valeur de n sont inscrites de gauche à droite sur des lignes horizontales successives, où chaque ligne représente une rangée du tableau périodique. L’ordre dans lequel les orbitales sont remplies est indiqué par les lignes diagonales allant du haut à droite au bas à gauche. Ainsi, l’orbitale 4s est remplie avant l’orbitale 3d en raison des effets de blindage et de pénétration. Par conséquent, la configuration électronique du potassium, qui commence la quatrième période, est 4s1, et la configuration du calcium est 4s2. Cinq orbitales 3d sont remplies par les 10 éléments suivants, les métaux de transition, suivis de trois orbitales 4p. Notez que le dernier membre de cette rangée est le gaz noble krypton (Z = 36), Kr : 4s2 3d10 4p6, qui possède des orbitales 4s, 3d et 4p remplies. La cinquième rangée du tableau périodique est essentiellement la même que la quatrième, sauf que les orbitales 5s, 4d et 5p sont remplies séquentiellement.
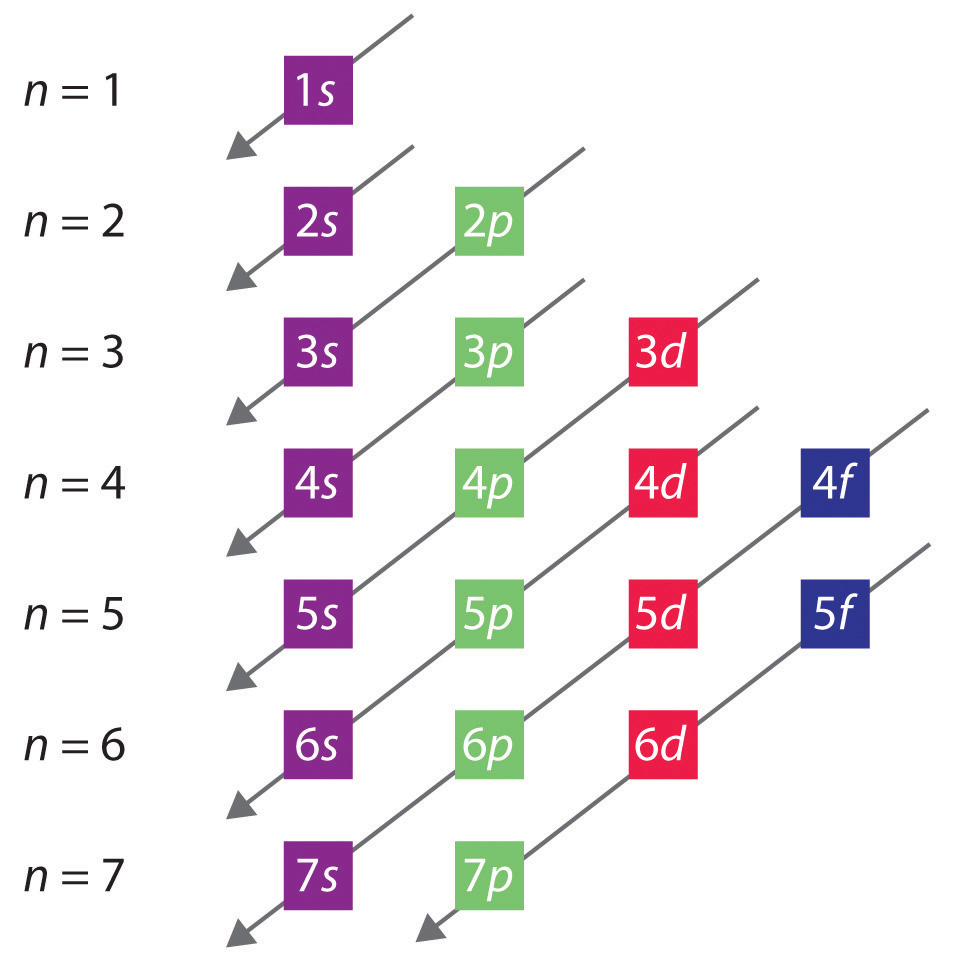
Figure 2.2.1 Prédire l’ordre dans lequel les orbitales sont remplies dans les atomes multiélectroniques. Si vous écrivez les sous-coquilles pour chaque valeur du nombre quantique principal sur des lignes successives, l’ordre observé dans lequel elles sont remplies est indiqué par une série de lignes diagonales allant du haut à droite au bas à gauche.
La sixième rangée du tableau périodique sera différente des deux précédentes parce que les orbitales 4f, qui peuvent contenir 14 électrons, sont remplies entre les orbitales 6s et 5d. Les éléments qui contiennent des orbitales 4f dans leur coquille de valence sont les lanthanides. Lorsque les orbitales 6p sont finalement remplies, nous avons atteint le prochain (et dernier) gaz noble connu, le radon (Z = 86), Rn : 6s2 4f14 5d10 6p6. Dans la dernière rangée, les orbitales 5f sont remplies entre les orbitales 7s et 6d, ce qui donne les 14 éléments actinides. Comme le grand nombre de protons rend leurs noyaux instables, tous les actinides sont radioactifs.
Exemple 2.2.3
Écrivez la configuration électronique du mercure (Z = 80), en montrant toutes les orbitales internes.
Donné : numéro atomique
Demandé : configuration électronique complète
Stratégie:
En utilisant le diagramme orbital de la figure 2.2.1 et le tableau périodique comme guide, remplissez les orbitales jusqu’à ce que les 80 électrons aient été placés.
Solution:
En plaçant les électrons dans les orbitales en suivant l’ordre indiqué dans la figure 2.2.1 et en utilisant le tableau périodique comme guide, nous obtenons
| 1s2 | row 1 | 2 électrons |
| 2s22p6 | row 2 | 8 électrons |
| 3s23p6 | ligne 3 | 8 électrons |
| 4s23d104p6 | row 4 | 18 electrons |
| 5s24d105p6 | row 5 | 18 electrons |
| rangée 1-5 | 54 électrons |
Après avoir rempli les cinq premières rangées, il nous reste 80 – 54 = 26 électrons à loger. Selon la figure 2.2.2, nous devons remplir les orbitales 6s (2 électrons), 4f (14 électrons) et 5d (10 électrons). Le résultat est la configuration électronique du mercure :
Hg : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10
Hg : 6s2 4f14 5d10
avec une sous coquille 5d remplie, une configuration de coquille de valence 6s2 4f14 5d10, et un total de 80 électrons. (Vous devez toujours vérifier que le nombre total d’électrons est égal au numéro atomique.)
Exercice 2.2.3
Bien que l’élément 114 ne soit pas assez stable pour être présent dans la nature, deux isotopes de l’élément 114 ont été créés pour la première fois dans un réacteur nucléaire en 1999 par une équipe de scientifiques russes et américains. Ecrivez la configuration électronique complète de l’élément 114.
Réponse : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p2
Les configurations électroniques des éléments sont présentées dans la figure 2.2.3, qui énumère les orbitales dans l’ordre où elles sont remplies. Dans plusieurs cas, les configurations électroniques de l’état fondamental sont différentes de celles prédites par la figure 2.2.1. Certaines de ces anomalies se produisent lorsque les orbitales 3d sont remplies. Par exemple, la configuration électronique observée du chrome à l’état fondamental est 4s1 3d5 plutôt que la configuration prédite 4s2 3d4. De même, la configuration électronique observée du cuivre est 4s1 3d10 au lieu de s2 3d9. La configuration électronique réelle peut être rationalisée en termes de stabilité supplémentaire associée à une demi-coquille remplie (ns1, np3, nd5, nf7) ou à une coquille remplie (ns2, np6, nd10, nf14). Étant donné les faibles différences entre les niveaux d’énergie supérieurs, cette stabilité supplémentaire est suffisante pour déplacer un électron d’une orbitale à une autre. Dans les éléments plus lourds, d’autres effets plus complexes peuvent également être importants, conduisant à certaines des anomalies supplémentaires indiquées à la figure 2.2.3. Par exemple, le cérium a une configuration électronique de 6s2 4f1 5d1, ce qui est impossible à rationaliser en termes simples. Dans la plupart des cas, cependant, ces anomalies apparentes n’ont pas de conséquences chimiques importantes.
Note
Une stabilité supplémentaire est associée aux sous-coquilles à moitié remplies ou remplies.