Vandets egenskaber
En af de ting, der gør vores planet til noget særligt, er tilstedeværelsen af flydende vand. Vand er grundlæggende for alt liv; uden vand ville alle levende væsener dø.
Vand dækker ca. 70 % af Jordens overflade, og det udgør 65-75 % af vores kroppe (82 % af vores blod er vand). Selv om vand kan virke kedeligt – ingen farve, smag eller lugt – har det fantastiske egenskaber, der gør det nødvendigt for at opretholde livet.
(Vores behov for vand og havets dyr, der lever i vand, er det, der gør olieudslip så skadelige.)
Vandets kemiske sammensætning er H2O – to brintatomer og et iltatom. Vandets egenskaber er specielle på grund af den måde, hvorpå dets atomer binder sig sammen til et vandmolekyle, og den måde, hvorpå molekylerne interagerer med hinanden.
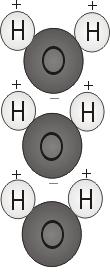
Vandets polaritet
Når de to brintatomer binder sig til ilten, sætter de sig fast på toppen af molekylet lidt ligesom Mickey Mouse-ører. Denne molekylære struktur giver vandmolekylet polaritet, eller en skæv elektrisk ladning, der tiltrækker andre atomer.
Enden af molekylet med de to hydrogenatomer er positivt ladet. Den anden ende, med ilten, er negativt ladet. Ligesom i en magnet, hvor nordpoler tiltrækkes af sydpoler (“modsætninger tiltrækkes”), vil den positive ende af vandmolekylet forbinde sig med den negative ende af andre molekyler.
Hvad betyder det for os? Vandets polaritet gør, at det meget let kan opløse andre polære stoffer. Når et polært stof kommes i vand, tiltrækkes de positive ender af dets molekyler af de negative ender af vandmolekylerne, og omvendt. Tiltrækningerne får molekylerne i det nye stof til at blive blandet ensartet med vandmolekylerne.
Vand opløser flere stoffer end nogen anden væske – selv den stærkeste syre! På grund af dette kaldes det ofte for “det universelle opløsningsmiddel”. Vandets opløsende evne er meget vigtig for livet på Jorden. Uanset hvor vand bevæger sig hen, bærer det opløste kemikalier, mineraler og næringsstoffer med sig, som bruges til at støtte levende væsener.
På grund af deres polaritet tiltrækkes vandmolekyler stærkt af hinanden, hvilket giver vand en høj overfladespænding. Molekylerne på vandets overflade “klæber sammen” og danner en slags “hud” på vandet, der er stærk nok til at bære meget lette genstande. Insekter, der går på vand, udnytter denne overfladespænding.
Overfladespændingen får vandet til at klumpe sig sammen i dråber i stedet for at sprede sig ud i et tyndt lag.
Det gør det også muligt for vand at bevæge sig gennem planterødder og -stængler, termometre og de mindste blodkar i din krop. Når et molekyle bevæger sig opad, ‘trækker’ det de andre med sig.
Tre stoftilstande
Vand er et af fire grundstoffer og det eneste naturlige stof, der kan eksistere i alle tre stoftilstande – fast stof, væske og gas – ved de temperaturer, der normalt findes på Jorden.
Mange andre stoffer skal overophedes eller afkøles for at skifte tilstand.
Vandets gasformige tilstand findes konstant i vores atmosfære som vanddamp. Den flydende tilstand findes overalt i floder, søer og oceaner.
Vandets faste tilstand, is, er enestående. De fleste væsker trækker sig sammen, når de afkøles, fordi molekylerne bevæger sig langsommere og har mindre energi til at modstå tiltrækningen til hinanden. Når de fryser til faste stoffer, danner de tætpakkede krystaller, der er meget tættere, end væsken oprindeligt var.
Vand opfører sig ikke på denne måde. Når det fryser, udvider det sig: molekylerne stiller sig på række og danner en meget “åben” krystallinsk struktur, der er mindre tæt end flydende vand.
Det er derfor, at is flyder. Og det er en god ting, at den gør det! Hvis vand opførte sig som de fleste andre væsker, ville søer og floder fryse fast, og alt liv i dem ville dø.
Tre andre egenskaber ved vand
Vand har en høj specifik varme. Det vil sige, at vand i modsætning til luft kan optage meget varme uden at ændre temperatur. Det er derfor, at svømning føles så forfriskende på en varm dag.
Vand taber også varme langsommere end luft. Resultatet er, at sø- og havvand om sommeren normalt er koldest tidligt på sæsonen og varmest sent på sæsonen (efter at have absorberet solens energi i mange dage).
Vandets kogepunkt (212° F eller 100 °C på havniveau) påvirkes af højden. Generelt gælder det, at jo større højde, jo lavere er vandets kogepunkt. I Denver, CO (5.280 fod) koger vand f.eks. ved 202,4° F. På Mount Everest i Nepal (29.012 fod) koger vand ved 156° F.
Vandvidenskabelige projekter om vand:
- Vandets kredsløb
- Vandhjulet
- Superkølet vand
- Vandreservoir