Atomer kan få eller miste elektroner for at danne ioner i en proces, der kaldes ionisering (forbindelser, der dannes på denne måde, kaldes ionforbindelser). Når ionforbindelser opløses i vand, adskilles deres ioner fra hinanden i en proces, der kaldes dissociation. En interessant egenskab ved vand og mange andre kovalente forbindelser er, at de også kan dissocieres til ioner. I modsætning til ionforbindelser, såsom natriumchlorid, er de ikke ioniseret, før de dissocieres; de gennemfører ionisering og dissociation på samme tid.
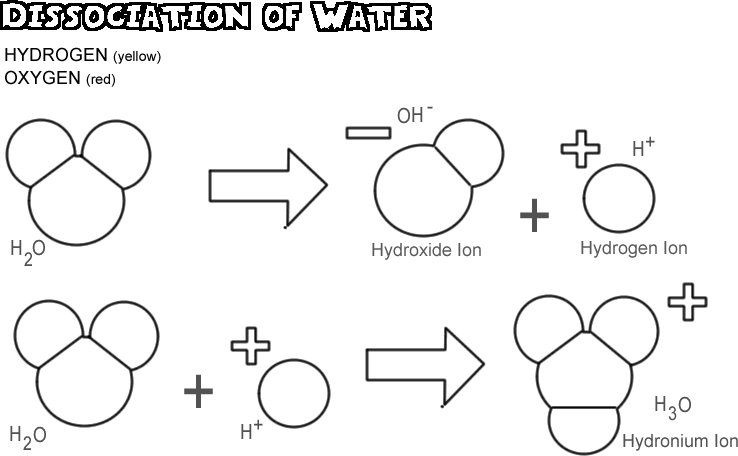
Vandets dissociation
Når vand dissocieres, efterlader en af hydrogenkernerne sin elektron sammen med oxygenatomet og bliver til en hydrogenion, mens oxygen- og de andre hydrogenatomer bliver til en hydroxid-ion. Da hydrogenionen ikke har nogen elektron til at neutralisere den positive ladning på dens proton, har den en hel enhed med positiv ladning og symboliseres som H+. Hydroxidionen beholder den elektron, der er tilbage, og har derfor en fuld enhed af negativ ladning, symboliseret med OH-. Hydrogenionen (protonen) vandrer ikke længe alene, før den binder sig til iltatomet i et andet uioniseret vandmolekyle og danner en hydroniumion (H3O +)
I en vandprøve er meget få af molekylerne dissocieret på et hvilket som helst tidspunkt: faktisk kun ca. et ud af 550 millioner. Der sker dog en konstant forandring; når en hydrogenion igen knytter sig til en hydroxidion for at danne et vandmolekyle, dissocieres et andet vandmolekyle for at erstatte hydrogenionen og hydroxidionen i opløsningen.
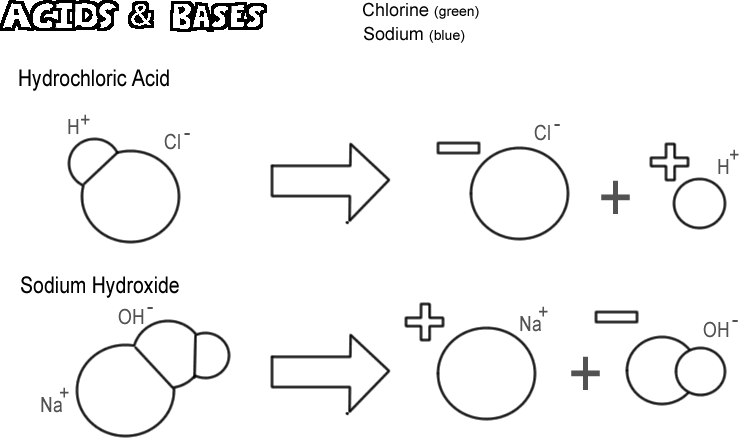
Hydrochlorsyre
Visse molekyler, ioniske og kovalente, dissocieres på en sådan måde, at de frigiver en hydrogenion uden at frigive en hydroxidion. Disse stoffer kaldes syrer. Da en hydrogenion i virkeligheden kun er en enkelt proton i de fleste tilfælde, er kemikerens definition af en syre en “protonedonor”. Hvis meget mange protoner (hydrogenioner) “doneres”, kan virkningen være meget dybtgående, f.eks. at huden brænder eller at metal opløses. Den syre, der er illustreret, er saltsyre. Ren saltsyre er en gas, men den opløses let i vand og danner en opløsning af hydrogenioner og kloridioner. Da næsten det hele opløses i vand, kaldes den en stærk syre. Syrer, der ikke dissocieres fuldstændigt, kaldes svage syrer.
Natriumhydroxid
Det modsatte af en syre er en base, også kendt som en alkali. En typisk stærk base er natriumhydroxid, som er hovedbestanddelen i lud. Natriumhydroxid dissocieres for at danne en natriumion og en hydroxidion. En base er defineret som en “protonacceptor”. De mest almindelige baser danner hydroxidioner, når de dissocierer, og det er hydroxidionen, der accepterer protonerne. En stærk base kan give din hud en meget værre forbrænding end en syre.
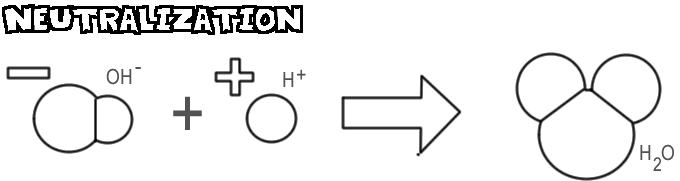
Neutralisering
Når en base og en syre blandes, kombineres hydroxidionen og basen med hydrogenionen fra syren for at danne vand. Denne proces kaldes neutralisering.
Spørgsmål:
1. Hvad sker der, når et atom får eller mister en elektron?