Vi er alle mutanter. Hver eneste egenskab, der definerer vores art, er resultatet af en genetisk mutation et eller andet sted i evolutionens historie. Og det samme gælder for alle andre organismer på planeten. Alligevel tænker vi oftest på mutationer som noget dårligt, der fører til handicap eller sygdom. Hvor ofte er disse ændringer i DNA’et så skadelige, og hvor mange af dem er potentielt nyttige? En ny undersøgelse tyder på, at dødelige mutationer måske er langt mindre almindelige, end vi engang troede, i hvert fald i bakterier.
De fleste DNA-mutationer skyldes fejl, der sker, når en celle laver en kopi af alle sine genetiske oplysninger, så den kan dele sig i to nye celler. Bakterier som E. coli skal kopiere omkring fem millioner bogstaver af DNA-koden. For mennesker er det omkring 3,2 milliarder DNA-bogstaver i æg og sæd og det dobbelte antal i andre kropsceller.
Trods sofistikerede systemer til at opdage og reparere kopieringsfejl, efterhånden som de opstår, slipper nogle af dem af og til igennem nettet. De fleste resulterer i det, der kaldes “punktmutationer”, da de kun omfatter en enkelt ændring af et enkelt DNA-bogstav. Men selv disse kan undertiden føre til store ændringer og ændre generne og de proteiner, de producerer. Dette kan igen påvirke den måde, kroppen vokser eller fungerer på.
Mutationer kan være drivkraften bag evolutionen, hvis de giver et individ en fordel, der betyder, at det er mere sandsynligt, at det vil overleve og få børn og give det muterede gen videre. Chancen for, at tilfældige mutationer i millioner eller milliarder af bogstaver i koden kan virke fordelagtige, kan synes lille. Men livet på Jorden har eksisteret i fire milliarder år, så evolutionens tidshorisonter er enorme.
Midlertid kan mutationer også forårsage alvorlige sundhedsproblemer, hvoraf nogle også kan være arvelige. Forskere i Frankrig forsøgte for nylig at finde ud af, hvor ofte mutationer faktisk er skadelige, idet de brugte E. coli-bakterier som model. Lydia Roberts og hendes kolleger brugte en genial teknik, der gjorde det muligt for dem at visualisere DNA-ændringer, der skete, mens bakterierne faktisk delte sig.
Den sædvanlige måde at estimere mutationshyppigheden i bakterier på indebærer, at man dyrker dem på agarplader, plastikfade, der indeholder en næringsrig gelé for mikrober. Men problemet med denne fremgangsmåde er, at bakterier, der får en dødelig mutation, naturligvis dør, så information om disse genetiske ændringer går permanent tabt.
For at omgå dette brugte de franske forskere en lille chip, der indeholder 1.000 mikroskopiske kanaler, hvortil flydende næringsstofbuljong leveres. Nye celler, der produceres efter hver celledeling, forbliver i kanalerne, uanset eventuelle skadelige mutationer, der kan påvirke deres overlevelse.
Teamet brugte derefter tidsforløbsbilleder kombineret med en fluorescerende markør, der blinkede, hver gang en mutation opstod. Dette producerede imponerende videoer af de mangfoldige, muterende bakterier, der minder om de kodelinjer, der er afbildet i sci-fi-filmen The Matrix.
Resultaterne, der er offentliggjort i Science, tyder på, at punktmutationer i bakterier opstår med en konstant hastighed på omkring én hver 600. time. Til forskernes overraskelse opdagede de også, at kun omkring 1 % af disse DNA-ændringer var dødelige for bakterierne – langt færre end tidligere antaget.
Det ser ud til, at de fleste mutationer i bakterier i det mindste ikke har nogen effekt på overlevelsen overhovedet. De er hverken “dårlige” eller “gode”, men blot evolutionære tilskuere. Forskere, der arbejder på at forstå, hvordan genetiske mutationer forårsager sygdom hos mennesker, stiller lignende spørgsmål. Resultaterne fra store projekter som f.eks. det britiske 100.000 genomes-projekt bør bidrage til at afsløre, hvilke mutationer der forårsager sygdom, og hvilke der er uden betydning.
Bredt fra godt og skidt
Men vi ved også, at det nogle gange kan være meget vanskeligt at kategorisere mutationer som gode eller dårlige. Ofte afhænger det af konteksten, f.eks. om mutationen hjælper organismen med at udnytte en bestemt fødekilde eller med at bekæmpe en sygdom, der er til stede i dens levetid. Og nogle mutationer kan være gavnlige, hvis kun én kopi går i arv, men skadelige, hvis to kopier går i arv. Et eksempel på en genmutation, der er genstand for denne form for “balancerende udvælgelse”, er seglcellesygdom.
Personer med seglcellesygdom har en genmutation, der producerer en ændret form af hæmoglobin, det protein i de røde blodlegemer, der transporterer ilt rundt i kroppen. Det ændrede hæmoglobin giver lange seglformede blodlegemer, som kan sidde fast i små blodkar. Dette forårsager smerter i brystet og leddene samt blodmangel, øget risiko for infektioner og andre problemer.
Men på trods af disse potentielt ødelæggende sundhedsmæssige virkninger er sygdommen relativt almindelig i visse lande. Det anslås, at 300.000 spædbørn, der arver to kopier af seglcellegenmutationen (en fra hver forælder), fødes med sygdommen hvert år, hovedsagelig i Nigeria, Den Demokratiske Republik Congo og Indien.
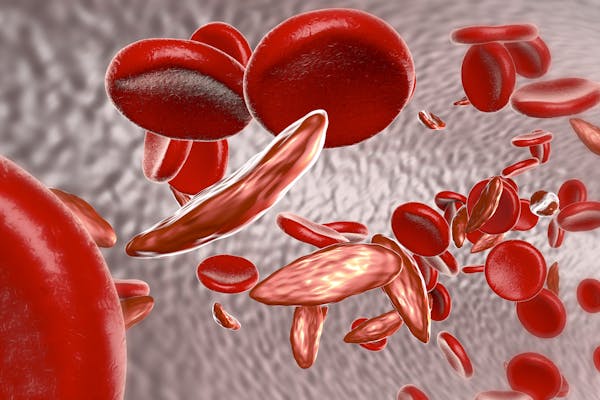
Dette skyldes, at personer med en kopi af mutationen er resistente over for malaria og dermed har større sandsynlighed for at overleve til voksenalderen og give det muterede gen videre til deres børn. Så selv om det at have seglsyge er en evolutionær ulempe, har uberørte bærere af genmutationen en overlevelsesfordel i lande, hvor malaria var (eller stadig er) udbredt.
En nyere amerikansk undersøgelse tyder på, at alle mennesker, der lever med sygdommen i dag, nedstammer fra en enkelt forfader, der levede for omkring 7.300 år siden i enten Sahara eller Vest-centralafrika. Dette viser, hvordan en enkelt mutation kan sprede sig til mange, mange individer i en befolkning, hvis den giver en betydelig fordel, selv om den også har potentiale til at gøre skade. På samme måde er der tegn på, at en enkelt kopi af mutationen i cystisk fibrose-genet kan have givet vores forfædre modstandsdygtighed over for kolera, og at bærere af Tay-Sachs-sygdommen har tuberkuloseresistens.
En bedre forståelse af virkningerne af mutationer kan spille en stor rolle i behandlingen af sygdomme. For eksempel kunne studier af mutationsrater i forskellige celletyper kaste lys over, hvordan kræft opstår i forskellige kropsvæv. Og en forståelse af bakterielle mutationsrater kunne hjælpe forskere med at bekæmpe mikrober, der har udviklet resistens over for antibiotika. Dette vil i sidste ende være med til at indlede en ny æra inden for lægevidenskaben, hvor mange sygdomme vil kunne diagnosticeres og behandles ved hjælp af genetisk information. Og det må være godt.