J Cancer 2020; 11(6):1341-1350. doi:10.7150/jca.40817
Forskningspapir
Amy C. Moreno1, Yan Heather Lin2, Isabelle Bedrosian3, Yu Shen2, Gildy V. Babiera3, Simona F. Shaitelman1 ![]()
1. Department of Radiation Oncology, The University of Texas MD Anderson Cancer Center, Houston, TX.
2. Department of Biostatistics, The University of Texas MD Anderson Cancer Center, Houston, TX.
3. Department of Surgical Oncology, The University of Texas MD Anderson Cancer Center, Houston, TX.
Moreno AC, Lin YH, Bedrosian I, Shen Y, Babiera GV, Shaitelman SF. Resultater efter behandling af metaplastisk versus andre brystkræftsubtyper. J Cancer 2020; 11(6):1341-1350. doi:10.7150/jca.40817. Available from https://www.jcancer.org/v11p1341.htm
Søgsmål: Metaplastisk brystkræft (BC) er en ualmindelig, men aggressiv histologisk undertype af BC. Vi søgte at identificere faktorer forbundet med dens diagnose og sammenligne håndteringen og resultaterne af metaplastisk BC med dem af andre BC’er og trippelnegativ invasiv duktalkarcinom i særdeleshed i betragtning af, hvor ofte den har en trippelnegativ fænotype.
Patienter og metoder: Vi identificerede kvinder, der blev diagnosticeret med invasiv BC i 2010-2014 i den nationale kræftdatabase, og brugte univariat analyse til at sammenligne baseline patient- og tumorkarakteristika efter BC-subtype. Samlet overlevelse (OS) blev estimeret med Kaplan-Meier-metoden, og multivariate Cox proportional hazards-modeller blev brugt til at identificere uafhængige prædiktorer for OS.
Resultater: Af 247.355 tilfælde var 2.084 (0,8%) metaplastisk BC, 55.998 (23%) triple negativ BC og 77% anden BC. I forhold til ikke-metaplastisk BC var kvinder med metaplastisk BC mere tilbøjelige til at være ældre ved diagnosen (medianalder, 62 vs. 59 år), have ≥1 komorbid tilstand (22% vs. 18%) og være på Medicare (41% vs. 33%; P<0.001). Metaplastiske BC’er havde en tendens til at være basallignende (77 %), og i forhold til triple-negative eller andre BC’er var metaplastiske BC’er forbundet med højere klinisk T-status (cT3-4, 18 % vs. 11 %, 8 %), ingen klinisk nodal involvering (cN0, 86 %, 77 %, 80 %), ingen lymfekredsløbsinvasion (72 %, 65 %, 62 %) og højgrads tumorer (71 %, 77 %, 35 %) (P<0,001). De fleste metaplastiske BC’er blev behandlet med mastektomi (58 %), sentinel lymfeknudeudskæring (65 %), bestråling af brystvæggen eller brystet (74 %) og kemoterapi (75 %) som adjuverende behandling (60 %). Ved en medianopfølgningstid på 44,5 måneder var OS-raterne lavere for metaplastisk BC end for triple-negativ eller anden BC på tværs af alle kliniske stadier efter 5 år (stadium I, 85 %, 87 %, 91 %; II, 73 %, 77 %, 87 %; III, 43 %, 53 %, 75 %) og efter 3 år (stadium IV, 15 %, 22 %, 64 %; P<0,001). Ved multivariat analyse var stigende alder, fremskredent klinisk stadium, lymfekarinvasion, axillær (vs. sentinel) knudeudedissektion og ingen stråle- eller kemoterapi forbundet med dårligere resultater i metaplastisk BC. Omfanget af kirurgi påvirkede overlevelsen for triple-negativ og anden BC, men ikke for metaplastisk BC.
Konklusion: Resultaterne for metaplastisk BC er fortsat dårligere end resultaterne for andre BC-subtyper på trods af moderne behandlinger. Optimering af systemiske behandlingsmuligheder, som var en væsentlig prædiktor for overlevelse, bør være en prioritet i håndteringen af metaplastisk BC.
Nøgleord: metaplastisk brystkræft, trippelnegativ brystkræft, resultater af brystkræft, stråleterapi, kemoterapi.
Indledning
Selv om brystkræft er den mest almindelige kræftdiagnose, der rammer kvinder, med mere end 268.000 tilfælde dokumenteret årligt, udgør metaplastisk brystkræft (BC) mindre end 1-2 % af alle brystkræfttilfælde. Klinisk viser metaplastisk BC sig som en hurtigt voksende brystmasse med kompleks ekkogenicitet (dvs. solide og cystiske komponenter) på ultralydsundersøgelse og en masse med høj tæthed på mammografi. Histologisk set består metaplastisk BC af en heterogen population af tumorer, der kan klassificeres efter tilstedeværelsen af ikke-glandulære eller mesenkymale celletyper eller ved yderligere kategorisering i undertyper afhængigt af tilstedeværelsen af forskellige karakteristika såsom osteoklastiske kæmpeceller eller spindelceller.
Ved præsentationen er den kliniske lymfeknudeinvolvering ved metaplastisk BC typisk lav. Metaplastisk BC diagnosticeres imidlertid oftere i fremskredne kliniske stadier på grund af større primærtumorer sammenlignet med andre BC’er og er forbundet med en højere grad af kemoresistens, fjernmetastasering og dårligere samlet overlevelse (OS). Metaplastisk BC har en særlig høj prævalens af triple-negativ receptorstatus eller fravær af østrogenreceptor, progesteronreceptor og human epidermal vækstfaktorreceptor 2 (HER2)-amplificering. Uden målbare proteiner er metaplastisk BC fortsat en udfordring at behandle. Der er kun begrænsede prospektive data til at vælge den bedste behandling af metaplastisk BC på grund af diagnosens sjældenhed. I stedet er en stor del af den nuværende behandlingsstandard for metaplastisk BC blevet ekstrapoleret ud fra resultaterne af små serier fra enkelte institutioner eller fra caserapporter. Vi brugte derfor National Cancer Data Base (NCDB), som omfatter ca. 70 % af alle diagnosticerede kræfttilfælde i USA, til at evaluere karakteristika, behandling og resultater baseret på behandling og tumorkarakteristika for patienter med metaplastisk BC sammenlignet med patienter med triple-negativ BC og alle andre BC-subtyper. Vi brugte også multivariat analyse til at identificere uafhængige prædiktorer for overlevelse for kvinder med metaplastisk BC.
Datakilde og kohorteudvælgelse
NCDB er et fælles projekt, der blev etableret i 1989 af Commission on Cancer of the American College of Surgeons og American Cancer Society, og har indsamlet onkologiske data fra ca. 1.500 akkrediterede faciliteter i USA, i alt over 34 millioner poster. De tilgængelige patientoplysninger er afidentificerede og er derfor fritaget for tilsyn med beskyttelse af mennesker af det institutionelle review board.
De udvælgelseskriterier, der blev anvendt til denne undersøgelse, er skitseret i figur 1. Kvinder på 18 år og derover, der blev diagnosticeret med invasiv brystkræft fra 2010 til 2014, blev inkluderet. Patienter med ukendt hormon (østrogen og progesteron) receptor (HR) status blev udelukket. Yderligere årsager til udelukkelse var manglende oplysninger om operation, kemoterapi eller klinisk stadieinddeling i henhold til American Joint Committee On Cancer (AJCC) 6. eller 7. udgave. Patienterne blev derefter stratificeret i tre grupper: 1-metaplastisk BC (med histologikoderne 8575 eller 8573), 2- trippelnegativ BC (TNBC, som kun omfattede ikke-metaplastiske histologier) og 3-alle andre resterende typer af BC. Udtrykket “ikke-metaplastisk BC” blev anvendt til at henvise til triple-negativ BC og anden BC kombineret.
CONSORT-diagram. BC, brystkræft.
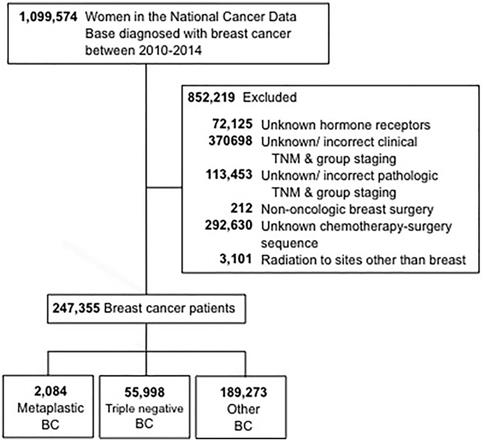 (Klik på billedet for at forstørre det.)
(Klik på billedet for at forstørre det.)
Variabler
Informationer indhentet og analyseret fra NCDB omfattede patientens alder ved diagnose, diagnoseår, race, Charlson/Deyo komorbiditetsindeks, sygesikringsstatus, medianhusstandsindkomst og behandlende facilitetstype (dikotomiseret i akademisk/forskningsmæssig versus ikke-akademisk). Klinisk-patologiske karakteristika omfattede AJCC-klinisk T- og N-betegnelse (nodal), samlet AJCC-klinisk stadiumgruppe, HR-status, HER2-receptorstatus, tumorstørrelse og lymfekredsløbsinvasion (LVSI). Molekylære subtyper blev defineret som værende HR(+)/HER2(-), HER2(+), triple-negativ (østrogenreceptor(-), progesteronreceptor(-), HER2(-)) eller ukendt. Patienter med metaplastisk BC med triple-negativ receptorstatus blev betegnet som tn-metaplastisk BC for at skelne dem fra ikke-metaplastisk TNBC. Den primære behandling omfattede kirurgi (enten brystbevarende, mastektomi eller ingen), strålebehandling med eller uden inddragelse af regional nodal bestråling, kemoterapi (neoadjuverende, adjuverende eller ingen) og hormonbehandling. Kirurgisk behandling af axillaen blev defineret som enten en axillær knudedissektion (ALND), hvor 10 lymfeknuder eller mere blev fjernet, eller en sentinel lymfeknudedissektion (SLND), når <10 lymfeknuder blev fjernet.
Statistisk analyse
Univariate analyse blev anvendt til at evaluere potentielle sammenhænge mellem demografiske, tumor- og kliniske karakteristika og en diagnose af metaplastisk BC ved hjælp af chi-square-test for kategoriske variabler og t-test/variansanalyse eller deres modstykker af de ikke-parametriske tilgange (Wilcoxon rank-sum eller Kruskal-Wallis) for kontinuerlige variabler. OS blev defineret som perioden fra diagnosetidspunktet til dødstidspunktet. OS-tiden for de overlevende patienter blev højrecensureret på tidspunktet for den sidste kontakt. Fordelingen af OS blev vurderet ved hjælp af Kaplan-Meier-metoden. Log-rank-testen blev anvendt til at teste forskellen i overlevelse mellem grupperne. Regressionsanalyser af overlevelsesdata baseret på Cox proportional hazards-modellen blev udført på OS. En multivariat Cox proportionalhazards-model blev opnået ved først at inkludere et indledende sæt af kandidatprædiktorvariabler med en P-værdi < 0,05 i den univariate analyse. Derefter blev der anvendt trinvis baglæns eliminering med 0,05 som signifikansniveau for Wald-chi-square for, at en effekt skulle forblive i modellen.
Overlevelsesanalyser blev udført inden for hver af kræfttyperne separat.
Hospitalets beliggenhed og type blev ikke medtaget i udvælgelsesprocessen for metaplastisk BC-modellen, fordi ingen af faktorerne var statistisk signifikante for denne gruppe i den univariate indstilling, og data var ikke fuldt ud tilgængelige for patienter under 40 år. For at undersøge, om detaljerne i systemisk terapi og strålebehandling påvirkede resultaterne blandt patienter med metaplastisk BC, udførte vi subgruppeanalyser på denne kohorte for at evaluere den potentielle indflydelse af kemoterapisekvensering og omfanget af strålemål på OS. Alle tests var tohalede, og statistisk signifikans blev defineret som en P-værdi <0,05. SAS version 9.4 (SAS Institute, Cary, NC) og S-Plus version 8.2 (TIBCO Software Inc, Palo Alto, CA) blev anvendt til at udføre beregningerne for alle analyser.
Kohorte- og tumorkarakteristika
Vi identificerede 247.355 kvinder med en diagnose af invasiv brystkræft i 2010-2014, hvoraf 0,8 % (n=2.084) havde metaplastisk BC, 23 % (n=55.998) TNBC og 77 % (n=189.273) havde anden BC. Patienternes sociodemografiske, kliniske og patologiske tumorkarakteristika og behandlingskarakteristika efter BC-type er vist i tabel 1. Medianalderen var 63 år (interval 22-90) for kvinder med metaplastisk BC og 59 år (interval 18-90) år for både TNBC og anden BC. Kvinder med metaplastisk BC havde oftere en komorbiditetsscore på ≥1 (22 % vs. 18 % TNBC vs. 16 % anden BC) og havde offentlig forsikring (50 % vs. 42 % TNBC vs. 41 % anden BC) (alle P<0,001). Diagnosen metaplastisk BC eller TNBC var oftere forbundet med sort race end anden BC (18 % vs. 21 % vs. 11 %, P<0,001).
Signifikante forskelle i klinisk sygdomsstadie og tumorkarakteristika blev set efter kræfttype. Metaplastisk BC blev ofte diagnosticeret i mere avancerede stadier, idet kun 31 % af patienterne med metaplastisk BC havde klinisk stadium I-sygdom mod 46 % af TNBC og 54 % af anden BC (P<0,001). Dette mønster syntes at korrelere med højere forekomst af større tumorer i den metaplastiske BC-gruppe (cT3-4, henholdsvis 18 % vs. 11 % vs. 8 %), men tilstedeværelsen af klinisk nodal involvering var den laveste for metaplastisk BC (cN1-3, henholdsvis 14 % vs. 23 % vs. 20 %) (alle P<0,001). I modsætning til den kliniske nodalstatus var satsen for patologisk nodal involvering lidt lavere for metaplastisk BC og TNBC, men fordoblet for anden BC (pN1-3, 18 % vs. 26 % vs. 40 %, henholdsvis, P<0,001). Med hensyn til receptorstatus havde 77 % af den metaplastiske BC-gruppe tn-metaplastisk BC, hvilket er 3,4 gange højere end den ikke-metaplastiske BC-gruppe (23 %), hvoraf HR(+)/HER2(-) var den mest almindelige molekylære subtype med 59 % (P<0,001). Desuden var kun 5 % af metaplastisk BC HER2(+) sammenlignet med 16 % af ikke-metaplastisk BC. Både metaplastisk BC og TNBC havde næsten dobbelt så stor en andel af grad 3-tumorer i forhold til anden BC (henholdsvis 71 %, 77 % og 35 %, P<0,001), og metaplastisk BC havde lavere LVSI-frekvens i forhold til TNBC og anden BC (henholdsvis 13 %, 20 % og 24 %, P<0,001).
Patient- og behandlingskarakteristika.
| Karakteristik | Metaplastisk BC, Antal (%) | Triple-Negativ BC, Antal (%) | Andre BC, Antal (%) | Andre BC, Antal (%) | (%) | P-værdi |
|---|---|---|---|---|---|---|
| Medianalder, år (interval) | 62 (22-90) | 59 (18-90) | 59 (18-90) | <0.001 | ||
| Race | ||||||
| Hvid | 1623 (77.9) | 41791 (74.6) | 158406 (83.7) | <0.001 | ||
| Sort | 368 (17.7) | 11771 (21) | 20722 (10.9) | |||
| Andre | 80 (3.8) | 2041 (3.6) | 8507 (4.5) | |||
| Ukendt | 13 (0.6) | 395 (0.7) | 1638 (0.9) | |||
| Komorbiditetsscore | ||||||
| 0 | 1635 (78.5) | 45882 (81.9) | 158177 (83.6) | <0.001 | ||
| 1 | 349 (16.7) | 8107 (14.5) | 25524 (13.5) | |||
| >=2 | 100 (4.8) | 2009 (3.6) | 5572 (2.9) | |||
| Medianindkomst | ||||||
| <30.000$ | 251 (12) | 7110 (12.7) | 19154 (10.) | <0.001 | ||
| $30,000-$34,999 | 332 (15.9) | 9081 (16.2) | 28472 (15) | |||
| $35,000-$45,999 | 580 (27.8) | 15084 (26.9) | 48845 (25.8) | |||
| $46,000+ | 858 (41.2) | 23050 (41.2) | 86637 (45.8) | |||
| Ukendt | 63 (3) | 1673 (3) | 6165 (3.3) | |||
| Medicinsk forsikring | ||||||
| Privat | 975 (46.8) | 30263 (54) | 105839 (55.9) | <0.001 | ||
| Medicaid | 154 (7.4) | 4716 (8.4) | 13267 (7) | |||
| Medicare | 862 (41.4) | 18355 (32.8) | 61535 (32.5) | |||
| Andet | 19 (0.9) | 665 (1.2) | 2212 (1.2) | |||
| Uforsikret | 43 (2.1) | 1422 (2.5) | 4163 (2.2) | |||
| Ukendt | 31 (1.5) | 577 (1) | 2257 (1.2) | |||
| County type | ||||||
| Metropolitan | 1720 (82.5) | 46252 (82.6) | 157058 (83) | 0.152 | ||
| By | 271 (13) | 7456 (13.3) | 24367 (12.9) | |||
| Landdistrikter | 43 (2.1) | 951 (1.7) | 3219 (1.7) | |||
| Ukendt | 50 (2.4) | 1339 (2.4) | 4629 (2.4) | |||
| Facilitetstype | ||||||
| Akademisk | 668 (32.1) | 16117 (28.8) | 52120 (27.5) | <0.001 | ||
| Ikke-akademisk | 1318 (63.2) | 35472 (63.3) | 126101 (66.6) | |||
| Ukendt | 98 (4.7) | 4409 (7.9) | 11052 (5.8) | |||
| Facilitets beliggenhed | ||||||
| Midtvesten | 614 (29.5) | 14132 (25.2) | 46644 (24.6) | <0.001 | ||
| Nordøst | 410 (19.7) | 10411 (18.6) | 37787 (20) | |||
| Syd | 716 (34.4) | 20595 (36.8) | 66519 (35.1) | |||
| Vest | 246 (11.8) | 6451 (11.5) | 27271 (14.4) | |||
| Ukendt | 98 (4.7) | 4409 (7.9) | 11052 (5.8) | |||
| Klinisk sygdomsstadie | ||||||
| I | 639 (30.7) | 25843 (46.1) | 102257 (54) | <0.001 | ||
| II | 1215 (58.3) | 23912 (42.7) | <0.001 | |||
| II | 1215 (58.3) | 23912 (42.7) | 70846 (37.4) | |||
| III | 201 (9.6) | 5579 (10) | 14283 (7.5) | |||
| IV | 29 (1.4) | 664 (1.2) | 1887 (1) | |||
| Klinisk T-status | ||||||
| cT0 | 5 (0.2) | 131 (0.2) | 341 (0.2) | <0.001 | ||
| cT1 | 674 (32.3) | 28452 (50.8) | <0.001 | |||
| cT1 | 674 (32.3) | 28452 (50.8) | 113113 (59.8) | |||
| cT2 | 1026 (49.2) | 21530 (38.4) | 61145 (32.3) | |||
| cT3 | 252 (12.1) | 3702 (6.6) | 10061 (5.3) | |||
| cT4 | 127 (6.1) | 2183 (3.9) | 4613 (2.4) | |||
| Klinisk N-status | ||||||
| cN0 | 1787 (85.7) | 43357 (77.4) | 150890 (79.7) | <0.001 | ||
| cN1 | 224 (10.7) | 9659 (17.2) | 30427 (16.1) | |||
| cN2 | 51 (2.4) | 1804 (3.2) | 5414 (2.9) | |||
| cN3 | 22 (1.1) | 1178 (2.1) | 2542 (1.3) | |||
| Patologisk stadium | ||||||
| 0 | 45 (2.2) | 4314 (7.7) | 5361 (2.8) | <0.001 | ||
| 1 | 582 (27.9) | 24787 (44.3) | 81680 (43.2) | |||
| 2 | 1223 (58.7) | 20790 (37.1) | 72445 (38.3) | |||
| 3 | 210 (10.1) | 5675( 10.1) | 28323 (15) | |||
| 4 | 24 (1.2) | 432 (0.8) | 1464 (0.8) | |||
| Patologisk T-status | ||||||
| pTis | 7 (0.3) | 432 (0.8) | 1862 (1) | <0.001 | ||
| pT0 | 42 (2) | 4250 (7.6) | 3972 (2.1) | |||
| pT1 | 634 (30.4) | 29055 (51.9) | 106130 (56.1) | |||
| pT2 | 1017 (48.8) | 18530 (33.1) | 63484 (33.5) | |||
| pT3 | 290 (13.9) | 2540 (4.5) | 10588 (5.6) | |||
| pT4 | 93 (4.5) | 1097 (2) | 2892 (1.5) | |||
| pTX | 1 (0) | 94 (0.2) | 345 (0.2) | |||
| Patologisk N-status | ||||||
| pN0 | 1705 (81.9) | 41587 (74.3) | 113787 (60.2) | <0.001 | ||
| pN1 | 284 (13.6) | 9725 (17.4) | 51483 (27.2) | |||
| pN2 | 66 (3.2) | 3031 (5.4) | 16111 (8.5) | |||
| pN3 | 27 (1.3) | 1607 (2.9) | 7685 (4.1) | |||
| Receptorgruppering | ||||||
| HR(+)/HER2(-) | 334 (16) | 0 (0) | 143687 (75.9) | <0.001 | ||
| Triple negativ | 1604 (77) | 55998 (100) | 0 (0) | |||
| HER2(+) | 97 (4.7) | 0 (0) | 38726 (20.5) | |||
| Ukendt | 49 (2.4) | 0 (0) | 6860 (3.6) | |||
| Tumorgrad | ||||||
| 1 | 41 (2) | 988 (1.8) | 32015 (16.9) | <0.001 | ||
| 2 | 237 (11.4) | 9050 (16.2) | 80590 (42.6) | |||
| 3 | 1485 (71.3) | 42930 (76.7) | 65482 (34.6) | |||
| 4 | 37 (1.8) | 286 (0.5) | 438 (0.2) | |||
| Ukendt | 284 (13.6) | 303030 (5.4) | 11186 (5.9) | |||
| LVSI | ||||||
| Ikke til stede | 1505 (72.2) | 36400 (65) | 118082 (62.4) | <0.001 | ||
| Til stede | 263 (12.6) | 11091 (19.8) | <0.001 | |||
| Til stede | 263 (12.6) | 11091 (19.8) | 45681 (24.1) | |||
| Ukendt | 316 (15.2) | 8507 (15.1) | 25510 (13.4) | |||
| Kirurgitype | ||||||
| BCS | 876 (42) | 29142 (52) | 92022 (48.6) | <0.001 | ||
| Mastektomi | 1200 (57.6) | 26561 (47.4) | 95910 (50.7) | |||
| Ingen operation | 8 (0,4) | 295 (0.5) | 1341 (0,7) | |||
| Axillær kirurgi | ||||||
| Ingen kirurgi | 47 (2.3) | 1034 (1.8) | 4433 (2.3) | <.001 | ||
| SLND | 1353 (64.9) | 34880 (62.3) | 109718 (58) | |||
| ALND | 666 (32) | 19229 (34.3) | 73181 (38.7) | |||
| Ukendt | 18 (0.9) | 855 (1.5) | 1941 (1) | |||
| Strålebehandling | ||||||
| Ja | 1087 (52.2) | 33938 (60.6) | 109268 (57.7) | <.001 | ||
| Nej | 989 (47.5) | 21860 (39) | 79375 (41.9) | |||
| Ukendt | 8 (0.4) | 200 (0.4) | 630 (0.3) | |||
| Strålemål | ||||||
| Kun bryst/CW | 803 (73.9) | 24704 (72.8) | 72410 (66.3) | <0.001 | ||
| Bryst/CW + Regionale knuder | 284 (26.1) | 9234 (27.2) | 36858 (33.7) | |||
| Kemoterapi | ||||||
| Ja | 1571 (75.4) | 44321 (79.1) | 133965 (70.8) | <0.001 | ||
| Nej | 499 (23.9) | 11195 (20) | 53062 (28) | |||
| Ukendt | 14 (0.7) | 482 (0.9) | 2246 (1.2) | |||
| Kemoterapi til kirurgisk sekvens | ||||||
| Adjuverende | 1241 (59,5) | 31519 (56.3) | 116645 (61.6) | <0.001 | ||
| Neoadjuvant | 324 (15.5) | 12581 (22,5) | 16717 (8,8) | |||
| Ingen | 519 (24.9) | 11898 (21.2) | 55911 (29.5) | |||
| Hormonbehandling | ||||||
| Ja | 220 (10.6) | 1178 (2.1) | 103906 (54.9) | <0.001 | ||
| Nej | 1798 (86.3) | 53274 (95.1) | 76820 (40.6) | |||
| Ukendt | 66 (3.2) | 1546 (2.8) | 8547 (4.5) | |||
| År for diagnose | ||||||
| 2010 | 309 (14.8) | 9605 (17.2) | 36712 (19.4) | <0.001 | ||
| 2011 | 393 (18.9) | 11163 (19.9) | 38815 (20.5) | |||
| 2012 | 458 (22) | 11205 (20) | 39364 (20.8) | |||
| 2013 | 463 (22.2) | 11992 (21.4) | 37764 (20) | |||
| 2014 | 461 (22.1) | 12033 (21.5) | 36618 (19.3) |
Afkortninger: BC, brystkræft; ALND, axillær lymfeknudeudskæring; BCS, brystbevarende kirurgi; CW, brystvæg; HER2, human epidermal vækstfaktorreceptor; HR, hormonreceptor; LVSI, lymfekarsvampinvasion; SLND, sentinel lymfeknudeudskæring.
Behandling efter brystkræfttype
De fleste patienter (99 %) gennemgik onkologisk brystkirurgi, herunder kirurgisk evaluering af aksillaen (97 %). Mastektomi blev oftere anvendt i den metaplastiske BC-gruppe (58 % vs. 47 % TNBC vs. 51 % andre BC, P<0,001), ligesom SLND (65 % vs. 62 % TNBC vs. 58 % andre BC; P<0,001). Regional nodal bestråling blev oftere anvendt som en del af behandlingen for anden BC end for metaplastisk BC og TNBC (henholdsvis 26 %, 27 % og 34 %; P<0,001).
Med hensyn til systemisk behandling blev neoadjuverende kemoterapi anvendt næsten dobbelt så ofte for metaplastisk BC og TNBC som for anden BC (16 %, 23 %, 9 %; P<0,001), og ca. en fjerdedel af alle kvinder modtog ingen kemoterapi. Hormonbehandling blev brugt mindst ofte til TNBC (2 %), men var en del af behandlingsparadigmet for 11 % af metaplastisk BC og 55 % af andre BC-tilfælde.
Survival Analysis
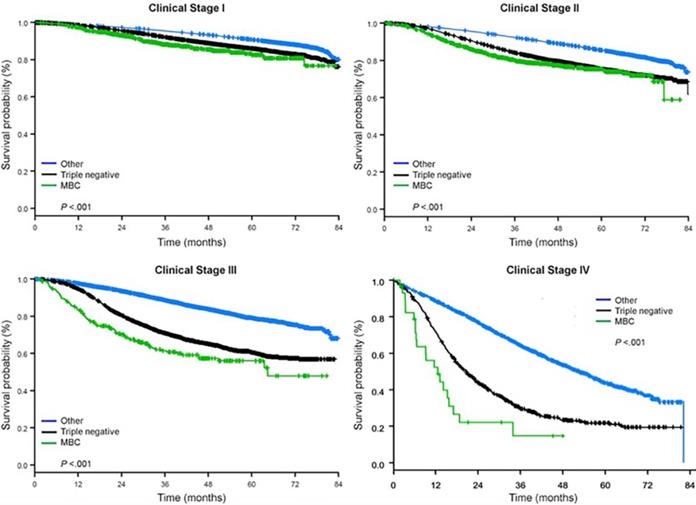
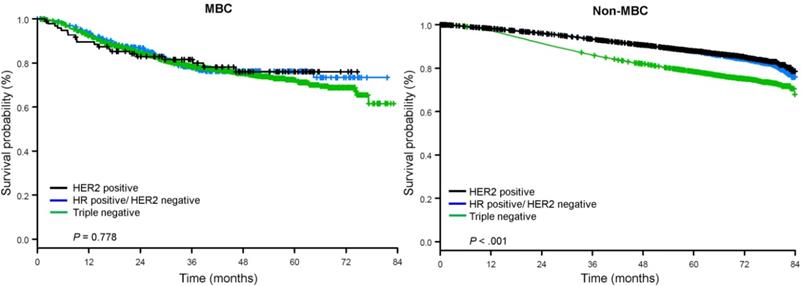
Medianen af opfølgningstiden var 44,5 måneder. Patienter med metaplastisk BC havde signifikant dårligere ujusteret OS uanset klinisk stadium (Fig. 2). De 5-årige OS-estimater for metaplastisk BC, TNBC og andre BC-patienter med sygdomsstadium I var 85 %, 87 % og 91 %; dem for stadium II var 73 %, 77 % og 87 %; og dem for stadium III var 43 %, 53 % og 75 % (P<0,001). 3-års OS-satserne for patienter med metastatisk sygdom var 2-4 gange højere for TNBC- og andre BC-grupper på 30 % og 64 % sammenlignet med 15 % for metaplastisk BC (P<0,001). Overlevelse efter molekylær subtype blev også analyseret (fig. 3). Blandt patienter med metaplastisk BC var der ingen forskelle i OS synlige efter molekylær subtype (HR(+)/HER2(-), HER2(+) eller tn-metaplastisk BC) (P=0,778). For ikke-metaplastisk BC var den trippelnegative subtype derimod forbundet med dårligere OS end HER+- og HR(+)/HER2(-)-subtyperne (P<0,001). Race syntes heller ikke at være forbundet med overlevelse blandt patienter med metaplastisk BC (5-års OS-rater 73 % for hvide vs. 74 % for sorte, P=0,876), mens race var forbundet med OS i både TNBC- (P<0,001) og andre BC-grupper (P<0,001; Fig. 4).
Gennemsnitlige overlevelseskurver for brystkræfttyper efter klinisk stadium, idet metaplastisk, trippelnegativ og anden brystkræft undersøges. Forkortelse: MBC, metaplastisk brystkræft.
 (Klik på billedet for at forstørre det.)
(Klik på billedet for at forstørre det.)
Gennemsnitlige overlevelseskurver for patienter med metaplastisk og ikke-metaplastisk brystkræft stratificeret efter receptorstatus. Forkortelser: HER2, human epidermal vækstfaktorreceptor 2; HR, hormonreceptor; MBC, metaplastisk brystkræft.
 (Klik på billedet for at forstørre.)
(Klik på billedet for at forstørre.)
Gennemsnitlige overlevelseskurver for patienter med metaplastisk, trippelnegativ og anden brystkræft stratificeret efter race. Forkortelser: (Klik på billedet for at forstørre det.)
Multivariabel analyse af faktorer, der er forbundet med den samlede overlevelse for patienter med metaplastisk BC.
| Faktorer, der er forbundet med den samlede overlevelse ved metaplastisk BC | ||||
|---|---|---|---|---|
| Variabel (reference) | Hasard Ratio (95% konfidensinterval) | P-værdi | ||
| Alder | Per år stigning | 1.024 (1.015-1.033) | <0.0001 | |
| Lymphovaskulær invasion (Ingen) | På nuværende tidspunkt | 1.307 (1.017-1.679) | 0.0364 | |
| Klinisk N-status (cN0) | cN+ | 1.758 (1.328-2.326) | <0.0001 | |
| Klinisk T-status (cT1) | cT0 | 2.226 (0.301-16.447) | <0.0001 | |
| cT2 | 1.454 (1.102-1.918) | |||
| cT3 | 3.029 (2.183-4.204) | |||
| cT4 | 3.145 (2.124-4.657) | |||
| Klinisk M-status (cM0) | cM1 | 3.330 (2.020-5.488) | <0.0001 | |
| Axillær kirurgi (SLND) | ALND | 1.333 (1.065-1.670) | 0.0247 | |
| Ingen kirurgi | 1.538 (0.884-2.675) | |||
| Stråling (Nej) | Ja | 0.709 (0.572-0.878) | 0.0016 | |
| Kemoterapi (Nej) | Ja | 0.579 (0.446-0.752) | <0.0001 | |
Afkortninger: ALND, akillær lymfeknudeudskæring; BC, brystkræft; SLND, sentinel lymfeknudeudskæring.
På multivariat analyse korrelerede stigende alder, højere klinisk T-klassifikation, tilstedeværelsen af klinisk nodal sygdom eller LVSI og behandling med ALND alle med dårligere resultater for patienter med metaplastisk BC, TNBC og anden BC (Supplerende tabel 1). Tilføjelse af kemoterapi og strålebehandling forbedrede begge uafhængigt OS uanset brystkræfttype. Andre patient- og tumorkarakteristika, der var forbundet med overlevelse i TNBC og anden BC, herunder race, komorbiditeter og tumorgrad, var ikke forbundet med overlevelsesresultater for metaplastisk BC ved multivariat analyse.
I betragtning af de relativt dårlige resultater blandt patienter med metaplastisk BC blev der foretaget subgruppeanalyser på gruppen af metaplastisk BC for at vurdere, om der var nogen behandlingsmodaliteter forbundet med bedre resultater. Efter justering for nodal status (cN0 vs. N+) var behandling med mere aggressiv axillær kirurgi (ALND vs. SLND) forbundet med dårligere resultater, et fænomen, som også blev set blandt TNBC og andre BC (tabel 2). Blandt dem, der modtog strålebehandling, havde behandling med regional nodal bestråling vs. bryst- eller brystvægsbestråling alene ingen signifikant indflydelse på resultaterne blandt patienter med metaplastisk BC (P=0,077 og 0,200 for henholdsvis klinisk N0 og N+). Modtagelse af neoadjuverende kemoterapi var forbundet med dårligere resultater end adjuverende kemoterapi blandt patienter med klinisk node-negativ metaplastisk BC (HR 1,9, 95% CI 1,3-2,6, P<0.001), men ikke for dem med klinisk node-positiv metaplastisk BC (P=0,43).
Diskussion
Metaplastisk brystkræft er en sjælden, men særligt aggressiv form for brystkræft, især sammenlignet med andre brysttumor-subtyper. Denne sygdomsenhed har været relativt underrepræsenteret i litteraturen. En omfattende søgning foretaget af Rayson et al. i publikationer fra 1966 til 1997 gav i alt kun 27 tilfælde. Store nationale databaser som NCDB er fordelagtige til undersøgelse af sjældne kræftformer som f.eks. metaplastisk BC. Incidensen af metaplastisk BC-diagnoser i USA er imidlertid ifølge disse databaser stadig lav og ligger på under 500 tilfælde om året. I vores undersøgelse fandt vi, at metaplastisk BC oftest blev diagnosticeret som en stor tumor med negative risikokendetegn som f.eks. dårligt differentieret tumorgrad og triple-negativ receptorstatus. Patienter med metaplastisk BC havde signifikant dårligere overlevelse uanset stadium ved præsentationen sammenlignet med triple-negativ og anden BC. Modtagelse af kemoterapi og strålebehandling var uafhængige prædiktorer for bedre overlevelse, men sekvenseringen af kemoterapi syntes at påvirke resultaterne, især for patienter med metaplastisk BC uden klinisk nodal involvering, idet det erkendes, at nogle af disse patienter havde patologisk nodal involvering. Vores resultater kan imidlertid afspejle potentiel heterogenitet i de underliggende biologiske mekanismer, der driver respons på behandlinger i denne særlige gruppe af BC-patienter, og fremhæver behovet for bedre risikostratificering og systemiske behandlingsmuligheder for at forbedre resultaterne.
Selv om de fleste metaplastiske BC’er har en triple-negativ fænotype, synes opførslen af metaplastisk BC at være unik sammenlignet med andre TNBC’er. TNBC har tendens til at have en dårligere prognose end andre typer af BC, og forestillingen om, at metaplastisk BC er mere aggressiv end TNBC, er blevet bekræftet af flere mindre, retrospektive undersøgelser af mindre omfang. Sådanne undersøgelser har vist lignende mønstre for diagnosticering i fremskredne stadier for metaplastisk BC og TNBC, hvilket skyldes højere forekomst af cT3-4-sygdom snarere end nodal involvering, og i en enkelt institutions gennemgang af 46 tilfælde af metaplastisk BC havde patienter med metaplastisk BC en signifikant højere risiko for lokalt sygdomsrecidiv (30 % vs. 15 %; P=0,004). Disse træk korrelerede i sidste ende med ringere 5-års sygdomsfri overlevelsesrater (30 % vs. 90 %; P<0,001) og OS-rater (65 % vs. 87 %; P=0,002) for patienter med metaplastisk BC i forhold til TNBC. En Surveillance Epidemiology and End Results-undersøgelse af 1112 patienter med metaplastisk BC viste også dårligere kræftspecifik overlevelsesrate efter 3 år for metaplastisk BC end for TNBC (78 % vs. 84 %). Ved undersøgelse af tn-metaplastisk BC fandt Li et al. en dårligere sygdomsfri overlevelse (HR 1,48, 95% CI 1,19-1,84, P<0,01) og OS (HR 1,42 ; P<0,01) for tn-metaplastisk BC sammenlignet med TNBC. Vores undersøgelse, som omfattede en af de største grupper af patienter med metaplastisk BC til dato (n=2.084), forstærker disse resultater og fremhæver, at receptorstatus ikke er en uafhængig prædiktor for overlevelse for metaplastisk BC (P=0.778), som det er for ikke-metaplastisk BC.
En kritisk terapeutisk komponent, der var forbundet med forbedrede resultater for alle metaplastiske BC-patienter i vores undersøgelse, var brugen af kemoterapi (HR 0,58, 95% CI 0,45-0,75, P<0,001). Vores rapport er den første, så vidt vi ved, til at rapportere om resultater i metaplastisk BC baseret på sekvensering af kemoterapi. Påfaldende nok fandt vores subanalyse, at for patienter med cN0 metaplastisk BC især neoadjuvant kemoterapi var forbundet med dårligere OS sammenlignet med adjuverende kemoterapi (HR 1,88, 95% CI 1,34-2,64, P<0,001), mens sekventering af kemoterapi ikke havde nogen effekt på klinisk nodepositiv metaplastisk BC. En mulig forklaring på dette kan være, at vores patienter med metaplastisk BC havde højere klinisk T-status, hvilket i andre rapporter har været forbundet med lavere satser for patologisk komplet respons og efterfølgende dårligere overlevelsesresultater. Desuden kan kliniske stadieinddelingsmetoder (dvs. fysisk undersøgelse alene, inddragelse af ultralyd) indføre heterogenitet i en klinisk N0-population ved at overse den sande nodale sygdomsbyrde, hvilket i sig selv kan være forbundet med dårligere resultater. Samlet set er metaplastisk BC respons på neoadjuverende kemoterapi blevet rapporteret til at være så lavt som 18 %, hvilket er meget lavere end de kendte responsrater for TNBC på anthracyklin- og taxanbaserede kemoterapiregimer.
Baseret på den dårligere overlevelse og den relativt hurtige udvikling af fjernmetastatisk spredning sammenlignet med andre brystkræftsubtyper, der er bemærket i vores undersøgelse og i andre rapporter, er behovet for bedre systemiske behandlingsmuligheder klart tydeligt for metaplastisk BC. Transkriptionsprofilering har vist, at denne kræftsubtype udviser en tumorigene signatur med stamcellelignende karakteristika, hyppige aberrationer i PI3K/AKT/mTOR-vejen og overekspression af vaskulær endothelial vækstfaktor (VEGF). Disse karakteristika svarer til dem, der findes i mesenkymale TNBC’er. Der er lovende bestræbelser i gang for at identificere alternative systemiske behandlingsregimer for disse patienter, herunder et nyligt fase I-forsøg, der viste forbedrede objektive responsrater på liposomal doxorubicin, bevacizumab (monoklonalt antistof mod VEGF-A) og everolimus (mTOR-hæmmer) hos patienter med metaplastisk TNBC med en PI3K-svejsaberration.
Med hensyn til lokale behandlinger var mastektomi mere almindeligt anvendt i vores undersøgelse til metaplastisk BC, men var ikke forbundet med forbedret overlevelse i forhold til brystbevarende kirurgi. Der blev heller ikke fundet nogen overlevelsesfordel ved behandling, der omfattede ALND versus SLND. Strålebehandling var imidlertid en betydelig prædiktor for overlevelse, idet metaplastiske BC-patienter, der blev behandlet med adjuverende strålebehandling, havde 30 % mindre sandsynlighed for at dø end dem, der ikke modtog strålebehandling. Relevante begrænsninger i vores analyse af strålebehandling omfatter ukendte detaljer vedrørende behandlingsplanlægning, valgt modalitet, kvalitetssikring, eller om der blev anvendt teknikker såsom dybt inspirerende breath-hold. Mens lokalregionalt recidiv ikke kan undersøges i NCDB, viste en institutionel serie på 113 patienter med metaplastisk BC (54 %, som modtog strålebehandling), at stråling var den eneste faktor, der korrelerede med reduceret lokalregionalt recidiv (relativ risiko uden stråling 3.1; 95% CI 1,13-9,88, P=0,027).
Vores resultater bør fortolkes med forsigtighed i betragtning af de store begrænsninger, der ligger i, at vi ikke ved, hvilke kemoterapieregimer der blev anvendt, behandlingernes varighed eller responset på neoadjuverende kemoterapi, da disse oplysninger ikke er tilgængelige i NCDB. Vi anerkender også begrænsningerne af de klinisk-katologiske risikofaktorer, der er registreret i NCDB, uden hvilke det måske ikke er muligt fuldt ud at karakterisere de kliniske forskelle, der driver nogle af de resultatforskelle, vi har fundet, såsom dårligere overlevelsesresultater med ALND, selv når der kontrolleres for lymfeknude status. Selv om vores stikprøvestørrelse af metaplastiske BC-patienter var lille i forhold til ikke-metaplastiske BC-undersøgelser, er det paradoksalt nok også den største eksisterende undersøgelse til dato, der undersøger dette spørgsmål i betragtning af det begrænsede antal patienter med metaplastisk BC, der er rapporteret i institutionelle serier. Der er behov for yderligere undersøgelser for at forstå den biologiske prædilektion for metastatisk spredning i metaplastisk BC og validere vores resultater i separate datasæt af metaplastiske BC-patienter.
Vores nuværende standardbehandling er tydeligvis ikke tilstrækkelig til denne unikke kræftpopulation, og opnåelse af randomiserede data om metaplastisk BC i fremtiden vil kræve samarbejdsbestræbelser på grund af det lille antal patienter. NCDB har en bemærkelsesværdig styrke, nemlig muligheden for at undersøge behandlingsmønstre og resultater i forbindelse med en sjælden diagnose. Med 2 084 personer med metaplastisk BC i denne kohorte er der tale om en af de største undersøgelser af metaplastisk BC, der er rapporteret i moderne tid. Overlevelsen for disse patienter er dårlig i forhold til patienter med andre BC-typer, og selv om denne kendsgerning sandsynligvis tilskynder til indarbejdelse af aggressiv behandling, tyder vores undersøgelse på, at mere omfattende lokal-regional behandling (f.eks. ALND eller regional knudebestråling) bør overvejes nøje fra sag til sag. Samlet set er brugen af systemisk terapi afgørende for håndteringen af metaplastisk BC uanset nodal byrde, og udviklingen af effektive målrettede terapier baseret på analyse af tumorgenomprofilering er lovende for fremtiden.
Supplementært materiale
![]()
Supplementær tabel.
Anerkendelser
Særlig tak til Christine Wogan for redaktionel assistance.
Finansiering
Delvis støttet af Cancer Center Support (Biostatistics Core) Grant CA016672 fra National Cancer Institute, National Institutes of Health, til The University of Texas MD Anderson Cancer Center.
Konkurrerende interesser
Forfatterne har erklæret, at der ikke eksisterer nogen konkurrerende interesser.
1. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA Cancer J Clin. 2018;68(1):7-30
2. Yerushalmi R, Hayes MM, Gelmon KA. Brystcarcinom-sære typer: gennemgang af litteraturen. Ann Oncol. 2009;20(11):1763-1770
3. Günhan-Bilgen I, Memiş A, Ustün EE, Zekioglu O, Ozdemir N. Metaplastic carcinoma of the breast: clinical, mammographic, and sonographic findings with histopathologic correlation. AJR Am J Roentgenol. 2002;178(6):1421-1425
4. Jung S-Y, Kim HY, Nam B-H. et al. Dårligere prognose for metaplastiske brystkræftpatienter end andre patienter med triple-negativ brystkræft. Breast Cancer Res Treat. 2010;120(3):627-637
5. Wargotz ES, Norris HJ. Metaplastiske karcinomer i brystet: V. Metaplastisk karcinom med osteoklastiske kæmpeceller. Hum Pathol. 1990;21(11):1142-1150
6. Wargotz ES, Norris HJ. Metaplastiske karcinomer i brystet. I. Matrix-producerende karcinomer. Hum Pathol. 1989;20(7):628-635
7. Wargotz ES, Deos PH, Norris HJ. Metaplastiske karcinomer i brystet. II. Spindelcellekarcinom. Hum Pathol. 1989;20(8):732-740
8. Lee H, Jung S-Y, Ro JY. et al. Metaplastisk brystkræft: klinisk-patologiske træk og prognose. J Clin Pathol. 2012;65(5):441-446
9. He X, Ji J, Dong R. et al. Prognose i forskellige undertyper af metaplastisk brystkræft: en befolkningsbaseret analyse. Breast Cancer Res Treat. Oktober. 2018
10. National Cancer Database.
11. Chagpar AB, Scoggins CR, Martin RCG. et al. Factors Determining Adequacy of Axillary Node Dissection in Breast Cancer Patients (Faktorer, der bestemmer tilstrækkeligheden af dissektion af aksillære knuder hos brystkræftpatienter). Breast J. 2007;13(3):233-237
12. Bembenek A, Schlag PM. Lymfeknudeudskillelse ved brystkræft. Langenbeck’s Arch Surg. 2000;385(4):236-245
13. Woolson RF. Statistiske metoder til analyse af biomedicinske data. New York, USA: John Wiley & Sons. 1987
14. Kaplan EL, Meier P. Nonparametric Estimation from Incomplete Observations NONPARAMETRIC ESTIMATION FROM INCOMPLETE OBSERVATIONS*. Kilde J Am Stat Assoc. 1958;53(282):457-481
15. Mantel N. Evaluering af overlevelsesdata og to nye rangordningsstatistikker, der opstår i forbindelse med deres behandling. Cancer Chemother Rep. 1966;50(3):163-170
16. D.R. C. Regressionsmodeller og livstabeller. Cox Livstabeller. 1972;2:187-220
17. Rayson D, Adjei AA, Suman VJ, Wold LE, Ingle JN. Metaplastisk brystkræft: prognose og respons på systemisk behandling. Ann Oncol Off J Eur Soc Med Oncol. 1999;10(4):413-419
18. Bilimoria KY, Stewart AK, Winchester DP, Ko CY. Den nationale kræftdatabase: et effektivt initiativ til at forbedre kræftbehandlingen i USA. Ann Surg Oncol. 2008;15(3):683-690
19. Ong CT, Campbell BM, Thomas SM. et al. Metaplastisk brystkræft behandling og resultater hos 2500 patienter: En retrospektiv analyse af en national onkologidatabase. Ann Surg Oncol. 2018;25(8):2249-2260
20. Dietze EC, Sistrunk C, Miranda-Carboni G, O’Regan R, Seewaldt VL. Triple-negativ brystkræft hos afroamerikanske kvinder: uligheder versus biologi. Nat Rev Cancer. 2015;15(4):248-254
21. Rakha EA, El-Sayed ME, Green AR, Lee AHS, Robertson JF, Ellis IO. Prognostiske markører i triple-negativ brystkræft. Cancer. 2007;109(1):25-32
22. ROJAS K, STUCKEY A. Brystkræft epidemiologi og risikofaktorer. Clin Obstet Gynecol. 2016;59(4):651-672
23. Liao H-Y, Zhang W-W, Sun J-Y, Li F-Y, He Z-Y, Wu S-G. De klinisk-patologiske træk og overlevelsesresultater for forskellige histologiske subtyper i triple-negativ brystkræft. J Cancer. 2018;9(2):296-303
24. El Zein D, Hughes M, Kumar S. et al. Metaplastic Carcinoma of the Breast Is More Aggressive Than Triple-negative Breast Cancer (Metaplastisk brystkræft er mere aggressiv end Triple-negativ brystkræft): En undersøgelse fra en enkelt institution og en gennemgang af litteraturen. Clin Breast Cancer. 2017;17(5):382-391
25. Liedtke C, Mazouni C, Hess KR. et al. Respons på neoadjuverende behandling og langtidsoverlevelse hos patienter med triple-negativ brystkræft. J Clin Oncol. 2008;26(8):1275-1281
26. Cortazar P, Zhang L, Untch M. et al. Pathological complete response and long-term clinical benefit in breast cancer: the CTNeoBC pooled analysis. Lancet. 2014;384(9938):164-172
27. Fisher B, Brown A, Mamounas E. et al. Effekt af præoperativ kemoterapi på lokalregional sygdom hos kvinder med operabel brystkræft: resultater fra National Surgical Adjuvant Breast and Bowel Project B-18. J Clin Oncol. 1997;15(7):2483-2493
28. Chen IC, Lin CH, Huang CS. et al. Manglende effekt af systemisk kemoterapi til behandling af metaplastisk carcinom i brystet i den moderne æra. Breast Cancer Res Treat. 2011;130(1):345-351
29. Hennessy BT, Gonzalez-Angulo A-M, Stemke-Hale K. et al. Karakterisering af en naturligt forekommende undergruppe af brystkræft, der er beriget med epithelial-til-mesenkymal overgang og stamcellekarakteristika. Cancer Res. 2009;69(10):4116-4124
30. Prat A, Parker JS, Karginova O. et al. Fænotypisk og molekylær karakterisering af den intrinsiske undertype af brystkræft med lavt indhold af claudin. Breast Cancer Res. 2010;12(5):R68
31. Yu K-D, Zhu R, Zhan M. et al. Identifikation af prognoserelevante undergrupper hos patienter med kemoresistent triple-negativ brystkræft. Clin Cancer Res. 2013;19(10):2723-2733
32. Basho RK, Yam C, Gilcrease M. et al. Comparative Effectiveness of an mTOR-Based Systemic Therapy Regimen in Advanced, Metaplastic and Nonmetaplastic Triple-Negative Breast Cancer (sammenlignende effektivitet af et mTOR-baseret systemisk behandlingsregime i avanceret, metaplastisk og ikke-metaplastisk triple-negativ brystkræft). Oncologist. 2018;23(11):1300-1309
33. Basho RK, Gilcrease M, Murthy RK. et al. Targeting the PI3K/AKT/mTOR Pathway for the Treatment of Mesenchymal Triple-Negative Breast Cancer. JAMA Oncol. 2017;3(4):509
34. Bergom C, Currey A, Desai N, Tai A, Strauss JB. Deep Inspiration Breath Hold: Teknikker og fordele for Cardiac Sparing Under Breast Cancer Irradiation. Front Oncol. 2018;8:87
35. Latty D, Stuart KE, Wang W, Ahern V. Review of deep inspiration breath-hold techniques for the treatment of breast cancer. J Med Radiat Sci. 2015;62(1):74-81
36. Leyrer CM, Berriochoa CA, Agrawal S. et al. Predictive factors on outcomes in metaplastic breast cancer. Breast Cancer Res Treat. 2017;165(3):499-504
37. Takala S, Heikkilä P, Nevanlinna H, Blomqvist C, Mattson J. Metaplastisk karcinom i brystet: Prognose og respons på systemisk behandling ved metastatisk sygdom. Breast J. 2019;25(3):418-424
38. Harper NW, Hodges KB, Stewart RL. et al. Adjuverende behandling af triple-negativ metaplastisk brystkræft med ugentlig paclitaxel- og platin-kemoterapi: Retrospektiv case review fra en enkelt institution. Clin Breast Cancer. May. 2019