Der blev gennemført et forskningsprogram for at forbedre behandlingsteknologien til udvinding af aluminiumoxid fra ikke-bauxit. Succesen med dette program havde givet den teknologi, der var nødvendig for at producere en tilstrækkelig forsyning af aluminiumoxid af høj kvalitet fra indenlandske kilder og dermed opfylde de nationale økonomiske og strategiske behov i forbindelse med aluminiumproduktion. Saltsyreprocessen til udvinding af aluminiumoxid fra lavkvalitetsmalme er en af de processer, der undersøges i forskningsprogrammet.
En fase af denne proces udnytter virkningen af klorid-ionkoncentrationen på aluminiumionens opløselighed i opløsning. Ved 25° C er opløseligheden af AlCl3 i rent vand ca. 31 vægtprocent og falder med stigende koncentration af saltsyre (HCl) og bliver 0,1 pct. når HCl-koncentrationen øges til 37 pct. Denne adfærd har været genstand for talrige undersøgelser, processer og patenter. Det er således muligt at udvande en ikke-bauxitmalm med HCl, dekantere og filtrere væsken og tilsætte gasformigt HCl for at udfælde AlCl3-6H2O. Den resterende syreopløsning kan derefter anvendes til udvaskning af yderligere malm, og det udfældede AlCl3-6H2O kan brændes for at opnå Al2O3 . En omfattende diskussion og evaluering af denne proces er præsenteret af Peters, Johnson og Kirby. Termodynamiske data, såsom ionaktiviteter og opløselighed, der er nødvendige for en fuldstændig analyse, fortolkning og forbedring af denne proces, er sparsomme, og de eksisterende opløselighedsdata er begrænset til et snævert temperaturområde. Derfor var formålet med denne undersøgelse (1) at bestemme AlCl3’s opløselighed i et temperaturområde fra 25° til 85° C med HCl-koncentrationer fra 0,0 til 37° C.2 pct; (2) at beregne aktiviteterne af AlCl3 og af H2O i opløsninger indeholdende forskellige elektrolytter , og ligevægtskonstanten for opløsning af AlCl3-6H2O; og (3) at foreslå forskningsområder til generering af brugbare data.
- Apparat
- Forsøgsmetode
- Analyse
- Resultater
- Sammenligning med andre data
- Thermodynamisk behandling
- Løselighedsprodukt og aktiviteter i AlCl3-6H2O-H2O-systemet
- Stimulering af aktiviteter i AlCl3-6H2O-H2O-systemet
- Løselighedsprodukt og aktiviteter i AlCl3-6H2O-HCl-H2O-systemet
- Stimulering af aktiviteter i AlCl3-6H2O-HCl-H2O-systemet
- AlCl3-FeCl3-KCl-NaCl-HCl-HCl-H2O System
- Områder, der anbefales til forskning
- Aluminiumchlorid i vandige saltsyreopløsninger
Apparat
Det apparat, der er anvendt til målinger af opløseligheden, er vist i figur 1. En 100-ml-kolbe, A, indeholder en opløsning af elektrolytter og lidt overskydende salt. Et glasfilter, B, der er smeltet på et Pyrex-rør med en diameter på 6 mm, er forbundet med et ydre rør, der er fastgjort til to teflonpropper, D og E. Den øverste del af kolben er fastgjort til A ved C ved hjælp af et nylonkompressionsfittings med gevind og en 0-ring af neopren. Et polyethylenrør F-L med en diameter på 6 mm OD fører en prøve af opløsningen, der er filtreret ved B, ind i den anden kolbe K, når A sættes under tryk gennem hanen D, og E åbnes. Fittingen ved J svarer til den ved C. Kolberne er fastspændt på en stang, G, som er fastgjort til en vippemekanisme med H som vippeakse til at ryste kolberne A og K skiftevis op og ned. En afdækket termostat, 0, reguleres med en nøjagtighed på ±0,2° C. En nærmere temperaturkontrol er unødvendig, da opløseligheden er en meget svag funktion af temperaturen.
Forsøgsmetode
Målinger af opløseligheden ved 25°, 45°, 65° og 85° C blev foretaget under fase ligevægtsforhold med analytiske reagensmaterialer. Passende mængder AlCl3-6H2O, 37-pct HCl-opløsning og destilleret vand blev anbragt i kolbe A for at danne ca. 90 ml opløsning med en lille mængde overskydende saltkrystaller (i det følgende betegner “salt” aluminiumchloridhexahydrat). Materialemængderne blev anslået ud fra de eksisterende opløselighedsdata for det ternære system AlCl3-6H2O-HCl-H2O. Efter at opløsningen var dannet i kolbe A, og apparatet var samlet, blev det nedsænket i vand til niveau N, og termostaten blev indstillet til den ønskede temperatur. Der blev anvendt en kontinuerlig mekanisk omrøring af kolberne under hver kørsel, der varede 2 til 3 dage. Med jævne mellemrum blev der også anvendt kraftig manuel omrøring for at sikre
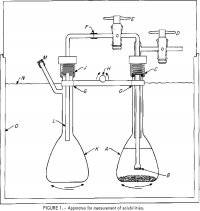
ligevægt, især hvis saltet kunne danne et komplekst fast salt med HCl. Ved afslutningen af ligevægtsperioden fik kolberne lov til at forblive ubevægelige i en oprejst stilling i 1 time for at sikre, at de faste partikler bundfældes. Derefter blev hanerne D og E åbnet for at overføre ca. halvdelen af opløsningen til prøvetagningskolben K. Niveauet i B under væsken i A var normalt afgørende for den mængde opløsning, der blev overført til K. Vægten af opløsningen i K blev bestemt ved at veje kolben før samling og efter indtagelse af opløsningen og efter demontering. En kendt mængde destilleret vand blev sprøjtet ind i kolben gennem L for at fortynde prøven og opløse eventuelle dampe i gasfasen. Partialtrykket af HCl i rent vand overstiger 1 torr ved 25° C ved molaliteter på over 8 m (m efter et tal i en sætning angiver molal); ved koncentrationer på under 8 m er det derfor tvivlsomt, om der kan ske tab af HCl under prøveudtagningen. Derfor blev nogle af kørslerne ved 25° C, der indeholdt mindre end 4 m HCl, udført med en enkelt proppekolbe, og efter equilibrering blev en del af opløsningen omhyggeligt dekanteret og filtreret med henblik på prøvetagning.
Analyse
Løsningerne blev analyseret efter passende fortyndinger for samlede klorid-ion- og aluminium-ionkoncentrationer. Den samlede klorid-ionkoncentration blev bestemt ved potentiometrisk titrering med Ag+. Al+++-koncentrationen blev bestemt ved først at kompleksere med et overskud af ethylendiamin-tetraeddikesyre (EDTA) og derefter tilbagetitrering af det overskydende EDTA med Cu++ ved en pH på 3,8.
AlCl3-indholdet blev beregnet ud fra Al+++-analysen. Ved at trække klorid-ionen i den beregnede mængde AlCl3 fra den samlede klorid-ionkoncentration kunne HCl-koncentrationen i de mættede opløsninger beregnes.
Denne beregningsmetode blev anvendt til alle analyser undtagen dem, hvor HCl-koncentrationen vides at være nul, dvs. når AlCl3 var den eneste elektrolyt i rent vand. For disse analyser blev AlCl3-koncentrationen simpelthen beregnet ud fra chlorid-ion-analysen, som var den mere nøjagtige af de to analyser, selv om både Al+++- og Cl-analyser stadig blev gennemført for disse prøver.
Den forskel i Cl-analysen beregnet ud fra den samlede Cl-analyse og Cl- fra Al+++-analysen for forsøg uden tilsat HCl var ±0,2 vægtprocent Cl-. Dette indikerer, at analysen af Al+++ i gennemsnit var behæftet med +0,05 wt-pct fejl, da Cl-analysen vidste sig at være betydeligt mere nøjagtig end Al+++-analysen. I HCl-holdige opløsninger blev en fejl på ±0,05 pct. i Al+++-indholdet afspejlet som ±0,20 pct. i HCl-indholdet; dette skyldes, at mens det samlede Cl-indhold var meget nøjagtigt, blev Cl-bidraget fra tilsat HCl og dermed molaliteten af HCl beregnet ved forskel som tidligere nævnt.
Resultater
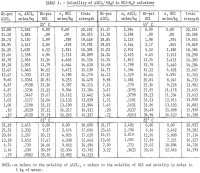
Resultaterne er sammenfattet i tabel 1 og vist i figur 2. Den maksimale HCl-koncentration for de i tabel 1 anførte data for 85° C er ca. 30 vægtprocent. Målingerne blev standset ved denne koncentration på grund af de for høje ligevægtstryk i systemet ved højere koncentrationer. Det skal også bemærkes, at der blev foretaget færre bestemmelser ved 65° og 85° C end ved 25° og 45° C. Der blev foretaget gentagelser ved de to lavere temperaturer for at give en indikation af tilfredsstillende gentagelighed af resultaterne. Figur 2 viser, at opløseligheden af aluminiumsalt falder drastisk med stigende HCl-koncentration. Det er derfor muligt at udvande ikke-bauxitmalme med HCl-opløsning og udfælde det rene salt med henblik på udvinding af aluminium ved at tilsætte HCl; en sådan proces er genstand for flere patenter. Resultaterne viser, at opløseligheden ikke ændrer sig meget med temperaturen, og for en temperaturstigning på 60° C (25° til 85° C) stiger opløseligheden af rent salt alene i vand kun med 2,2 pct. i forhold til opløseligheden ved 25° C.
Sammenligning med andre data
Den viste sig, at opløseligheden af rent salt i vand ved 25° C stemmer nøjagtigt overens med Palitzchs data og med Ehret og Frere. Resultaterne fra Malquori er ca. 10 pct. højere. Den opløselighed, der er opnået af Tanaka, er ca. 3,3 pct. højere end i denne undersøgelse ved 45° og 65° C.
Indvirkningen af HCl i vand på saltets opløselighed er blevet undersøgt af Seidel og Fisher ved 0° C og af Malquori ved 25° C. De førstnævnte forskeres resultater ved 0° C stemmer meget nøje overens med dataene i tabel 1, ekstrapoleret til 0° C, mens sidstnævnte forskers resultater ved 25° C spredes noget og er uoverensstemmende med ca. 3 pet ved lave HCl-koncentrationer; overensstemmelsen i intervallet fra 5 til 30 vægtprocent HCl er dog inden for 1 pct.
Thermodynamisk behandling
Løselighedsprodukt og aktiviteter i AlCl3-6H2O-H2O-systemet
Den ioniske aktivitetskoefficient Y12 for AlCl3 i vand er blevet målt op til 1,8 m af Mason, og genberegnede værdier er givet af Robinson og Stokes. Da aktivitetskoefficienten fra 1,8 m til mætningsværdien på 3,3835 m forventes at stige mere end femdoblet, anvendes mætningsværdien til beregning efter den metode, der er beskrevet i detaljer i en tidligere rapport (1 m = 1 mol i 1 kg opløsningsmiddel). Metoden, med dens relevante nye anvendelse, er kort opsummeret i denne rapport. Den gennemsnitlige ioniske aktivitet af AlCl3, betegnet som a12, udtrykkes ved følgende potenserie i form af molalitet m:

Den tilsvarende ligning for aktiviteten af vand aw, fås ved anvendelse af Gibbs-Duhem-relationen; resultatet er
![]()
Opmærksomheden henledes på, at eksponenterne for m med de samme koefficienter for C, D, osv, er 1 højere i ligning 2 end i ligning 1, og koefficienten for m i ligning 2 stammer fra Debye-Huckel-teorien, som diskuteret af Gokcen.
Reaktionen for opløsning af saltet er
AlCl3-6H2O (S) = Al+++ + 3Cl- + 6H2O (l),………………………….(3)
hvor (s) betyder fast stof og (l) væske.
Den tilsvarende ligevægtskonstant er
![]()
hvor nævneren, aktiviteten af fast stof, tages som en enhed, da dets sammensætning forbliver uændret, når andre elektrolytter tilsættes i opløsning. Vi erstatter a12 i 1n Kp direkte fra ligning 1 og for aw fra ligning 2 efter at have ganget ligning 2 med 0,108093 for at gøre koefficienten for 1n aw lig med 6. Da Kp er sammensætningsuafhængig, er det indlysende, at
![]()
Efter de nødvendige substitutioner fra ligning 1 og 2 og derefter substitutionen af gennemsnitsværdien m = 3.3835 fra de to første kørsler i tabel 1, fås én ligning til løsning af de seks ukendte koefficienter i ligning 1, og de resterende fem ligninger fås ved at substituere hver af de fem eksperimentelle værdier af den gennemsnitlige ioniske aktivitetskoefficient for AlCl3 , y12 i tabel 2, i
![]()
![]()
og derefter substituere hvert resultat i ligning 1. Seks simultane ligninger, der er opnået på denne måde, løses derefter ved hjælp af en computer. Resultaterne er følgende:
C = -57,5723,
D = +142,0288,
E = -202,5581,
F = +161,1919,
G = -67,7831,
og H = +11,6880.
Substitution af disse værdier i ligninger 1, 2 og 4 giver værdierne for Y12, aw og Kp. Resultaterne er anført i tabel 3 under overskriften “Bureauets resultater:” Det skal bemærkes, at vandets aktivitet nu kan beregnes ud fra ligning 2, og vandets damptryk over opløsningen, P, ud fra
aw = P/P°,……………………………….(7)
hvor P° er damptrykket for rent vand ved samme temperatur. Bemærk, at vandets damptryk over den mættede opløsning er lidt mere end halvdelen af damptrykket over rent vand, da aw = 0,509. Ovenstående resultater udgør det første sæt data om aktiviteter baseret på saltets opløselighed.
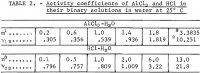
Note.- I denne tabel refererer m til molaliteten af AlCl3, n refererer til molaliteten af HCl, og molaliteten er mol i 1 kg vand.
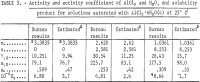
Note.-I denne tabel henviser m til molaliteten af AlCl3, n henviser til molaliteten af HCl, og molaliteten er mol i 1 kg vand.
Stimulering af aktiviteter i AlCl3-6H2O-H2O-systemet
Der anvendes to eksisterende pålidelige estimationsmetoder til at opnå aktiviteterne i AlCl3-6H2O-H2O-systemet ud over de eksisterende direkte eksperimentelle data ved m = 1,8. Den første metode, som er beskrevet af Kusik og Meissner, giver en estimeret værdi af γ12 = 9,94 ved 3,3835 m. Denne estimerede værdi er i tæt overensstemmelse med 10,251, som er den værdi, der er opnået i denne undersøgelse. Den tilsvarende skønnede værdi af vandets aktivitet, aw, er 0,47, hvilket igen er i tæt overensstemmelse med den værdi på 0,509, der er fundet i denne undersøgelse. Ligevægtskonstanten Kp beregnet ud fra disse værdier er ikke langt fra 6,8 x 10 5, idet man tager i betragtning, at fjerde potens af a12 og sjette potens af aw multipliceres for at opnå Kp.
Den anden estimationsmetode, der skyldes Bromley, giver 10,42 for γ12, en værdi, der ligger tættere på den værdi, der er opnået ved den forrige metode. Aktivitetskoefficienten for vand er blevet opnået af de nuværende forfattere ved at integrere Gibbs-Duhem-ligningen, hvori værdierne for a12 anslået ved Bromley-metoden er blevet anvendt. Resultatet er aw = 0,540. Gennemsnittet af de to metoder er 0,505, hvilket er i meget god overensstemmelse med Bureauets værdi på 0,509. Bromley-metoden indeholder imidlertid ikke en bekvem metode til bestemmelse af aw, der er indeholdt i Kusik-Meissner-metoden.
Den overensstemmelse mellem de estimerede værdier og værdierne fra opløselighedsdataene er ikke altid så god som vist her for hver elektrolyt ved hver sammensætning. For eksempel, selv for AlCl3 ved 1 m, adskiller de to estimater af γ12 sig kun 13 procent fra hinanden.
Løselighedsprodukt og aktiviteter i AlCl3-6H2O-HCl-H2O-systemet
Effekten af stigende koncentration af HCl på saltets opløselighed skyldes i høj grad den stigende koncentration af chloridionerne. Ligevægtskonstanten i dette tilfælde med aktiviteterne a1 og a2 for de enkelte ioner er
![]()
hvor γ12 = γ1γ2 ved definition af γ12 ud fra de enkelte ioniske aktiviteter γ1 (for Al+++) og γ2 (for Cl-), og n er molaliteten af HCl. Værdien af Kp er den samme som i ligning 4, men den højre side i ligning 8 er forskellig fra den i ligning 4. Det kan bemærkes, at når n stiger, må m, koncentrationen af Al+++, falde, forudsat at γ12 og aw ikke falder meget; derfor udfældes saltet, hvilket er kendt som saltningseffekten.
Beregningen af aktiviteterne i den ternære opløsning kræver en ligning svarende til ligning 1 for HCl. Da dataene for HCl er kendt nøjagtigt over et bredt koncentrationsområde, er det muligt at tage en ligning med så mange variabler som ønsket. Følgende ligning giver en nøjagtig gengivelse af dataene for aktivitetskoefficienten for HCl, γ32, hvor subscript 3 er for H+ og 2 for Cl-:
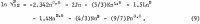
De data, der er udvalgt til dette formål fra Haase, Naas og Thutnm, er anført på tredje og fjerde række i tabel 2. Værdierne af de koefficienter, der er beregnet ud fra disse data, er følgende:
J = -1,88416,
K = +2,24342,
L = -1,98545,
M = +1,00091,
N = -0,25934,
og P = +0,02634.
Ligningerne for aktiviteterne af AlCl3 og af H2O indeholder disse koefficienter samt koefficienterne for krydsprodukterne (m h/2)(n k/2), hvor h og k er hele tal, og disse ligninger er som følger:
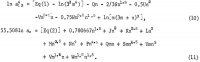
De fem yderligere koefficienter i disse ligninger bestemmes ved at addere ligning 10 og 6 1n aw fra ligning 11 for at opnå 1n Kp og ved at anvende følgende udvalgte opløselighedsdata fra tabel 1:
m: 2.620, 2,016, 1,333, 0,953 og 0,535.
n: 2,581, 4,460, 6,780, 8,397 og 10,063.
De resulterende beregninger giver følgende værdier af koefficienterne i ligninger 10 og 11:
Q = +23,27027,
S = -22.47064,
U = +4,29102,
V = -9,76081,
og W = +4,60246.
Resultaterne for γ12, a12, aw og Kp, beregnet ud fra de foregående ligninger, er anført i tabel 3. Værdierne for γ12 fra ligning 9 er i overensstemmelse med værdierne fra Harned og Gary ved meget lave koncentrationer af HCl og AlCl3.
Det partielle tryk af HCl(g), P32, over en opløsning kan beregnes ud fra følgende ligning (4):
Kp (HCl) = 4.94 x 10 -7 = P32/a²32………………………….(12)
hvor Kp(HCl) er ligevægtskonstanten ved 25° C for H+ + Cl- = HCl(g), og a32 er den gennemsnitlige ioniske aktivitet af HCl i opløsning. Til dette formål er det nødvendigt at skrive en ligning for a32, svarende til ligning 10, ved hjælp af parametrene i ligning 11, som vist i detaljer andetsteds.
Indvirkningen af temperaturen på saltets opløselighed er lille, som det fremgår af tabel 1. Effekten på de ioniske aktiviteter forventes derfor at være lille, da alle parametrene i ligning 11 kunne være opnået ud fra opløselighedsdataene, hvis den eksperimentelle fejl var mindre end ±0,01 vægtprocent for aluminiumanalysen. Generelt er hver parameter for et temperaturområde op til ca. 80° C en lineær funktion af temperaturen, og denne afhængighed kan bestemmes, hvis ligning 11 var kendt ved en anden temperatur, der er mindst 50° C højere end 25° C.
Stimulering af aktiviteter i AlCl3-6H2O-HCl-H2O-systemet
Værdierne af aktiviteter, aktivitetskoefficient og opløselighedsproduktet, der er estimeret i denne rapport i henhold til den af Kusik og Meissner udtænkte metode, er anført i tabel 3. Aktivitetskoefficienten γ12 for AlCl3 er ca. dobbelt så høj som den estimerede værdi for de udvalgte opløsninger indeholdende HCl. Aktiviteten for vand, aw, stemmer imidlertid godt overens med de anslåede værdier, undtagen for m = 2,620. Det er indlysende, at beregningerne ville have været betydeligt mere pålidelige, hvis vandets damptryk, aw, var blevet målt, fordi aw indgår i Kp som aw, således at små fejl i aw medfører store fejl i γ12 og Kp . Til dette formål anbefales det, at der foretages et begrænset antal damptryksmålinger for at teste nøjagtigheden af de nuværende beregninger og estimationsmetoderne.
Temperaturafhængigheden af de termodynamiske egenskaber, der er anført i tabel 3, kan estimeres som beskrevet af Kusik og Meissner. Skønnet vil dog sandsynligvis give en højere grad af temperaturafhængighed end den, der fremgår af den svage temperaturafhængighed af opløseligheden. Der kunne ikke gøres noget forsøg på at beregne virkningen af temperaturen ved hjælp af Bureauets metode, fordi (1) a12 ved lave koncentrationer af AlCl3 ikke er kendt ved forskellige temperaturer, (2) AlCl3’s opløselighed ikke kunne bestemmes med en nøjagtighed, der nærmer sig 0,01 pct. i Al+++, og (3) koncentrationsområdet for HCl ved 65° og 85° C er for lille til, at der kan udvælges et tilstrækkeligt antal vidt forskellige opløselighedsdata for AlCl3 til, at parametrene i ligning 10 og 11 kan bestemmes nøjagtigt.
AlCl3-FeCl3-KCl-NaCl-HCl-HCl-H2O System
Foreløbige data om opløseligheden af AlCl3, FeCl3 , KCl og NaCl i vandige opløsninger indeholdende 24 til 31 vægtprocent HCl ved 25° C blev opnået for at vurdere kontaminering af AlCl3-6H2O, der kan udvindes fra ikke-bauxitmalme. Til dette formål blev der fremstillet 2 liter af en opløsning indeholdende kendte mængder af salte, 90 ml af denne opløsning blev anbragt i en kolbe til hver kørsel, hvorefter en kendt mængde gasformigt HCl blev tilført for at opnå 24 til 31 vægtprocent opløst HCl. I dette interval af HCl i opløsning blev der udfældet farveløse anisotropiske krystaller af AlCl3-6H2O, lyse anisotropiske krystaller af FeCl3-2KCl-H2O og kubiske isotropiske gennemsigtige krystaller af KCl og NaCl, som blev identificeret ved mikroskopisk undersøgelse. Fremgangsmåden og analyserne for aluminium-ion- og klorid-ion-koncentrationer var de samme som dem, der blev anvendt for AlCl3-6H2O-HCl-H2O-systemet, der er præsenteret tidligere i denne rapport. Desuden blev jern-ionkoncentrationen bestemt ved standardtitrering med K2Cr2O7, natrium-ionkoncentrationen blev bestemt ved atomabsorptionsteknik, og kalium-ionkoncentrationen blev bestemt ved subtraktion af natrium-ionkoncentrationen fra en bestemmelse af de kombinerede kalium-ion- og natrium-ionkoncentrationer efter separation ved ionbytning. Resultaterne er anført i tabel 4 og plottet i figur 3. Lignende resultater fra Miles er også plottet i figur 3 for at vise, at overensstemmelsen er fremragende. Linke har samlet offentliggjorte data for beslægtede enklere systemer, der indeholder færre komponenter.
I de evaporative eller HCl-gassparging-krystalliseringsprocesser til fremstilling af rent aluminiumchloridhexahydrat bliver kontaminering med andre metalliske chlorider et problem, efterhånden som urenhedsniveauet opbygges i udvaskningsopløsningerne. Figur 3 viser de koncentrationsniveauer, hvor urenheder som NaCl, KCl og FeCl2-2KCl-H2O også vil udkrystallisere fra opløsningen som særskilte separate faser og dermed forårsage forurening af AlCl3-6H2O-krystallerne. Ved f.eks. mindre end 2,4 vægtprocent FeCl3 i tilstedeværelse af 1,6 vægtprocent KCl ved 25° C skal HCl-koncentrationen være mindre end 28 vægtprocent for at undgå forurening af AlCl3-6H2O med dobbeltsaltet FeCl3-2KCl-H2O. Figur 3 er også nyttig ved genopløsning af udfældningen ved fraktioneret omkrystallisering til rensning af aluminiumsaltet. Desuden kan nogle af overgangselementernes salte, såsom FeCl3, minimeres ved delvis elektrolyse for at udplade en tilstrækkelig mængde jern før forsuring med HCl.
En termodynamisk behandling af systemet med den sædvanlige fejl på ±0,05 wt-pct. i klorid-ionkoncentrationen er ikke mulig, især i mangel af damptryksdata for H2O(g) og HCl(g). Der kan dog foretages grove skøn over aktiviteterne ved hjælp af Kusik-Meissner-metoden. Det forventes, at sådanne skøn kun vil kunne give grove værdier af aktiviteterne for de hydrerede og komplekse salte og for vandet.

Områder, der anbefales til forskning
Målingerne af aktiviteter er nyttige ved fortolkning af termodynamikken og kinetikken for udvaskning, udfældning og rensning af ønskede komponenter i forskellige malme. Der er to grunde til, at aktiviteterne kan bestemmes nøjagtigt ud fra målingerne af vands damptryk: (1) Damptrykket kan måles med en høj grad af præcision ved hjælp af differenstryktransducere for at opnå aw ved ligning 7 og derefter beregne værdierne af parametrene i ligning 11, således at alle de relaterede egenskaber kan beregnes som diskuteret tidligere i detaljer (2) Opløselighedsproduktet og aktiviteterne kan begge bestemmes nøjagtigt for multivalente salte, der indeholder et stort antal vandmolekyler i deres hydrerede krystaller. Den anden grund skyldes, at eksponenten for vandets aktivitet i ligning 4 er lig med molerne af vand i den hydrerede krystal.
Aluminiumchlorid i vandige saltsyreopløsninger
En anden interessant type forsøg for det ternære system, der er diskuteret her, er måling af partialtrykket af HCl(g) over forskellige opløsninger, der indeholder tilstrækkeligt store mængder opløst HCl. Den eksperimentelle fremgangsmåde til dette formål er beskrevet andetsteds. Salte af gruppe IIA, IIIA og overgangsmetaller er fremragende kandidater til disse typer undersøgelser, da elektrolytter med højere valenser end 1:1 normalt danner hydrerede salte.
Løseligheden og aktiviteten af aluminiumchloridhexahydrat, AlCl3-6H2O, i vandige opløsninger blev bestemt som en del af Bureau of Mines, U.S. Department of the Interior, forskning til forbedring af mineralforarbejdningsteknologi til genindvinding af aluminiumoxid fra lavkvalitets indenlandske ressourcer. AlCl3’s opløselighed i rent vand blev fundet at være 31,09 og 31,77 vægtprocent ved henholdsvis 25° og 85° C, og faldt drastisk til 10 og 0,1 vægtprocent, når de respektive mængder af 20,3 og 37 vægtprocent saltsyre (HCl) blev tilsat i opløsningen. Ligevægtskonstanten for hexahydratets opløselighed, aktiviteterne og aktivitetskoefficienterne for AlCl3 og H2O blev beregnet og sammenlignet med resultaterne fra de tilgængelige beregningsmetoder. Resultaterne viste sig at være nyttige ved udvaskning af ikke-bauxitiske malme til udvinding af aluminiumoxid ved at ændre opløseligheden af komponentsalte ved tilsætning af HCl.
Simultane opløseligheder af AlCl3 , FeCl3, KCl og NaCl i HCl-H2O-opløsninger blev også bestemt, og deres virkninger på renheden af AlCl3-6H2O krystalliseret fra blandede saltopløsninger er kort diskuteret.