Doseringsform: kapsel
Medicinsk gennemgået af Drugs.com. Sidst opdateret den 1. okt. 2020.
- Overblik
- Bivirkninger
- Bivirkninger
- Dosering
- Professionel
- Tipser
- Interaktioner
- Mere
For at reducere udviklingen af lægemiddel-resistente bakterier og bevare effektiviteten af nitrofurantoin (makrokrystaller) og andre antibakterielle lægemidler, bør nitrofurantoin (makrokrystaller) kun anvendes til at behandle eller forebygge infektioner, der beviseligt eller med stærk mistanke er forårsaget af bakterier.
- BESKRIVELSE:
- CLINICAL PHARMACACOLOGY:
- MICROBIOLOGI
- Virkningsmekanisme
- Interaktioner med andre antibiotika
- Udvikling af resistens
- INDIKATIONER OG ANVENDELSE:
- KONTRAINDIKATIONER:
- VARNEMÆRKNINGER:
- Pulmonale reaktioner:
- Hepatotoksicitet:
- Neuropati:
- Hæmolytisk anæmi:
- Clostridium difficile-associeret diarré:
- FORANSTALTNINGER:
- Informationer til patienter:
- Allmenet:
- Lægemiddelinteraktioner:
- Medicin/laboratorieprøveinteraktioner:
- Karcinogenese, mutagenese, forringet fertilitet:
- Graviditet:
- Graviditetskategori B.
- Laboration og fødsel:
- Sygeplejende mødre:
- Pædiatrisk brug:
- Geriatrisk brug:
- ADVERSE REAKTIONER:
- Respiratoriske:
- Hepatisk:
- Neurologisk:
- Dermatologisk:
- Allergisk:
- Gastrointestinal:
- Hæmatologisk:
- Diverse:
- Laboratoriske bivirkninger:
- Overdosering
- DOSERING OG ADMINISTRATION:
- Voksne:
- Pædiatriske patienter:
- SÅDAN FÅR DU DEN:
- PRINCIPAL DISPLAY PANEL – 50 mg
- PRINCIPAL DISPLAY PANEL – 100 mg
- Hyppigt stillede spørgsmål
- Mere om nitrofurantoin
- Forbrugerressourcer
- Faglige ressourcer
- Relaterede behandlingsvejledninger
BESKRIVELSE:
Nitrofurantoin, USP (makrokrystaller) er et syntetisk kemikalie af kontrolleret krystalstørrelse. Det er en stabil, gul, krystallinsk forbindelse. Nitrofurantoin, USP (makrokrystaller) er et antibakterielt middel til specifikke urinvejsinfektioner. Det fås i kapsler på 25 mg, 50 mg og 100 mg til oral indgift.
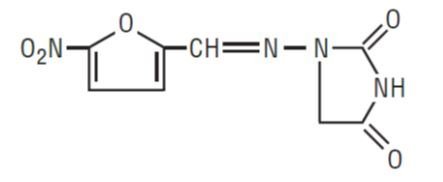
1-AMINO]-2, 4-IMIDAZOLIDINEDIONE
Inactive Ingredients: Hver kapsel indeholder D&C Yellow # 10, FD&C Blue # 1, FD&C Blue # 2, FD&C Red # 40, gelatine, jernoxid sort, laktose vandfri, magnesiumstearat, prægelatiniseret majsstivelse, natriumlaurylsulfat, talkum og titandioxid. Kapslerne på 50 mg og 100 mg indeholder også FD&C Yellow No. 6.
CLINICAL PHARMACACOLOGY:
Nitrofurantoin (makrokrystaller) er en større krystalform af nitrofurantoin. Absorptionen af nitrofurantoin (makrokrystaller) er langsommere og dens udskillelse noget mindre sammenlignet med nitrofurantoin. Blodkoncentrationerne ved terapeutisk dosering er normalt lave. Det er meget opløseligt i urin, som det kan give en brun farve.
Efter et doseringsregime på 100 mg fire gange dagligt i 7 dage var den gennemsnitlige genfinding af lægemiddelstoffer i urinen (0 til 24 timer) på dag 1 og dag 7 37.9% og 35,0%.
I modsætning til mange lægemidler kan tilstedeværelsen af mad eller midler, der forsinker gastrisk tømning, øge biotilgængeligheden af nitrofurantoin (makrokrystaller), formodentlig ved at muliggøre en bedre opløsning i mavesækken.
MICROBIOLOGI
Nitrofurantoin er et nitrofuran antimikrobielt middel med aktivitet mod visse Gram-positive og Gram-negative bakterier.
Virkningsmekanisme
Mekanismen for den antimikrobielle virkning af nitrofurantoin er usædvanlig blandt antibakterielle midler. Nitrofurantoin reduceres af bakterielle flavoproteiner til reaktive mellemprodukter, som inaktiverer eller ændrer bakterielle ribosomale proteiner og andre akromolekyler. Som følge af sådanne inaktiveringer hæmmes de vitale biokemiske processer i forbindelse med proteinsyntese, aerobt energimetabolisme, DNA-syntese, RNA-syntese og cellevægssyntese. Nitrofurantoin er bakteriedræbende i urinen ved terapeutiske doser. Den brede karakter af denne virkemåde kan forklare manglen på erhvervet bakteriel resistens over for nitrofurantoin, da de nødvendige mange og samtidige mutationer af målmakromolekylerne sandsynligvis ville være dødelige for bakterierne.
Interaktioner med andre antibiotika
Antagonisme er påvist in vitro mellem nitrofurantoin og quinolonantimikrobielle stoffer. Den kliniske betydning af dette fund er ukendt.
Udvikling af resistens
Udvikling af resistens over for nitrofurantoin har ikke været et væsentligt problem siden dets introduktion i 1953. Krydsresistens med antibiotika og sulfonamider er ikke blevet observeret, og overførbar resistens er højst et meget sjældent fænomen.
Nitrofurantoin har vist sig at være aktivt mod de fleste stammer af følgende bakterier både in vitro og i kliniske infektioner (se Indikationer og Anvendelse):
Aerobiske og fakultative grampositive mikroorganismer:
Staphylococcus aureus
Enterokokker (f.eks. Enterococcus faecalis)
Aerobe og fakultative gramnegative mikroorganismer:
Escherichia coli
BEMÆRK: Mens nitrofurantoin har fremragende aktivitet mod Enterococcus faecalis, er størstedelen af Enterococcus faecium-isolater ikke modtagelige for nitrofurantoin.
Mindst 90 % af følgende mikroorganismer udviser en in vitro minimumsinhibitorisk koncentration (MIC), der er mindre end eller lig med det modtagelige brudpunkt for nitrofurantoin. Virkningen af nitrofurantoin til behandling af kliniske infektioner forårsaget af disse mikroorganismer er imidlertid ikke blevet fastslået i tilstrækkelige og velkontrollerede forsøg.
Aerobiske og fakultative Gram-positive mikroorganismer:
Coagulase-negative stafylokokker (herunder Staphylococcus
epidermidis og Staphylococcus saprophyticus)
Streptococcus agalactiae
Gruppe D-streptokokker
Viridansgruppe-streptokokker
Aerobiske og fakultative Gram-negative mikroorganismer:
Citrobacter amalonaticus
Citrobacter diversus
Citrobacter freundii
Klebsiella oxytoca
Klebsiella ozaenae
HINVISNING: Nogle stammer af Enterobacter-arter og Klebsiella-arter er resistente over for nitrofurantoin.
Testning af modtagelighed:
For specifikke oplysninger vedrørende fortolkningskriterier for modtagelighedstest og tilhørende testmetoder og kvalitetskontrolstandarder, der er anerkendt af FDA for dette lægemiddel, se venligst: https://www.fda.gov/STIC.
INDIKATIONER OG ANVENDELSE:
Nitrofurantoinkapsler (makrokrystaller) er specifikt indiceret til behandling af urinvejsinfektioner, når de skyldes modtagelige stammer af Escherichia coli, enterokokker, Staphylococcus aureus og visse modtagelige stammer af Klebsiella- og Enterobacter-arter.
Nitrofurantoin er ikke indiceret til behandling af pyelonefritis eller perinefiske abscesser.
For at reducere udviklingen af lægemiddelresistente bakterier og opretholde effektiviteten af nitrofurantoinkapsler (makrokrystaller) og andre antibakterielle lægemidler bør nitrofurantoinkapsler (makrokrystaller) kun anvendes til behandling eller forebyggelse af infektioner, der beviseligt eller med stærk mistanke er forårsaget af modtagelige bakterier. Når der foreligger oplysninger om dyrkning og modtagelighed, skal de tages i betragtning ved valg eller ændring af antibakteriel behandling. I mangel af sådanne data kan lokal epidemiologi og modtagelighedsmønstre bidrage til det empiriske valg af terapi.
Nitrofurantoiner har ikke den bredere vævsfordeling som andre terapeutiske midler, der er godkendt til urinvejsinfektioner. Derfor er mange patienter, der behandles med nitrofurantoinkapsler (makrokrystaller), prædisponeret for persistens eller genindtræden af bakteriuri. Urinprøver til dyrkning og modtagelighedstest bør udtages før og efter afslutning af behandlingen. Hvis der forekommer persistens eller genkomst af bakteriuri efter behandling med nitrofurantoinkapsler (makrokrystaller), bør der vælges andre terapeutiske midler med bredere vævsfordeling. Ved overvejelse af brugen af nitrofurantoinkapsler (makrokrystaller) skal lavere eradikationsrater afvejes mod det øgede potentiale for systemisk toksicitet og for udvikling af antimikrobiel resistens, når midler med bredere vævsfordeling anvendes.
KONTRAINDIKATIONER:
Anuri, oliguri eller betydelig nedsat nyrefunktion (kreatininclearance under 60 mL pr. minut eller klinisk signifikant forhøjet serumkreatinin) er kontraindikationer. Behandling af denne type patienter medfører en øget risiko for toksicitet på grund af nedsat udskillelse af lægemidlet. På grund af muligheden for hæmolytisk anæmi på grund af umodne erytrocyt-enzymsystemer (glutathioninstabilitet) er lægemidlet kontraindiceret til gravide patienter ved termin (38 til 42 ugers gestation), under fødsel og fødsel, eller når fødselsstart er nært forestående. Af samme grund er lægemidlet kontraindiceret hos nyfødte under en måned.
Nitrofurantoinkapsler (makrokrystaller) er kontraindiceret hos patienter med en tidligere historie af kolestatisk gulsot/hepatisk dysfunktion i forbindelse med nitrofurantoin.
Nitrofurantoinkapsler (makrokrystaller) er også kontraindiceret hos de patienter med kendt overfølsomhed over for nitrofurantoin.
VARNEMÆRKNINGER:
Pulmonale reaktioner:
AKUTE, SUBAKUTE ELLER KRONISKE PULMONARREAKTIONER ER BLEVET OBSERVERET hos PATIENTER, SOM BEHANDLES MED NITROFURANTOIN. HVIS DISSE REAKTIONER OPSTÅR, SKAL NITROFURANTOIN (MAKROKRYSTALLER) SEPONERES, OG DER SKAL TRÆFFES PASSENDE FORANSTALTNINGER. RAPPORTER HAR NÆVNT LUNGEREAKTIONER SOM EN MEDVIRKENDE ÅRSAG TIL DØDSFALD.
KRONISKE LUNGEREAKTIONER (DIFFUS INTERSTITIEL PNEUMONITIS ELLER LUNGEFIBROSE ELLER BEGGE DELE) KAN UDVIKLE SIG SNIGENDE. DISSE REAKTIONER FOREKOMMER SJÆLDENT OG GENERELT HOS PATIENTER, DER MODTAGER BEHANDLING I SEKS MÅNEDER ELLER LÆNGERE. NØJE OVERVÅGNING AF LUNGESYGDOMMEN HOS PATIENTER, DER MODTAGER LANGTIDSBEHANDLING, ER BERETTIGET OG KRÆVER, AT FORDELENE VED BEHANDLINGEN AFVEJES MOD DE POTENTIELLE RISICI (SE RESPIRATORISKE REAKTIONER).
Hepatotoksicitet:
Hepatiske reaktioner, herunder hepatitis, kolestatisk gulsot, kronisk aktiv hepatitis og hepatisk nekrose, forekommer sjældent. Der er rapporteret om dødsfald. Begyndelsen af kronisk aktiv hepatitis kan være snigende, og patienterne bør overvåges periodisk for ændringer i biokemiske test, der kunne indikere leverskade. Hvis hepatitis opstår, skal lægemidlet straks trækkes tilbage, og der skal træffes passende foranstaltninger.
Neuropati:
Perifer neuropati, som kan blive alvorlig eller irreversibel, er forekommet. Der er rapporteret om dødsfald. Tilstande såsom nedsat nyrefunktion (kreatininclearance under 60 mL pr. minut eller klinisk signifikant forhøjet serumkreatinin), anæmi, diabetes mellitus, elektrolytforstyrrelser, vitamin B-mangel og invaliderende sygdom kan øge forekomsten af perifer neuropati. Patienter, der modtager langtidsbehandling, bør overvåges regelmæssigt for ændringer i nyrefunktionen.
Optisk neuritis er sjældent rapporteret i erfaring efter markedsføring med nitrofurantoin-formuleringer.
Hæmolytisk anæmi:
Fælde af hæmolytisk anæmi af primaquin-overfølsomhedstypen er blevet induceret af nitrofurantoin. Hæmolyse synes at være forbundet med en glucose-6-fosfatdehydrogenase-mangel i de røde blodlegemer hos de berørte patienter. Denne mangel findes hos 10 % af de sorte og en lille procentdel af de etniske grupper af middelhavs- og nærøstlig oprindelse. Hæmolyse er en indikation for seponering af nitrofurantoin (makrokrystaller); hæmolyse ophører, når lægemidlet trækkes tilbage.
Clostridium difficile-associeret diarré:
Clostridium difficile-associeret diarré (CDAD) er blevet rapporteret ved brug af næsten alle antibakterielle midler, herunder nitrofurantoin, og kan variere i sværhedsgrad fra mild diarré til dødelig colitis. Behandling med antibakterielle midler ændrer den normale flora i colon, hvilket fører til overvækst af C. difficile.
C. difficile producerer toksiner A og B, som bidrager til udviklingen af CDAD. Hypertoksinproducerende stammer af C. difficile forårsager øget morbiditet og mortalitet, da disse infektioner kan være refraktære over for antimikrobiel behandling og kan kræve kolektomi. CDAD skal overvejes hos alle patienter, der præsenterer sig med diarré efter antibiotikaanvendelse. Det er nødvendigt med en omhyggelig anamnese, da CDAD er blevet rapporteret at forekomme over to måneder efter indgift af antibakterielle midler. Hvis der er mistanke om eller bekræftelse af CDAD, kan det være nødvendigt at afbryde fortsat brug af antibiotika, der ikke er rettet mod C. difficile. Der skal iværksættes passende væske- og elektrolytbehandling, proteintilskud, antibiotikabehandling af C. difficile og kirurgisk evaluering som klinisk indiceret.
FORANSTALTNINGER:
Informationer til patienter:
Patienter bør rådes til at tage nitrofurantoin (makrokrystaller) med mad for yderligere at øge tolerancen og forbedre lægemiddelabsorptionen. Patienterne skal instrueres om at gennemføre hele behandlingsforløbet; de skal dog rådes til at kontakte deres læge, hvis der opstår usædvanlige symptomer under behandlingen.
Mange patienter, som ikke kan tåle mikrokrystallinsk nitrofurantoin, er i stand til at tage nitrofurantoin (makrokrystaller) uden kvalme.
Patienterne skal rådes til ikke at bruge antacidpræparater indeholdende magnesiumtrisilikat, mens de tager nitrofurantoin (makrokrystaller).
Patienterne skal rådgives om, at antibakterielle lægemidler, herunder nitrofurantoin (makrokrystaller), kun må anvendes til behandling af bakterielle infektioner. De behandler ikke virale infektioner (f.eks. forkølelse). Når nitrofurantoin (makrokrystaller) ordineres til behandling af en bakteriel infektion, skal patienterne informeres om, at selv om det er almindeligt at føle sig bedre tidligt i behandlingsforløbet, skal medicinen tages præcis som anvist. Hvis man springer doser over eller ikke gennemfører hele behandlingsforløbet, kan det (1) mindske effektiviteten af den umiddelbare behandling og (2) øge sandsynligheden for, at bakterierne udvikler resistens og ikke kan behandles med nitrofurantoin (makrokrystaller) eller andre antibakterielle lægemidler i fremtiden.
Diarré er et almindeligt problem forårsaget af antibiotika, som normalt ophører, når antibiotikaet afbrydes. Nogle gange kan patienter efter påbegyndt behandling med antibiotika udvikle vandig og blodig afføring (med eller uden mavekramper og feber) selv så sent som to eller flere måneder efter at have taget den sidste dosis af antibiotikaet. Hvis dette sker, skal patienterne kontakte deres læge så hurtigt som muligt.
Allmenet:
Skrivning af nitrofurantoin (makrokrystaller) i mangel af en påvist eller stærkt mistænkt bakteriel infektion eller en profylaktisk indikation er usandsynligt, at det vil give gavn for patienten og øger risikoen for udvikling af lægemiddelresistente bakterier.
Lægemiddelinteraktioner:
Antacider, der indeholder magnesiumtrisilikat, reducerer ved samtidig indgift med nitrofurantoin både absorptionshastigheden og absorptionsomfanget. Mekanismen for denne interaktion er sandsynligvis adsorption af nitrofurantoin på overfladen af magnesiumtrisilikat.
Uricosuriske lægemidler, såsom probenecid og sulfinpyrazon, kan hæmme den renale tubulære sekretion af nitrofurantoin. Den deraf følgende stigning i nitrofurantoin-serumniveauerne kan øge toksiciteten, og de nedsatte urinniveauer kan mindske dets effektivitet som et antibakterielt middel mod urinvejene.
Medicin/laboratorieprøveinteraktioner:
Som følge af tilstedeværelsen af nitrofurantoin kan der forekomme en falsk-positiv reaktion for glukose i urinen. Dette er blevet observeret med Benedict’s og Fehling’s opløsninger, men ikke med den enzymatiske glukoseprøve.
Karcinogenese, mutagenese, forringet fertilitet:
Nitrofurantoin var ikke kræftfremkaldende, når det blev givet til Holtzman-rottehunner i 44,5 uger eller til Sprague-Dawley-rottehunner i 75 uger. To kroniske bioassays hos gnavere med han- og hun Sprague-Dawley rotter og to kroniske bioassays hos schweiziske mus og BDF1 mus viste ingen tegn på carcinogenicitet.
Nitrofurantoin viste tegn på carcinogen aktivitet hos hun B6C3F1 mus som vist ved øget forekomst af tubulære adenomer, godartede blandede tumorer og granulosacelletumorer i æggestokkene. Hos F344/N-hanrotter var der en øget forekomst af ualmindelige tubulære celletumorer i nyrerne, osteosarkomer i knoglerne og neoplasmer i det subkutane væv. I en undersøgelse med subkutan indgift af 75 mg/kg nitrofurantoin til drægtige hunmus blev der i F1-generationen observeret papillære adenomer i lungerne af ukendt betydning.
Nitrofurantoin har vist sig at fremkalde punktmutationer i visse stammer af Salmonella typhimurium og forward-mutationer i L5178Y-lymfomceller fra mus. Nitrofurantoin inducerede et øget antal søsterkromatidbytninger og kromosomale aberrationer i kinesiske hamster-ovarieceller, men ikke i humane celler i kultur. Resultaterne af den kønsrelaterede recessive letale test i Drosophila var negative efter indgivelse af nitrofurantoin ved fodring eller ved injektion. Nitrofurantoin inducerede ikke arvelige mutationer i de undersøgte gnavermodeller.
Betydningen af resultaterne vedrørende carcinogenicitet og mutagenicitet i forhold til den terapeutiske anvendelse af nitrofurantoin hos mennesker er ukendt.
Administration af høje doser nitrofurantoin til rotter forårsager midlertidig spermatogen stop; dette er reversibelt ved ophør af lægemidlet. Doser på 10 mg/kg/dag eller derover hos raske mandlige mænd kan i visse uforudsigelige tilfælde medføre et let til moderat spermatogent stop med et fald i antallet af sædceller.
Graviditet:
Teratogene virkninger:
Graviditetskategori B.
Der er udført flere reproduktionsundersøgelser på kaniner og rotter ved doser op til seks gange den humane dosis, og de har ikke vist tegn på nedsat fertilitet eller skade på fosteret på grund af nitrofurantoin. I en enkelt offentliggjort undersøgelse udført på mus ved 68 gange den humane dosis (baseret på mg/kg administreret til moderdyret) blev der observeret væksthæmning og en lav forekomst af mindre og almindelige misdannelser. Ved 25 gange den humane dosis blev der imidlertid ikke observeret fostermisdannelser; relevansen af disse resultater for mennesker er usikker. Der findes imidlertid ingen fyldestgørende og velkontrollerede undersøgelser af gravide kvinder. Da undersøgelser af dyrs reproduktion ikke altid er forudsigelige for respons hos mennesker, bør dette lægemiddel kun anvendes under graviditet, hvis det er klart nødvendigt.
Ikke-teratogene virkninger:
Nitrofurantoin har i en offentliggjort undersøgelse af transplacental carcinogenicitet vist sig at inducere papillære adenomer i lungerne hos F1-generationen af mus ved doser 19 gange den humane dosis på mg/kg-basis. Forholdet mellem dette fund og potentiel human carcinogenese er på nuværende tidspunkt ukendt. På grund af usikkerheden om de menneskelige konsekvenser af disse dyredata bør dette lægemiddel kun anvendes under graviditet, hvis det er klart nødvendigt.
Laboration og fødsel:
Se KONTRAINDIKATIONER.
Sygeplejende mødre:
Nitrofurantoin er påvist i spormængder i human modermælk. På grund af potentialet for alvorlige bivirkninger af nitrofurantoin hos ammende spædbørn under en måned bør der træffes en beslutning om, hvorvidt amningen skal ophøre eller om lægemidlet skal seponeres, idet der tages hensyn til lægemidlets betydning for moderen (se KONTRAINDIKATIONER).
Pædiatrisk brug:
Nitrofurantoin (makrokrystaller) er kontraindiceret til spædbørn under en måned (se KONTRAINDIKATIONER).
Geriatrisk brug:
Kliniske undersøgelser af nitrofurantoin (makrokrystaller) omfattede ikke et tilstrækkeligt antal forsøgspersoner på 65 år og derover til at afgøre, om de reagerer anderledes end yngre forsøgspersoner. Andre rapporterede kliniske erfaringer har ikke identificeret forskelle i respons mellem ældre og yngre patienter. Spontane rapporter tyder på en højere andel af lungereaktioner, herunder dødsfald, hos ældre patienter; disse forskelle synes at være relateret til den højere andel af ældre patienter, der modtager langtidsbehandling med nitrofurantoin. Som hos yngre patienter observeres kroniske lungereaktioner generelt hos patienter, der modtager behandling i seks måneder eller længere (se ADVARSEL). Spontane rapporter tyder også på en øget andel af alvorlige leverreaktioner, herunder dødsfald, hos ældre patienter (se ADVARSEL).
Generelt bør den større hyppighed af nedsat lever-, nyre- eller hjertefunktion og af ledsagende sygdom eller anden lægemiddelbehandling tages i betragtning ved ordination af nitrofurantoin (makrokrystaller). Dette lægemiddel er kendt for at blive udskilt i væsentlig grad af nyrerne, og risikoen for toksiske reaktioner på dette lægemiddel kan være større hos patienter med nedsat nyrefunktion. Anuri, oliguri eller betydelig nedsat nyrefunktion (kreatininclearance under 60 mL pr. minut eller klinisk signifikant forhøjet serumkreatinin) er kontraindikationer (se KONTRAINDIKATIONER). Da ældre patienter er mere tilbøjelige til at have nedsat nyrefunktion, skal man være forsigtig med dosisvalg, og det kan være nyttigt at overvåge nyrefunktionen.
ADVERSE REAKTIONER:
Respiratoriske:
KRONISKE, SUBAKUTE ELLER AKUT PULMONARISKE HYPERSENSITIVITETSREAKTIONER KAN OPSTÅ.
KRONISKE PULMONARISKE REAKTIONER OPSTÅR GENERELT hos PATIENTER, SOM HAR MODTAGET KONTINUERLIG BEHANDLING I Seks Måneder ELLER LÆNGERE. UTILPASHED, DYSPNØ VED ANSTRENGELSE, HOSTE OG ÆNDRET LUNGEFUNKTION ER ALMINDELIGE MANIFESTATIONER, SOM KAN OPSTÅ SNIGENDE. RADIOLOGISKE OG HISTOLOGISKE FUND AF DIFFUS INTERSTITIEL PNEUMONITIS ELLER FIBROSE, ELLER BEGGE DELE, ER OGSÅ ALMINDELIGE MANIFESTATIONER AF DEN KRONISKE LUNGEREAKTION. FEBER ER SJÆLDENT FREMTRÆDENDE.
SVÆRHEDSGRADEN AF KRONISKE LUNGEREAKTIONER OG DERES GRAD AF OPLØSNING SYNES AT VÆRE RELATERET TIL VARIGHEDEN AF BEHANDLINGEN, EFTER AT DE FØRSTE KLINISKE TEGN ER OPSTÅET. LUNGEFUNKTIONEN KAN VÆRE PERMANENT NEDSAT, SELV EFTER OPHØR AF BEHANDLINGEN. RISIKOEN ER STØRRE, NÅR KRONISKE PULMONARREAKTIONER IKKE ERKENDES tidligt.
I subakutte pulmonale reaktioner forekommer feber og eosinofili sjældnere end i den akutte form. Efter ophør af behandlingen kan det tage flere måneder at komme sig. Hvis symptomerne ikke erkendes som værende lægemiddelrelaterede, og nitrofurantoinbehandlingen ikke stoppes, kan symptomerne blive mere alvorlige.
Akutte lungereaktioner viser sig almindeligvis ved feber, kulderystelser, hoste, brystsmerter, dyspnø, lungeinfiltrering med konsolidering eller pleuraeffusion på røntgenbilleder og eosinofili. Akutte reaktioner forekommer normalt inden for den første uge af behandlingen og er reversible ved ophør af behandlingen. Resolutionen er ofte dramatisk (se ADVARSEL).
Ændringer i EKG (f.eks, uspecifikke ST/T-bølgeændringer, bundgrenblok) er blevet rapporteret i forbindelse med lungereaktioner.
Cyanose er sjældent blevet rapporteret.
Hepatisk:
Hepatiske reaktioner, herunder hepatitis, kolestatisk gulsot, kronisk aktiv hepatitis og hepatisk nekrose, forekommer sjældent (se ADVARSEL).
Neurologisk:
Perifer neuropati, som kan blive alvorlig eller irreversibel, er forekommet. Der er rapporteret om dødsfald. Tilstande såsom nedsat nyrefunktion (kreatininclearance under 60 mL pr. minut eller klinisk signifikant forhøjet serumkreatinin), anæmi, diabetes mellitus, elektrolytforstyrrelser, vitamin B-mangel og invaliderende sygdomme kan øge risikoen for perifer neuropati (se ADVARSEL).
Astheni, vertigo, nystagmus, svimmelhed, hovedpine og døsighed er også blevet rapporteret ved brug af nitrofurantoin.
Benign intrakraniel hypertension (pseudotumor cerebri), forvirring, depression, optikusneuritis og psykotiske reaktioner er sjældent rapporteret. Udbulende fontaneller, som tegn på benign intrakraniel hypertension hos spædbørn, er sjældent rapporteret.
Dermatologisk:
Exfoliativ dermatitis og erythema multiforme (herunder Stevens-Johnsons syndrom) er sjældent rapporteret. Forbigående alopeci er også blevet rapporteret.
Allergisk:
Et lupuslignende syndrom i forbindelse med lungereaktioner på nitrofurantoin er blevet rapporteret. Der er også rapporteret angioødem; makulopapuløse, erytematøse eller eksematøse udbrud; pruritus; urticaria; anafylaksi; arthralgi; myalgi; lægemiddelfeber; kulderystelser; og vaskulitis (undertiden i forbindelse med lungereaktioner). Overfølsomhedsreaktioner udgør de hyppigst spontant rapporterede bivirkninger i den verdensomspændende erfaring efter markedsføring af nitrofurantoinformuleringer.
Gastrointestinal:
Nausea, opkastning og anoreksi forekommer hyppigst. Abdominalsmerter og diarré er mindre almindelige gastrointestinale reaktioner. Disse dosisrelaterede reaktioner kan minimeres ved reduktion af dosis. Sialadenitis og pancreatitis er blevet rapporteret. Der har været sporadiske rapporter om pseudomembranøs colitis ved brug af nitrofurantoin. Begyndelsen af symptomer på pseudomembranøs colitis kan forekomme under eller efter antimikrobiel behandling (se ADVARSEL).
Hæmatologisk:
Cyanose sekundært til methæmoglobinæmi er sjældent blevet rapporteret.
Diverse:
Som med andre antimikrobielle midler kan superinfektioner forårsaget af resistente organismer, f.eks, Pseudomonas-arter eller Candida-arter, kan forekomme.
Laboratoriske bivirkninger:
Der er rapporteret om følgende laboratorie-bivirkninger i forbindelse med brug af nitrofurantoin: øget AST (SGOT), øget ALT (SGPT), nedsat hæmoglobin, øget serumfosfor, eosinofili, glukose-6-fosfatdehydrogenasemangelanæmi (se ADVARSEL), agranulocytose, leukopeni, granulocytopeni, hæmolytisk anæmi, trombocytopeni, megaloblastisk anæmi. I de fleste tilfælde forsvandt disse hæmatologiske abnormiteter efter ophør af behandlingen. Aplastisk anæmi er sjældent blevet rapporteret.
Overdosering
Enkelt forekommende tilfælde af akut overdosering af nitrofurantoin (makrokrystaller) har ikke resulteret i andre specifikke symptomer end opkastninger. Induktion af emesis anbefales. Der findes ingen specifik antidot, men der bør opretholdes et højt væskeindtag for at fremme urinudskillelsen af lægemidlet. Det kan dialyseres.
DOSERING OG ADMINISTRATION:
Nitrofurantoinkapsler (makrokrystaller) bør gives sammen med mad for at forbedre lægemiddelabsorptionen og, hos nogle patienter, tolerancen.
Voksne:
50 mg til 100 mg fire gange dagligt — det lavere doseringsniveau anbefales til ukomplicerede urinvejsinfektioner.
Pædiatriske patienter:
5 til 7 mg/kg legemsvægt pr. 24 timer, givet i fire delte doser (kontraindiceret under en måned).
Behandlingen bør fortsættes i en uge eller i mindst 3 dage efter, at der er opnået sterilitet af urinen. Fortsat infektion indikerer behov for reevaluering.
For langvarig suppressiv behandling hos voksne kan en reduktion af dosis til 50-100 mg ved sengetid være tilstrækkelig. Til langvarig suppressiv behandling hos pædiatriske patienter kan doser så lave som 1 mg/kg pr. 24 timer, givet i en enkelt dosis eller i to opdelte doser, være tilstrækkelige. SE AFSNITET OM ADVARSLER VEDRØRENDE RISIKOER VED LANGTIDSTERAPI.
SÅDAN FÅR DU DEN:
Nitrofurantoin kapsler USP (makrokrystaller) fås som følger:
50 mg uigennemsigtig, hvid krop og uigennemsigtig, gul hætte præget med sort blæk med “WATSON” på hætten og “5780” på kroppen.
NDC 0115-2023-10 flasker á 100 flasker
100 mg uigennemsigtig, gul kapsel præget med sort blæk med “WATSON” på hætten og “5781” på kroppen.
NDC 0115-2024-10 flasker á 100 flasker
Opbevares ved 20° til 25°C (68° til 77°F) .
Fremstillet af:
Watson Pharma Private Limited
Verna, Salcette Goa 403722 INDIA
Distribueret af:
Watson Pharma Private Limited
Verna, Salcette Goa 403722 INDIA
Distribueret af:
Amneal Pharmaceuticals LLC
Bridgewater, NJ 08807
For at rapportere formodede bivirkninger skal du kontakte Amneal Pharmaceuticals på 1-877-835-5472 eller FDA på 1-800-FDA-1088 eller www.fda.gov/medwatch.
Rev. 11-2019-00
PRINCIPAL DISPLAY PANEL – 50 mg

PRINCIPAL DISPLAY PANEL – 100 mg

| NITROFURANTOIN nitrofurantoin kapsel |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||