Generisk navn: lidocainhydrochlorid
Doseringsform: oral opløsning
Rx only
Et aktuelt bedøvelsesmiddel til slimhinderne i mund og svælg.
Efter markedsføring er der rapporteret om tilfælde af kramper, hjerte-lunge-stop og død hos patienter under 3 år ved brug af Lidocaine Viscous 2%, når det ikke blev administreret under nøje overholdelse af doserings- og administrationsanbefalingerne. I forbindelse med tændersmerter bør Lidocaine Viscous 2% generelt ikke anvendes. Ved andre tilstande bør brugen af produktet til patienter under 3 år begrænses til de situationer, hvor sikrere alternativer ikke er tilgængelige eller er blevet forsøgt, men er slået fejl.
For at mindske risikoen for alvorlige bivirkninger ved brug af Lidocaine Viscous 2% skal man instruere plejepersonalet om nøje at overholde den foreskrevne dosis og indgivelseshyppighed og opbevare den receptpligtige flaske sikkert uden for børns rækkevidde.
- BESKRIVELSE
- Lidocain topisk oral opløsning – klinisk farmakologi
- Farmakokinetik og metabolisme
- Indikationer og anvendelse for Lidocain lokal oral opløsning
- Kontraindikationer
- Advarsler
- Livsfarlige og dødelige hændelser hos spædbørn og småbørn
- Methæmoglobinæmi
- Forsigtighedsregler
- Lægemiddelinteraktioner
- Graviditet
- Sygeplejende mødre
- Bivirkninger
- Centralnervesystemet
- Overdosering
- Håndtering af lokalanæstetiske nødsituationer
- DOSERING OG ADMINISTRATION
- Voksen
- Hvordan leveres
- Pakke/mærketavle
- Pakke/mærketavle
BESKRIVELSE
Lidocaine Viscous 2% (Lidocaine Hydrochloride Oral Topical Solution USP) indeholder et lokalbedøvende middel og administreres topisk. Lidocaine Viscous 2% (Lidocaine Hydrochloride Oral Topical Solution USP) indeholder lidocainhydrochlorid, der kemisk betegnes som acetamid, 2-(diethylamino)-N-(2,6-dimethylphenyl)-,monohydrochlorid, og har følgende strukturformel:
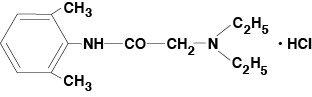
Lidocainets molekylformel er C14H22N2O. Molekylvægten er 234,34.
Løsningens sammensætning:
Hver ml indeholder 20 mg (2 %) lidocainhydrochlorid USP og følgende inaktive ingredienser: carboxymethylcellulosenatrium, aromastoffer, methylparaben, propylparaben, renset vand og saccharinnatrium.
Lidocain topisk oral opløsning – klinisk farmakologi
Virkningsmekanisme
Lidocain stabiliserer neuronmembranen ved at hæmme de ioniske strømme, der er nødvendige for initiering og ledelse af impulser, hvorved der opnås lokalbedøvende virkning.
Hemodynamik
Overdrevne blodniveauer kan forårsage ændringer i hjertemængden, den samlede perifere modstand og det gennemsnitlige arterielle tryk. Disse ændringer kan tilskrives en direkte deprimerende virkning af det lokalanæstetiske middel på forskellige komponenter i det kardiovaskulære system. Nettoeffekten er normalt en beskeden hypotension, når de anbefalede doser ikke overskrides.
Farmakokinetik og metabolisme
Lidocain absorberes efter topisk indgift på slimhinder, idet absorptionshastigheden og absorptionsomfanget afhænger af koncentrationen og den samlede indgivne dosis, det specifikke påføringssted og eksponeringstiden. Generelt sker absorptionen af lokalanæstetiske midler efter topisk anvendelse hurtigst efter intratracheal administration. Lidocain absorberes også godt fra mave-tarmkanalen, men der forekommer kun lidt intakt lægemiddel i kredsløbet på grund af biotransformation i leveren. Plasmabindingen af lidocain er afhængig af lægemiddelkoncentrationen, og den bundne fraktion aftager med stigende koncentration. Ved koncentrationer på 1 til 4 mcg fri base pr. mL er 60 til 80 % af lidokain proteinbundet. Bindingen er også afhængig af plasmakoncentrationen af alfa-1-syreglykoprotein.
Lidocain krydser blod-hjerne- og placentabarrieren, formentlig ved passiv diffusion.
Lidocain metaboliseres hurtigt af leveren, og metabolitter og uændret lægemiddel udskilles af nyrerne. Biotransformationen omfatter oxidativ N-dealkylering, ringhydroxylering, spaltning af amidbindingen og konjugering. N-dealkylering, en af de vigtigste biotransformationsveje, giver metabolitterne monoethylglycinexylidididid og glycinexylididid. Den farmakologiske/toksikologiske virkning af disse metabolitter svarer til, men er mindre potent end lidocains virkning. Ca. 90 % af den indgivne lidocain udskilles i form af forskellige metabolitter, og mindre end 10 % udskilles uændret. Den primære metabolit i urinen er et konjugat af 4-hydroxy-2, 6-dimethylanilin.
Eliminationshalveringstiden for lidocain efter en intravenøs bolusinjektion er typisk 1,5 til 2 timer. På grund af den hurtige hastighed, hvormed lidocain metaboliseres, kan enhver tilstand, der påvirker leverfunktionen, ændre lidocain-kinetikken. Halveringstiden kan være forlænget to gange eller mere hos patienter med leverdysfunktion. Nyrefunktionsforstyrrelser påvirker ikke lidocainkinetikken, men kan øge ophobningen af metabolitter.
Faktorer såsom acidose og brug af CNS-stimulerende og -depressive midler påvirker de CNS niveauer af lidocain, der er nødvendige for at producere åbenlyse systemiske virkninger. Objektive skadelige manifestationer bliver mere og mere tydelige med stigende venøse plasmaniveauer over 6 mcg fri base pr. mL. Hos rhesusaben har arterielle blodniveauer på 18 til 21 mcg/mL vist sig at være tærskel for krampagtig aktivitet.
Indikationer og anvendelse for Lidocain lokal oral opløsning
Lidocain er indiceret til fremstilling af lokal anæstesi af irriterede eller betændte slimhinder i mund og svælg. Det er også nyttigt til at reducere kvælning under optagelse af røntgenbilleder og tandaftryk.
Kontraindikationer
Lidocain er kontraindiceret hos patienter med en kendt historie af overfølsomhed over for lokalanæstetika af amidtypen eller over for andre komponenter i opløsningen.
Advarsler
EXCESSIV DOSERING, ELLER KORTE INTERVALLER MELLEM DOSER, KAN FØRE HØJT PLASMASKINSPIL OG SERIØSE ADVERSE EFFEKTER. PATIENTERNE SKAL INSTRUERES OM NØJE AT OVERHOLDE DE ANBEFALEDE DOSERINGS- OG ADMINISTRATIONSRETNINGSLINJER SOM ANFØRT I DENNE INDLÆGSSEDDEL. BEHANDLING AF SERIØSE ADVERSE REAKTIONER KAN KØRE ANVENDELSE AF RESUSCITATIVT UDSTYR, OXYGEN OG ANDRE RESUSCITATIVE DRUGS.
Lidocain bør anvendes med ekstrem forsigtighed, hvis slimhinden i applikationsområdet er traumatiseret, da der under sådanne forhold er mulighed for hurtig systemisk absorption.
Livsfarlige og dødelige hændelser hos spædbørn og småbørn
Postmarketing tilfælde af kramper, hjerte-lungestop og død hos patienter under 3 år er blevet rapporteret med brug af Lidocaine Viscous 2%, når det ikke blev administreret under nøje overholdelse af doserings- og administrationsanbefalingerne. I forbindelse med tændersmerter bør Lidocaine Viscous 2% generelt ikke anvendes. Ved andre tilstande bør brugen af produktet til patienter under 3 år begrænses til de situationer, hvor sikrere alternativer ikke er tilgængelige eller er blevet forsøgt uden held.
Methæmoglobinæmi
Fælde af methæmoglobinæmi er blevet rapporteret i forbindelse med lokalanæstetisk brug. Selv om alle patienter er i risiko for methæmoglobinæmi, er patienter med glukose-6-fosfatdehydrogenasemangel, medfødt eller idiopatisk methæmoglobinæmi, hjerte- eller lungesvækkelse, spædbørn under 6 måneder og samtidig eksponering for oxiderende stoffer eller deres metabolitter mere modtagelige for at udvikle kliniske manifestationer af tilstanden. Hvis lokalanæstetika skal anvendes til disse patienter, anbefales nøje overvågning for symptomer og tegn på methæmoglobinæmi.
Tegn på methæmoglobinæmi kan forekomme straks eller kan være forsinket nogle timer efter eksponering og er karakteriseret ved en cyanotisk hudfarvning og/eller unormal farvning af blodet. Methæmoglobinniveauerne kan fortsætte med at stige; derfor er øjeblikkelig behandling påkrævet for at afværge mere alvorlige bivirkninger på centralnervesystemet og kardiovaskulære bivirkninger, herunder kramper, koma, arytmier og død. Afbryd Lidocaine Viscous 2% og alle andre oxiderende midler. Afhængigt af alvorligheden af tegn og symptomer kan patienterne reagere på understøttende behandling, dvs. iltbehandling, hydrering. En mere alvorlig klinisk præsentation kan kræve behandling med methylenblåt, udskiftningstransfusion eller hyperbar oxygen.
Forsigtighedsregler
Informationer til patienter
Forældre og plejere skal advares om følgende:
– For patienter under 3 år skal man være særlig opmærksom på nøjagtig måling af den ordinerede dosis og på ikke at administrere produktet oftere end ordineret. – For at sikre nøjagtighed anbefaler vi, at du bruger et måleapparat til omhyggeligt at måle den korrekte mængde. – Produktet må kun anvendes til den foreskrevne indikation. – For at reducere risikoen for utilsigtet indtagelse skal produktbeholderen være tæt lukket, og produktet skal opbevares godt uden for alle børns rækkevidde umiddelbart efter hver brug. – Hvis patienten viser tegn på systemisk toksicitet (f.eks. sløvhed, overfladisk vejrtrækning, krampeaktivitet) skal der straks søges akut lægehjælp, og der bør ikke gives yderligere produkt. – Ubrugt produkt skal kasseres på en måde, der forhindrer mulig eksponering af børn og kæledyr.
Alle patienter skal være opmærksomme på, at når topiske anæstetika anvendes i mund eller svælg, kan produktionen af topisk anæstesi nedsætte synkeevnen og dermed øge faren for aspiration. Derfor bør der ikke indtages mad i 60 minutter efter brug af lokalanæstetiske præparater i mund- eller halsområdet. Dette er særlig vigtigt hos børn på grund af deres hyppige spisning.
Mukhed af tungen eller slimhinden i mundvigen kan øge faren for bidetraumer. Af denne grund bør mad og/eller tyggegummi ikke anvendes, mens mund- eller halsområdet er bedøvet.
Informér patienterne om, at brug af lokalbedøvelsesmidler kan forårsage methæmoglobinæmi, en alvorlig tilstand, der skal behandles omgående. Informer patienter eller plejere om at søge øjeblikkelig lægehjælp, hvis de eller en person i deres pleje oplever følgende tegn eller symptomer: bleg, grå eller blåfarvet hud (cyanose); hovedpine; hurtig hjertefrekvens; åndenød; svimmelhed; eller træthed.
Generelt
Sikkerheden og effektiviteten af lidocain afhænger af korrekt dosering, korrekt teknik, tilstrækkelige forholdsregler og beredskab i nødstilfælde (se ADVARSEL og BEMÆRKNINGER og ADVERSE REAKTIONER). Den laveste dosis, der resulterer i effektiv anæstesi, skal anvendes for at undgå høje plasmaniveauer og alvorlige bivirkninger. Gentagne doser af lidocain kan medføre betydelige stigninger i blodniveauet ved hver gentagen dosis på grund af langsom ophobning af lægemidlet og/eller dets metabolitter. Tolerancen varierer med patientens status. Svækkede, ældre patienter, akut syge patienter og børn bør gives reducerede doser i forhold til deres alder, vægt og fysiske tilstand. Lidocain bør også anvendes med forsigtighed hos patienter med alvorligt chok eller hjerteblokade.
Lidocain bør anvendes med forsigtighed hos personer med kendt lægemiddeloverfølsomhed. Patienter, der er allergiske over for paraaminobenzoesyrederivater (prokain, tetrakain, benzokain osv.), har ikke vist krydsoverfølsomhed over for lidocain.
Lægemiddelinteraktioner
Patienter, der indgives lokalanæstetika, har øget risiko for at udvikle methæmoglobinæmi, når de samtidig udsættes for følgende lægemidler, som kan omfatte andre lokalanæstetika:
Eksempler på lægemidler, der er forbundet med methæmoglobinæmi:
|
Klasse |
Eksempler |
|
Nitrater/Nitriter |
nitroglycerin, nitroprussid, nitrogenoxid, lattergas |
|
Lokalbedøvende midler |
benzocain, lidocain, bupivacain, mepivacain, tetrakain, prilocain, prokain, artikain, ropivacain |
|
Antineoplastiske midler |
cyclofosfamid, flutamid, rasburicase, ifosfamid, hydroxyurea |
|
Antibiotika |
dapson, sulfonamider, nitrofurantoin, para-aminosalicylsyre |
|
Antimalariamidler |
chloroquin, primaquin |
|
Antikonvulsiva |
phenytoin, natriumvalproat, phenobarbital |
|
Andre lægemidler |
acetaminophen, metoclopramid, sulfasalazin, kinin |
Carcinogenese, mutagenese, forringelse af fertiliteten
Der er ikke foretaget undersøgelser af lidocain på dyr for at vurdere det carcinogene og mutagene potentiale eller virkningen på fertiliteten.
Graviditet
Teratogene virkninger
Graviditet Kategori B: Der er udført reproduktionsundersøgelser på rotter ved doser på op til 6,6 gange den humane dosis, og de har ikke vist tegn på skade på fosteret forårsaget af lidocain. Der findes imidlertid ingen tilstrækkelige og velkontrollerede undersøgelser hos gravide kvinder. Da undersøgelser af dyrs reproduktion ikke altid er forudsigende for respons hos mennesker, bør dette lægemiddel kun anvendes under graviditet, hvis der er klart behov for det.
Sygeplejende mødre
Det vides ikke, om dette lægemiddel udskilles i modermælk. Da mange lægemidler udskilles i modermælk, skal der udvises forsigtighed, når lidocain administreres til ammende kvinder.
Pædiatrisk brug
Doseringen til børn skal reduceres i forhold til alder, kropsvægt og fysiske forhold. Se DOSERING OG ADMINISTRATION.
Bivirkninger
Bivirkninger efter indgift af lidocain er af samme art som dem, der er observeret med andre amidlokalanæstetiske midler. Disse bivirkninger er generelt dosisrelaterede og kan skyldes høje plasmaniveauer forårsaget af for høj dosis eller hurtig absorption, eller kan skyldes overfølsomhed, idiosynkrasi eller nedsat tolerance hos patienten. Alvorlige bivirkninger er generelt af systemisk karakter. Følgende typer er de hyppigst rapporterede:
Centralnervesystemet
CNS manifestationer er excitatoriske og/eller depressive og kan være karakteriseret ved svimmelhed, nervøsitet, ængstelse, eufori, forvirring, svimmelhed, døsighed, tinnitus, sløret eller dobbelt syn, opkastning, fornemmelser af varme, kulde eller følelsesløshed, trækninger, rystelser, kramper, bevidstløshed, åndedrætsdepression og hjertestop. De excitatoriske manifestationer kan være meget kortvarige eller kan slet ikke forekomme, i hvilket tilfælde den første manifestation af toksicitet kan være døsighed, der går over i bevidstløshed og åndedrætsstop.
Dårlighed efter indgift af lidocain er normalt et tidligt tegn på et højt blodniveau af lægemidlet og kan opstå som følge af hurtig absorption.
Kardiovaskulært system
Kardiovaskulære manifestationer er normalt deprimerende og er karakteriseret ved bradykardi, hypotension og kardiovaskulært kollaps, som kan føre til hjertestop.
Allergiske
Allergiske reaktioner er karakteriseret ved kutane læsioner, urticaria, ødemer eller anafylaktoide reaktioner. Allergiske reaktioner kan opstå som følge af følsomhed enten over for det lokalanæstetiske middel eller over for methylparaben og/eller propylparaben, der anvendes i denne formulering. Allergiske reaktioner som følge af følsomhed over for lidocain er ekstremt sjældne og skal, hvis de forekommer, håndteres med konventionelle midler. Påvisning af følsomhed ved hudtest er af tvivlsom værdi.
Overdosering
Akutte nødsituationer som følge af lokalanæstetika er generelt relateret til høje plasmaniveauer, der forekommer under terapeutisk brug af lokalanæstetika. (Se ADVERSE REAKTIONER, ADVARSEL og FORSIGTIGELSER)
Håndtering af lokalanæstetiske nødsituationer
Den første overvejelse er forebyggelse, hvilket bedst opnås ved omhyggelig og konstant overvågning af kardiovaskulære og respiratoriske vitale tegn og patientens bevidsthedstilstand efter hver lokalanæstetisk administration.
Det første skridt i håndteringen af kramper består i øjeblikkelig opmærksomhed på opretholdelse af en åben luftvej og assisteret eller kontrolleret ventilation med ilt. I situationer, hvor uddannet personale er let tilgængeligt, bør ventilationen opretholdes, og ilt bør leveres af et system, der er i stand til at muliggøre øjeblikkeligt positivt luftvejstryk via maske. Umiddelbart efter iværksættelse af disse respiratoriske foranstaltninger bør kredsløbets tilstrækkelighed vurderes, idet man skal huske på, at lægemidler, der anvendes til behandling af kramper, undertiden nedsætter kredsløbet, når de indgives intravenøst. Hvis kramperne fortsætter på trods af tilstrækkelig respiratorisk støtte, og hvis kredsløbets tilstand tillader det, kan der indgives små doser af et ultrakortvirkende barbiturat (f.eks. thiopental eller thiamylal) eller et benzodiazepin (f.eks. diazepam) intravenøst. Klinikeren bør være fortrolig med disse antikonvulsive lægemidler, inden lokalbedøvelse anvendes. Understøttende behandling af kredsløbsdepression kan kræve administration af intravenøs væske og, når det er relevant, en vasopressor som angivet af den kliniske situation (f.eks. efedrin).
Hvis de ikke behandles straks, kan både kramper og kardiovaskulær depression resultere i hypoxi, acidose, bradykardi, arytmier og hjertestop. Hvis hjertestop skulle opstå, skal der iværksættes standard kardiopulmonale genoplivningsforanstaltninger.
Dialyse er af ubetydelig værdi ved behandling af akut overdosering med lidocain.
Den orale LD50 af lidocain hos hunrotter, der ikke er ædt, er 459 (346 til 773) mg/kg (som salt) og 214 (159 til 324) mg/kg (som salt) hos hunrotter, der er ædt.
DOSERING OG ADMINISTRATION
Voksen
Den maksimale anbefalede enkeltdosis af lidocain til raske voksne bør være sådan, at dosis af lidocain ikke overstiger 4.5 mg/kg eller 2 mg/lb legemsvægt og under ingen omstændigheder overstiger en samlet dosis på 300 mg.
Til symptomatisk behandling af irriterede eller betændte slimhinder i mund og svælg er den sædvanlige dosis til voksne 15 mL ufortyndet. Til brug i munden skal opløsningen svirpes rundt i munden og spyttes ud. Ved brug i svælget skal den ufortyndede opløsning gurgles og kan synkes. Denne dosis bør ikke indgives med mindre end tre timers mellemrum, og der bør ikke gives mere end otte doser inden for en 24-timers periode. Dosis skal justeres i forhold til patientens alder, vægt og fysiske tilstand (se PRÆCAUTIONER).
Pædiatrisk
Der skal udvises forsigtighed for at sikre korrekt dosering hos alle pædiatriske patienter, da der har været tilfælde af overdosering på grund af uhensigtsmæssig dosering.
Det er vanskeligt at anbefale en maksimal dosis af et lægemiddel til børn, da denne varierer som funktion af alder og vægt. For børn over 3 år, der har en normal magert kropsmasse og normal kropsudvikling, er den maksimale dosis bestemt af barnets vægt eller alder. For eksempel: hos et barn på 5 år, der vejer 50 lbs., bør dosis af lidocain ikke overstige 75 til 100 mg (3,7 til 5 mL lidocain).
For spædbørn og hos børn under 3 år bør opløsningen måles nøjagtigt, og der bør ikke påføres mere end 1,2 mL på det umiddelbare område med en applikator med en vatpind. Vent mindst 3 timer, før der gives den næste dosis; der må højst gives fire doser inden for en 12-timers periode. Lidocain bør kun anvendes, hvis den underliggende tilstand kræver behandling med en produktmængde, der er mindre end eller lig med 1,2 mL.
Hvordan leveres
Lidocain Viskøs 2% (Lidocainhydrochlorid oral topisk opløsning USP)
Den orale topiske 2%-opløsning leveres som en klar, farveløs, viskøs opløsning.
NDC 0054-0548-44: Squeeze Bottle of 20 mL
NDC 0054-3500-49: Squeeze Bottle of 100 mL
Lagres ved 20° til 25°C (68° til 77°F).
Dispenseres i en børnesikret beholder som defineret i USP/NF.
SKALK VEL INDEN BRUG.
Distr. af: West-Ward
Pharmaceuticals Corp.
Eatontown, NJ 07724
Revideret oktober 2018
Pakke/mærketavle
NDC 0054-3500-49 Lidocaine Viscous (Lidocaine Hydrochloride Oral Topical Solution USP) 100mL

Pakke/mærketavle
NDC 0054-0548-44 Lidocain Viscous (Lidocainhydrochlorid oral topisk opløsning USP) 15mL

| LIDOCAINE VISCOUS lidocainhydrochloridopløsning |
|||||||||||||||
|
|||||||||||||||
|
|||||||||||||||
|
|||||||||||||||
|
|||||||||||||||
|
|||||||||||||||
| LIDOCAINE VISCOUS lidocainhydrochlorid opløsning |
|||||||||||||||
|
|||||||||||||||
|
|||||||||||||||
|
|||||||||||||||
|
|||||||||||||||
|
|||||||||||||||
Mærketager – West-Ward Pharmaceuticals Corp. (080189610)
| Etablering | |||
| Navn | Adresse | ID/FEI | Operations |
| West-Ward Columbus Inc. | 058839929 | MANUFACTURE(0054-3500, 0054-0548) | |
Medicinsk ansvarsfraskrivelse