- Tabel over geometrier
- LÆRINGSMÅL
- Nøglepunkter
- Nøglepunkter
- Nøglebegreber
- VSEPR-modellen
- Molekylære geometrier
- Hvordan man bestemmer molekylær geometri – YouTube: Denne video beskriver en metode til hurtigt at finde de vigtigste geometriske former for simple molekyler.
- Molekylære geometrier
- LÆRINGSMÅL
- Nøglepunkter
- Nøglepunkter
- Nøglebegreber
- AXE-metoden
- Hovedgeometrier (uden enkeltpar af elektroner):
- Trigonal Planar
- Tetraederisk
- Oktaedrisk
- Interaktivt: Elektrongeometri: Molekyler antager forskellige former på grund af mønstre af delte og ikke-delte elektroner. I disse eksempler er alle elektroner, der påvirker molekylernes form, delte i de kovalente bindinger, der holder atomerne sammen til at danne molekylerne.
- Enlige elektronpar
- LÆRINGSMÅL
- Nøglepunkter
- Nøglepunkter
- Nøglebegreber
- Molekylære geometrier med lone pair-elektroner
- Koordineringstal og det centrale atom
- Den repulsive effekt af det ensomme pars elektroner
- Interaktiv: Udelagte elektroner og den “bøjede” form: Brug 3D-modellen til at se, hvordan ikke-delte elektroner frastøder de delte elektroner i bindingerne mellem hydrogen og oxygen, hvilket får molekylet til at have en “bøjet” form.
- LICENSER OG ATTRIBUTIONER
- CC LICENSED CONTENT, SHARED PREVIOYLY
- CC LICENSED CONTENT, SPECIFIC ATTRIBUTION
Tabel over geometrier
VSEPR-teorien bestemmer molekylære geometrier (lineære, trigonale, trigonale bipyramidale, tetraedriske og oktaedriske).
LÆRINGSMÅL
Anvend VSEPR-modellen til at bestemme geometrien for et molekyle, der ikke indeholder nogen enkeltpar af elektroner på det centrale atom.
Nøglepunkter
Nøglepunkter
- Fundamentalt set teoretiserer VSEPR-modellen, at områder med negativ elektrisk ladning vil frastøde hinanden, hvilket får dem (og de kemiske bindinger, som de danner) til at holde sig så langt fra hinanden som muligt.
- Molekylære geometrier tager hensyn til antallet af atomer og antallet af lone pair-elektroner.
- De vigtigste geometrier uden lone pair-elektroner er: lineære, trigonale, tetraedriske, trigonale bipyramidale og oktaedriske geometrier.
Nøglebegreber
- VSEPR-teori: en kemisk model, der bruges til at forudsige formen af individuelle molekyler baseret på elektronpars elektrostatisk repulsion
VSEPR-modellen
VSEPR-modellen (VSEPR) fokuserer på de bindende og ikke-bundende elektronpar, der er til stede i den yderste (valens)skal af et atom, der forbinder sig med to eller flere andre atomer.
Fundamentalt set teoretiserer VSEPR-modellen, at disse områder med negativ elektrisk ladning vil frastøde hinanden, hvilket får dem (og de kemiske bindinger, som de danner) til at holde sig så langt fra hinanden som muligt. Derfor vil de to elektronskyer, der er indeholdt i et simpelt triatomart molekyle ![]() , strække sig ud i modsatte retninger. En vinkelafstand på 180° placerer de to bindingsorbitaler så langt væk fra hinanden som muligt; vi forventer derfor, at de to kemiske bindinger vil strække sig i modsatte retninger, hvilket giver et lineært molekyle.
, strække sig ud i modsatte retninger. En vinkelafstand på 180° placerer de to bindingsorbitaler så langt væk fra hinanden som muligt; vi forventer derfor, at de to kemiske bindinger vil strække sig i modsatte retninger, hvilket giver et lineært molekyle.

 . De to X-atomer (i hvidt) er 180° væk fra hinanden.
. De to X-atomer (i hvidt) er 180° væk fra hinanden.Hvis det centrale atom også indeholder et eller flere par af ikke-bindende elektroner, vil disse ekstra områder med negativ ladning opføre sig på samme måde som dem, der er forbundet med de bundne atomer. De orbitaler, der indeholder de forskellige bindende og ikke-bundende par i valensskallen, vil strække sig ud fra det centrale atom i retninger, der minimerer deres gensidige repulsionsvirkninger. Hvis det centrale atom har delvist besatte d-orbitaler, kan det være i stand til at rumme fem eller seks elektronpar, hvilket undertiden kaldes en “udvidet oktet.”
Molekylære geometrier
Molekylære geometrier (lineære, trigonale, tetraedriske, trigonale bipyramidale og oktaedriske) er bestemt af VSEPR-teorien. En tabel over geometrier ved hjælp af VSEPR-teorien kan gøre det lettere at tegne og forstå molekyler. Tabellen over molekylgeometrier findes i den første figur. Den anden figur tjener som et visuelt hjælpemiddel til tabellen.


Hvordan man bestemmer molekylær geometri – YouTube: Denne video beskriver en metode til hurtigt at finde de vigtigste geometriske former for simple molekyler.
Molekylære geometrier
VSEPR-teorien beskriver fem hovedformer for simple molekyler: lineær, trigonalplanar, tetraedrisk, trigonalbipyramidal og oktaedrisk.
LÆRINGSMÅL
Anvend VSEPR-modellen til at bestemme geometrien af molekyler, hvor det centrale atom indeholder et eller flere ensomme elektronpar.
Nøglepunkter
Nøglepunkter
- Linær: et simpelt triatomært molekyle af typen
 ; dets to bindingsorbitaler er 180° fra hinanden.
; dets to bindingsorbitaler er 180° fra hinanden. - Trigonalt planar: trekantet og i ét plan, med bindingsvinkler på 120°.
- Tetraedrisk: fire bindinger på ét centralt atom med bindingsvinkler på 109,5°.
- Trigonal bipyramidal: fem atomer omkring det centrale atom; tre i et plan med bindingsvinkler på 120° og to i modsatte ender af molekylet.
- Oktaedrisk: seks atomer omkring det centrale atom, alle med bindingsvinkler på 90°.
Nøglebegreber
- VSEPR-teori: VSEPR-modellen (Valence Shell Electron Pair Repulsion) bruges til at forudsige de enkelte molekylers form baseret på omfanget af elektronpars elektrostatisk repulsion
AXE-metoden
En anden måde at se på molekylære geometrier på er gennem “AXE-metoden” til tælling af elektroner. A i AXE repræsenterer det centrale atom og har altid en underforstået subscript et; X repræsenterer antallet af sigma-bindinger mellem det centrale atom og de ydre atomer (flere kovalente bindinger – dobbelt-, trippel- osv. – tæller som ét X); og E repræsenterer antallet af ensomme elektronpar, der omgiver det centrale atom. Summen af X og E, kendt som det steriske tal, er også forbundet med det samlede antal hybridiserede orbitaler, der anvendes i valensbindingsteorien. VSEPR bruger det steriske tal og fordelingen af X’er og E’er til at forudsige molekylære geometriske former.

Bemærk, at geometrierne kun er navngivet i henhold til atomernes positioner, ikke elektronarrangementet.

Hovedgeometrier (uden enkeltpar af elektroner):
I en lineær model er atomerne forbundet i en lige linje, og en bindingsvinkel er simpelthen den geometriske vinkel mellem to tilstødende bindinger. Et simpelt triatomært molekyle af typen ![]() har sine to bindingsorbitaler 180° fra hinanden. Eksempler på triatomære molekyler, for hvilke VSEPR-teorien forudsiger en lineær form, omfatter
har sine to bindingsorbitaler 180° fra hinanden. Eksempler på triatomære molekyler, for hvilke VSEPR-teorien forudsiger en lineær form, omfatter ![]() (som ikke har nok elektroner til at overholde oktetreglen) og
(som ikke har nok elektroner til at overholde oktetreglen) og ![]() . Når du skriver elektronpunktformlen for kuldioxid ud, skal du bemærke, at C-O-bindingerne er dobbeltbindinger; dette gør ingen forskel for VSEPR-teorien. Det centrale kulstofatom er stadig forbundet med to andre atomer. De elektronskyer, der forbinder de to oxygenatomer, er 180° fra hinanden.
. Når du skriver elektronpunktformlen for kuldioxid ud, skal du bemærke, at C-O-bindingerne er dobbeltbindinger; dette gør ingen forskel for VSEPR-teorien. Det centrale kulstofatom er stadig forbundet med to andre atomer. De elektronskyer, der forbinder de to oxygenatomer, er 180° fra hinanden.

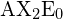 i tabellen.
i tabellen.Trigonal Planar
Molekyler med trigonal planar form er trekantede og i ét plan, eller flad overflade. Et ![]() molekyle som
molekyle som ![]() har tre områder med elektrontæthed, der strækker sig ud fra det centrale atom. Afstødningen mellem disse vil være mindst, når vinklen mellem to af dem er 120o.
har tre områder med elektrontæthed, der strækker sig ud fra det centrale atom. Afstødningen mellem disse vil være mindst, når vinklen mellem to af dem er 120o.
Tetraederisk
Tetra- betyder fire, og -hedral henviser til en flade i et fast stof; “tetraederisk” betyder bogstaveligt talt “med fire flader”. “Denne form findes, når der er fire bindinger alle på ét centralt atom, uden ensomme elektronpar. I overensstemmelse med VSEPR-teorien er bindingsvinklerne mellem elektronbindingerne 109,5o. Et eksempel på et tetraedrisk molekyle er methan ![]() . De fire ækvivalente bindinger peger i fire geometrisk ækvivalente retninger i tre dimensioner, svarende til de fire hjørner af et tetraeder med centrum på kulstofatomet.
. De fire ækvivalente bindinger peger i fire geometrisk ækvivalente retninger i tre dimensioner, svarende til de fire hjørner af et tetraeder med centrum på kulstofatomet.

En trigonal bipyramideform dannes, når et centralt atom er omgivet af fem atomer i et molekyle. I geometrien befinder tre atomer sig i samme plan med bindingsvinkler på 120°; de to andre atomer befinder sig i modsatte ender af molekylet. Nogle grundstoffer i gruppe 15 i det periodiske system danner forbindelser af typen ![]() ; eksempler herpå er
; eksempler herpå er ![]() og
og ![]() .
.

Oktaedrisk
Okta- betyder otte, og -hedral henviser til en flade i et fast stof, så “oktaedrisk” betyder bogstaveligt talt “med otte flader”. Bindingsvinklerne er alle 90°, og ligesom fire elektronpar oplever minimal frastødning, når de er rettet mod hjørnerne af et tetraeder, forsøger seks elektronpar at pege mod hjørnerne af et oktaeder. Et eksempel på et oktaedrisk molekyle (![]() ) er svovlhexafluorid (
) er svovlhexafluorid (![]() ).
).
https://lab.concord.org/embeddable.html#interactives/jsmol/electron-geometry.json
Interaktivt: Elektrongeometri: Molekyler antager forskellige former på grund af mønstre af delte og ikke-delte elektroner. I disse eksempler er alle elektroner, der påvirker molekylernes form, delte i de kovalente bindinger, der holder atomerne sammen til at danne molekylerne.
Enlige elektronpar
Ubundne elektroner er i orbitaler, der optager plads, frastøder de andre orbitaler og ændrer et molekyls form.
LÆRINGSMÅL
Kend virkningen af ensomme elektronpar på molekylers geometrier.
Nøglepunkter
Nøglepunkter
- Orbitaler, der indeholder de forskellige bindende og ikke-bundende par i valensskallen, vil strække sig ud fra det centrale atom i retninger, der minimerer deres repulsionsvirkninger.
- En ikke-bindende orbital har ingen atomkerne i den fjerneste ende, der trækker elektronskyen mod sig. Ladningen i en sådan orbital vil derfor blive koncentreret tættere på det centrale atom.
- Nonbindende orbitaler udøver mere frastødning på andre orbitaler end bindende orbitaler.
Nøglebegreber
- koordineringstal: I kemi og krystallografi, antallet af et centralt atoms naboer i et molekyle eller krystal
- lone pair: et valenssæt af to elektroner, der eksisterer uden binding eller deling med andre atomer
Molekylære geometrier med lone pair-elektroner
Så langt har vi kun diskuteret geometrier uden nogen lone pair-elektroner. Som du sikkert har bemærket i tabellen over geometrier og AXE-metoden, ændrer tilføjelsen af enlige par et molekyls form ved at tilføje enlige par. Vi har tidligere nævnt, at hvis det centrale atom også indeholder et eller flere par af ikke-bundne elektroner, vil disse ekstra områder med negativ ladning opføre sig på samme måde som dem, der er forbundet med de bundne atomer. De orbitaler, der indeholder de forskellige bindende og ikke-bundende par i valensskallen, vil strække sig ud fra det centrale atom i retninger, der minimerer deres gensidige repulsionsvirkninger.

Koordineringstal og det centrale atom
Koordineringstal refererer til antallet af elektronpar, der omgiver et givet atom, ofte omtalt som det centrale atom. Geometrierne af molekyler med lone par vil adskille sig fra dem uden lone par, fordi lone paret ligner tomrum i et molekyle. Begge geometriklasser er opkaldt efter formen af de imaginære geometriske figurer (for det meste regelmæssige faste polygoner), der ville være centreret om det centrale atom og have et elektronpar ved hvert toppunkt.
I vandmolekylet (![]() ) er det centrale atom
) er det centrale atom ![]() , og Lewis-elektronpunktformlen forudsiger, at der vil være to par af ikke-bindende elektroner. Oxygenatomet vil derfor være tetraedrisk koordineret, hvilket betyder, at det sidder i midten af tetraedronen. To af koordineringspositionerne er besat af de delte elektronpar, der udgør O-H-bindingerne, og de to andre af de ikke-bundende par. Derfor beskrives
, og Lewis-elektronpunktformlen forudsiger, at der vil være to par af ikke-bindende elektroner. Oxygenatomet vil derfor være tetraedrisk koordineret, hvilket betyder, at det sidder i midten af tetraedronen. To af koordineringspositionerne er besat af de delte elektronpar, der udgør O-H-bindingerne, og de to andre af de ikke-bundende par. Derfor beskrives ![]() -molekylets bindingsgeometri (form) som bøjet, selv om iltatometret er tetraedrisk koordineret.
-molekylets bindingsgeometri (form) som bøjet, selv om iltatometret er tetraedrisk koordineret.

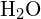 -molekylet som bøjet.
-molekylet som bøjet.Den repulsive effekt af det ensomme pars elektroner
Der er en vigtig forskel mellem bindende og ikke-bundene elektronorbitaler. Fordi en ikke-bindende orbital ikke har nogen atomkerne i den fjerneste ende, der trækker elektronskyen til sig, vil ladningen i en sådan orbital blive koncentreret tættere på det centrale atom; som følge heraf udøver ikke-bindende orbitaler mere frastødning på andre orbitaler end bindende orbitaler. I ![]() skubber de to ikke-bundende orbitaler de bindende orbitaler tættere sammen, hvilket gør H-O-H vinklen 104,5° i stedet for den tetraedriske vinkel på 109,5°.
skubber de to ikke-bundende orbitaler de bindende orbitaler tættere sammen, hvilket gør H-O-H vinklen 104,5° i stedet for den tetraedriske vinkel på 109,5°.
Elektron-punktstrukturen i ![]() placerer et par ikke-bundende elektroner i nitrogenatomets valensskal. Det betyder, at der er tre bundne atomer og et enkelt lone pair for et koordineringstal på fire omkring nitrogenet, det samme som forekommer i
placerer et par ikke-bundende elektroner i nitrogenatomets valensskal. Det betyder, at der er tre bundne atomer og et enkelt lone pair for et koordineringstal på fire omkring nitrogenet, det samme som forekommer i ![]() .
.

 ..: Det ensomme par, der er knyttet til det centrale nitrogen, skaber bindingsvinkler, der afviger fra de tetraedriske 109,5 °.
..: Det ensomme par, der er knyttet til det centrale nitrogen, skaber bindingsvinkler, der afviger fra de tetraedriske 109,5 °.Vi kan derfor forudsige, at de tre hydrogenatomer vil ligge i hjørnerne af et tetraeder centreret om nitrogenatomet. Det enlige pars orbital vil pege mod det fjerde hjørne af tetraederet, men da denne position vil være ledig, kan ![]() -molekylet ikke selv være tetraedrisk; i stedet antager det en pyramideform, nærmere bestemt en trigonal pyramide (en pyramide med trekantet base). Brintatomerne befinder sig alle i samme plan, med nitrogenet uden for dette plan. De ikke-bindende elektroner skubber de bindende orbitaler en smule sammen, hvilket gør H-N-H-bindingsvinklen ca. 107°.
-molekylet ikke selv være tetraedrisk; i stedet antager det en pyramideform, nærmere bestemt en trigonal pyramide (en pyramide med trekantet base). Brintatomerne befinder sig alle i samme plan, med nitrogenet uden for dette plan. De ikke-bindende elektroner skubber de bindende orbitaler en smule sammen, hvilket gør H-N-H-bindingsvinklen ca. 107°.
I 5-koordinerede molekyler, der indeholder ensomme par, vil disse ikke-bindende orbitaler (som er tættere på det centrale atom og dermed mere tilbøjelige til at blive frastødt af andre orbitaler) fortrinsvis befinde sig i ækvatorplanet. Dette vil placere dem i 90°-vinkler i forhold til højst to aksialt orienterede bindingsorbitaler. Vi kan derfor forudsige, at et ![]() molekyle (et molekyle, hvor det centrale atom A er koordineret til fire andre atomer X og til et ikke-bundende elektronpar) som
molekyle (et molekyle, hvor det centrale atom A er koordineret til fire andre atomer X og til et ikke-bundende elektronpar) som ![]() vil have en “see-saw”-form.
vil have en “see-saw”-form.

Substitution af ikke-bindende par for bundne atomer reducerer den trekantede bipyramidekoordinering til endnu enklere molekylære former.
https://lab.concord.org/embeddable.html#interactives/jsmol/unshared-electrons.json
Interaktiv: Udelagte elektroner og den “bøjede” form: Brug 3D-modellen til at se, hvordan ikke-delte elektroner frastøder de delte elektroner i bindingerne mellem hydrogen og oxygen, hvilket får molekylet til at have en “bøjet” form.
LICENSER OG ATTRIBUTIONER
CC LICENSED CONTENT, SHARED PREVIOYLY
- Curation and Revision: Interaktiv: Brug 3D-modellen til at se, hvordan ikke-delte elektroner frastøder de delte elektroner i bindingerne mellem hydrogen og oxygen, hvilket får molekylet til at have en “bøjet” form. Leveret af: Boundless.com. Licens: CC BY-SA: Attribution-ShareAlike
CC LICENSED CONTENT, SPECIFIC ATTRIBUTION
- VSEPR Theory. Leveret af: Wikipedia: Wikipedia: Wikipedia. Lokaliseret på: http://en.wikipedia.org/wiki/VSEPR_Theory. Licens: http://en.wikipedia.org/wiki/VSEPR_Theory: CC BY-SA: Attribution-ShareAlike
- Molekylær geometri. Leveret af: Wikipedia. Lokaliseret på: http://en.wikipedia.org/wiki/Molecular_geometry. Licens: CC BY-SA: Attribution-ShareAlike
- VSEPR-teori. Leveret af: Wikipedia. Lokaliseret på: http://en.wikipedia.org/wiki/VSEPR%20Theory. Licens: http://en.wikipedia.org/wiki/VSEPR%20Theory: CC BY-SA: Attribution-ShareAlike
- Molekylær geometri. Leveret af: Wikipedia. Lokaliseret på: http://en.wikipedia.org/wiki/Molecular_geometry. Licens: Public Domain: Public Domain: Public Domain: Public Domain: Public Domain: Public Domain: Public Domain: Public Domain: Public Domain: Public Domain: Ingen kendt ophavsret:
- VSEPR-geometrier. Leveret af: Wikimedia. Lokaliseret på: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Licens: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG: CC BY-SA: Attribution-ShareAlike
- How to Determin Molecular Geometry – YouTube. Lokaliseret på:: http://www.youtube.com/watch?v=pA9ML0HVOYE. Licens: Public Domain: Ingen kendt ophavsret. Licensbetingelser: Standard YouTube-licens
- Linear-3D-balls. Leveret af: Wikipedia. Lokaliseret på: http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Licens: CC BY: CC BY: Attribution
- Molekylær geometri. Leveret af: Wikipedia. Lokaliseret på: http://en.wikipedia.org/wiki/Molecular_geometry. Licens: CC BY-SA: Attribution-ShareAlike
- VSEPR-teori. Leveret af: Wikipedia. Lokaliseret på: http://en.wikipedia.org/wiki/VSEPR_Theory. Licens: : CC BY-SA: Attribution-ShareAlike
- VSEPR-teori. Leveret af: Wikipedia. Lokaliseret på: http://en.wikipedia.org/wiki/VSEPR%20Theory. Licens: http://en.wikipedia.org/wiki/VSEPR%20Theory: CC BY-SA: Attribution-ShareAlike
- Molekylær geometri. Leveret af: Wikipedia. Lokaliseret på: http://en.wikipedia.org/wiki/Molecular_geometry. Licens: Public Domain: Ingen kendt ophavsret:
- VSEPR-geometrier. Leveret af: Wikimedia. Lokaliseret på: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Licens: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG: CC BY-SA: Attribution-ShareAlike
- How to Determin Molecular Geometry – YouTube. Lokaliseret på:: http://www.youtube.com/watch?v=pA9ML0HVOYE. Licens: Public Domain: Ingen kendt ophavsret. Licensbetingelser: Standard YouTube-licens
- Linear-3D-balls. Tilvejebragt af: Wikipedia. Lokaliseret på: http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Licens: CC BY: Attribution
- VSEPR-teori. Leveret af: Wikipedia. Lokaliseret på: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_metode. Licens: Public Domain: Ingen kendt ophavsret:
- VSEPR Teori. Tilvejebragt af: Wikipedia. Lokaliseret på: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_metode. Licens: Public Domain: Ingen kendt ophavsret
- koordineringsnummer. Leveret af: Wiktionary. Lokaliseret på: http://en.wiktionary.org/wiki/coordination_number. Licens: CC BY-SA: Attribution-ShareAlike
- John Hutchinson, Concept Development Studies in Chemistry. September 18, 2013. Leveret af: OpenStax CNX. Lokaliseret på: http://cnx.org/content/m12594/latest/?collection=col10264/latest. Licens: CC BY: Attribution
- Boundless. Leveret af: Boundless Learning. Beliggende på: http://www.boundless.com//chemistry/definition/lone-pair. Licens: CC BY-SA: Attribution-ShareAlike
- Molekylær geometri. Tilvejebragt af: Wikipedia. Lokaliseret på: http://en.wikipedia.org/wiki/Molecular_geometry. Licens: Public Domain: Ingen kendt ophavsret:
- VSEPR-geometrier. Tilvejebragt af: Wikimedia. Lokaliseret på: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Licens: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG: CC BY-SA: Attribution-ShareAlike
- How to Determin Molecular Geometry – YouTube. Lokaliseret på:: http://www.youtube.com/watch?v=pA9ML0HVOYE. Licens: Public Domain: Ingen kendt ophavsret. Licensbetingelser: Standard YouTube-licens
- Linear-3D-balls. Provided by: Wikipedia. Lokaliseret på: http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Licens: CC BY: Attribution
- VSEPR-teori. Provided by: Wikipedia. Lokaliseret på: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_metode. Licens: Public Domain: Ingen kendt ophavsret:
- VSEPR Teori. Provided by: Wikipedia. Lokaliseret på: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_metode. Licens: Public Domain: Ingen kendt ophavsret:
- VSEPR Teori. Provided by: Wikipedia. Lokaliseret på: http://en.wikipedia.org/wiki/VSEPR_Theory. Licens: Public Domain: Ingen kendt copyright
- Tetrahedral_Structure_of_Water.png. Provided by: Wikimedia. Lokaliseret på: https://commons.wikimedia.org/wiki/File:Tetrahedral_Structure_of_Water.png. Licens: https://commons.wikimedia.org/wiki/File:Tetrahedral_Structure_of_Water.png: Public Domain: Ingen kendt ophavsret:
en kemi-model, der bruges til at forudsige formen af individuelle molekyler baseret på elektron-par elektrostatisk afstødning
det samlede antal atomer, der er direkte naboer til et centralt atom i et molekyle eller en ion
to (et par) valenselektroner, der ikke bruges til at danne en kovalent binding