Hvordan begyndte livet på Jorden? Hvordan kan kemikalier på en ung, stenet planet have fundet sammen på den helt rigtige måde for at danne de allerførste celler? Hvordan begyndte disse primitive celler at opføre sig som liv: de voksede, delte sig og gav fordelagtige egenskaber videre til den næste generation?
Livets oprindelse er særlig uklar, fordi de geologiske optegnelser – lagene af sten og indlejrede fossiler, der indeholder spor om Jordens og livets historie – forsvinder for ca. 3,9 milliarder år siden og udviskes af bevægelser i planetens skorpe. Derfor mangler forskerne direkte beviser for forholdene på den tidlige Jord, herunder beviser for de molekyler, der kan have hvirvlet rundt i de første damme og dannet livets byggesten.
Dette giver anledning til et væld af spørgsmål, netop den slags store spørgsmål, som Jack Szostak er tiltrukket af. Han og andre mener, at de i laboratoriet kan rekonstruere den lange vej, der førte fra kemikalier i rummet til Jordens dannelse, til kemien før livets opståen på planeten, til tidlige protoceller og endelig til avancerede celler med stofskifte og proteinsyntese. Udstrakte undersøgelser som disse kræver ekspertise inden for mange områder, herunder kemi og biokemi, geologi og geofysik samt astronomi.
Szostak (udtales shah-stak) er måske den ideelle person til at finde svarene. Han er nobelpristager, professor i genetik ved Harvard Medical School, professor i kemi og kemisk biologi ved fakultetet for kunst og videnskab, Rich Distinguished Investigator ved Massachusetts General Hospital (MGH) og Howard Hughes Medical Institute investigator, og han beskrives af andre som en strålende og dreven videnskabsmand. Men han er også kendt for sin milde ydmyghed, herunder en villighed til at dykke dybt ned i emner, der er nye for ham, og for sin kollegialitet og for at bidrage til at fremme idéudveksling, som bringer videnskaben fremad.
Hans egen forskning fokuserer på et segment af vejen til liv: protocellen, “en virkelig, virkelig simpel urcelle, der kunne samles af kemikalier, som fandtes tidligt på Jordens overflade”, forklarer Szostak. Han håber at kunne forstå, hvordan den ville vokse og dele sig og begynde at replikere sig og i sidste ende udvikle sig. “Vi ved måske ikke, hvad der faktisk skete, men måske kan vi finde forskellige mulige veje”, siger han. “Det eneste, vi kan gøre, er at forsøge at samle ting i laboratoriet, som virker plausible.”
“Directed Evolution”
I august i år fyldte Szostak 40 år på Harvard og 35 år på MGH (hvor hans laboratorium er placeret), en periode præget af vigtige opdagelser inden for en overraskende række områder. I 1980’erne gennemførte hans laboratorium eksperimenter med gær for at forstå genetik og biokemi i forbindelse med DNA-rekombination – et arbejde, der førte til modellen for reparation af dobbeltstrengsbrud, som beskriver, hvordan lange DNA-strenge knækker, bytter segmenter og derefter samles igen. Dette gav anledning til efterfølgende forskning i rekombinationsmekanismen under meiose, den celledeling, der fører til sædceller og æg.
I samme periode gjorde hans hold også vigtige opdagelser om telomerer – de beskyttende hætter, der findes i kromosomernes ender, og som sikrer, at DNA replikeres korrekt, når cellerne deler sig. For denne forskning modtog Szostak senere Nobelprisen i fysiologi eller medicin i 2009, som han delte med forskerne Elizabeth Blackburn, Sc.D. ’06, nu emerita på UC, San Francisco, og Carol Greider fra Johns Hopkins.
Da Szostak modtog telefonopkaldet fra Sverige tidligt om morgenen i oktober 2009, havde han allerede brugt mere end 20 år på at yde grundlæggende bidrag på andre videnskabelige områder. Efter telomeropdagelserne i midten af 1980’erne (forskningen satte forkortede telomerer i forbindelse med mange aldringssygdomme) kom mange forskere ind på området, og Szostak valgte at skifte retning. “Det var ret klart, hvad de næste eksperimenter skulle være, og det føltes som om, at alt, hvad vi gjorde, ville blive gjort alligevel”, husker han. “Jeg har aldrig følt, at der er meget mening i at gøre ting, som alligevel bliver gjort. Så det fik mig virkelig til at se mig omkring og tænke over, hvilke andre videnskabelige spørgsmål jeg kunne begynde at tage fat på.” I 1984 accepterede han et tilbud om at flytte sit laboratorium fra det daværende Sidney Farber Cancer Institute til MGH for at slutte sig til de forskere der, der arbejdede med grundlæggende videnskab. “Det var et fantastisk tilbud: al min forskning ville blive fuldt finansieret i 10 år”, husker Szostak. “Det var perfekt for mig, da det gav mig mulighed for at ændre retning uden at skulle bekymre mig om at skrive bevillinger på et nyt område.”
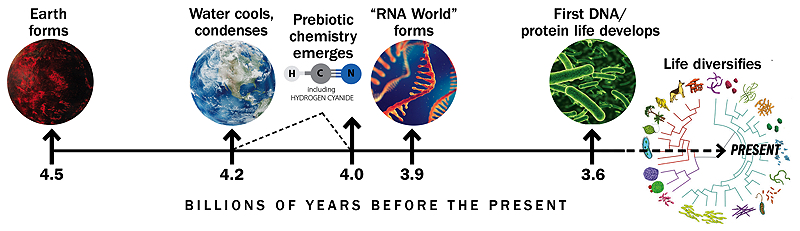
Tidslinje baseret på lignende grafik af Gerald Joyce
Efter at have overvejet sine muligheder besluttede han sig for RNA-enzymer, kendt som ribozymer, et område, som han så som “interessant, håndterbart og ikke stærkt konkurrencepræget”. Han og hans ph.d.-studerende begyndte at udvikle værktøjer til at udvikle RNA, de enkeltstrengede molekyler i cellerne, der kopierer den genetiske information, som er indeholdt i DNA. I reagensglas fik hans hold RNA til at påtage sig nye roller, f.eks. at genkende målmolekyler og katalysere reaktioner. Denne proces, der er kendt som “styret evolution”, involverede indførelse af mutationer i RNA-strengene, hvor man ledte efter varianter, der kunne udføre nyttige funktioner, og lod disse nye molekyler reproducere sig selv. De udførte også lignende arbejde med DNA, peptider og proteiner.
I 1994 modtog Szostak sammen med forskeren Gerald Joyce, nu fra Salk Institute for Biological Studies, National Academy of Sciences Award in Molecular Biology for samtidig, men uafhængigt af hinanden, at have udviklet in vitro evolution af RNA. “Det er en teknologi til at fremstille molekyler, der gør, hvad man ønsker”, forklarede Joyce i et interview og beskrev det som noget, der ligner den måde, som landbrugsforskere avler køer til at producere mere mælk eller udvikler afgrøder, der kan modstå tørke. “Dette er den molekylære version af det. Og det er noget, der nu er meget udbredt,” tilføjer han (se “Harnessing Evolution”, januar-februar 2017, side 15), en måde at udvikle nye molekyler til en række anvendelsesformål, herunder medicin.
For Szostak rejste arbejdet med styret evolution nye spørgsmål. “Jeg blev mere og mere interesseret i, hvordan evolutionen kom i gang helt af sig selv på den tidlige Jord,” husker han. “Det er én ting at pålægge selektivt pres og lave darwinistisk evolution i laboratoriet, hvor man har enzymer og studerende og instrumenter. Men på en eller anden måde kom den darwinistiske evolution i gang helt af sig selv.” Da evnen til at udvikle sig er et centralt kendetegn ved liv, stillede Szostak et af videnskabens grundlæggende spørgsmål: Hvordan kom livet i gang?
Originals: “Three Big, Fundamental Questions”
Den canadisk-amerikanske Szostak blev født i London, hvor hans far studerede til luftfartsingeniør. Familien vendte til sidst tilbage til Canada, hvor de boede i Ottawa og derefter i Montreal, og hans far arbejdede for det canadiske luftvåben. (Hans mor arbejdede i mange år i administrative funktioner for en kemisk industrivirksomhed, og Szostak havde sit første sommerjob der som teenager, hvor han testede farveægthed i virksomhedens farvelaboratorium. “Jobbet var repetitivt og kedeligt, men det gav mig mit første indblik i, hvor vigtigt det er at teste og gen-teste produkter til brug i den virkelige verden”, husker han. På det tidspunkt var han “seriøst interesseret” i naturvidenskab, matematik og teknik. Han fik sin doktorgrad i biokemi som 25-årig fra Cornell og kalder sin rådgiver, Ray Wu, for en vigtig mentor: “Han skabte et fantastisk laboratoriemiljø, men viste mig også, hvordan jeg kunne få hjælp til et projekt, når jeg stod over for problemer.”
Og selv om Szostak har udført en del praktisk, anvendt forskning i sin karriere – en af de virksomheder, han har startet, Ra Pharma, har fundet et lægemiddel mod sygdommen myasthenia gravis, som er klar til at indlede kliniske forsøg i fase III – er han mest passioneret omkring grundvidenskab.
“Det er en spændende tid at gå ind i neurovidenskab, fordi man nu kan løse problemer, som man ikke engang kunne tænke på for 30 år siden.”
“For mig at se er der tre store grundlæggende videnskabelige spørgsmål, som er superinteressante: livets oprindelse, universets oprindelse og sindets eller bevidsthedens oprindelse”, siger han, mens han sidder på sit stille, næsten tomme kontor i Mallinckrodt Laboratory på Oxford Street i Cambridge. (Kontoret er til lejlighedsvise møder; Szostak arbejder hovedsageligt i sit laboratorium på MGH). Efter livets oprindelse er det sindets oprindelse, der interesserer ham mest. I 1980’erne, da han planlagde, hvad han skulle gøre efter sin telomerforskning, overvejede han at skifte til studiet af neurovidenskab og sad endda med på Harvard-seminarer om emnet. “Det var fascinerende, men også deprimerende, fordi teknologien var så primitiv,” husker han. Han har med interesse fulgt med i de fremskridt, som feltets værktøjer har gjort siden da. “Det er en spændende tid for unge mennesker at gå ind i neurovidenskab, for med al den nye teknologi er der problemer, som man kan løse nu, som man ikke engang kunne tænke på for 30 år siden”, siger han. “Alligevel er det overordnede problem stadig så stort og lidt skræmmende. Som jeg ser på det, arbejder jeg på det nemmeste af disse store problemer.” Fordi spørgsmålene om livets oprindelse er velegnede til de nuværende forskningsteknologier, tilføjer han, mener han, at det er “et problem, der kan løses.”
Modelprotoceller og “rodet” RNA
Szostaks hold har lavet modelprotoceller siden begyndelsen af 2000’erne og forsøgt at finde ud af, hvordan de oprindeligt kan være blevet samlet og udviklet. Disse primitive strukturer var “ekstremt enkle” i sammenligning med den enkleste encellede bakterie på Jorden i dag, forklarer han. Protocellerne indeholdt sandsynligvis en minimal fedtmembran og oprindeligt kun ét gen, som gav cellen en fordel. Moderne bakterier har derimod “mindst hundreder og typisk tusindvis af gener.”
Trods nogle teorier om, at det tidlige liv opstod nær hydrotermiske slamper i det dybe hav, er Szostak mere overbevist af forskning, der viser, at de tidligste celler udviklede sig på land i damme eller bassiner, muligvis i vulkansk aktive områder. Ultraviolet lys og lynnedslag kunne have hjulpet med at omdanne molekyler i atmosfæren til cyanid og andre nyttige materialer for at skabe byggestenene til liv. Det lavvandede vand ville give disse materialer et sted at ophobe sig i høje koncentrationer, og vulkansk aktivitet kunne skabe varme og kolde temperatursvingninger, der var nyttige for visse kemiske reaktioner.
En historie om Jorden og livets begyndelse
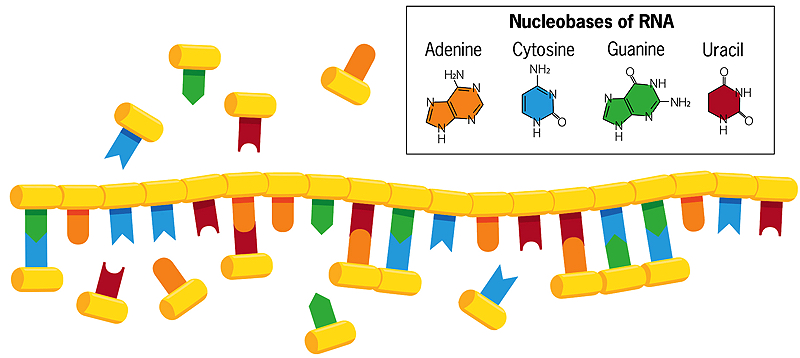
I modsætning til dobbeltstrenget DNA, hvor baserne cytosin og thymin danner par med guanin og adenin på den modsatte streng, kan baserne i en enkelt spiralformet RNA-streng i vand danne associationer med frit svævende nukleobaser (vist på billedet ovenfor). Hvis disse frit svævende baser derefter fusionerer med hinanden, opstår der en ny, spejlvendt kopi af RNA-strengen, som brydes fra den oprindelige, når vandet opvarmes. Når denne nye streng på sin side replikerer sig, danner den en spejlkopi af sig selv, der passer til den oprindelige RNA-streng. Nogle gange opstår der fejl i denne kopieringsproces, og de gavnlige fejl foreviger sig selv. Hver kæde, der fungerer som skabelon for sin egen replikation, udvikler sig således og interagerer med sine omgivelser.
Nogle forskere, herunder Gerald Joyce, foreslår, at livet måske er startet uden for cellerne, hvor frit svævende molekyler mødte hinanden og dannede bindinger, der gjorde det muligt for dem at optræde som liv. Men Szostak hævder, at cellemembranen var nødvendig, bl.a. fordi den ville holde gavnlige genetiske molekyler sammen og forhindre, at de nyttige metabolitter fremstillet af genetisk kodede ribozymer flyder væk i det omgivende vand eller bliver snuppet af andre forbipasserende protoceller.
Eksperimenter i hans laboratorium viste, hvordan en sådan membran kunne vokse og dele sig. Forskerne kombinerede fedtsyrer som oliesyre med vand og en buffer (for at holde pH-værdien i opløsningen stabil) og rystede derefter opløsningen. Når de blev set under et mikroskop, havde ingredienserne samlet sig til vesikler: cirkulære, væskefyldte strukturer med to lag membraner. Ved at tilsætte ekstra fedtsyrer til miljøet – for at tjene som næringsstoffer – fik vesiklerne til at vokse lange, hårlignende tråde, der var så skrøbelige, at selv et let pust af luft på objektglasset i mikroskopet fik dem til at briste i stykker. Szostaks hold opnåede lignende resultater med forskellige membrandannende molekyler og i forskellige miljøer, hvilket tyder på, at dette er en plausibel måde for en protokolcellemembran at vokse og derefter dele sig på. Men hvordan kan denne struktur videregive gavnligt genetisk materiale til den næste generation af datterceller? “Det er det genetiske materiale, der faktisk ser ud til at være et meget vanskeligere problem”, siger han.
For at dele nedarvede egenskaber med de efterfølgende generationer er nutidens celler afhængige af DNA – det dobbelthelixmolekyle, der består af nukleobaserne adenin, cytosin, guanin og thymin – til at lagre og overføre genetisk information. Men for at replikere DNA i cellerne kræves både det enkeltstrengede molekyle RNA og proteinenzymer, og genetisk kodede proteiner er alt for komplekse til at være dannet spontant på den tidlige Jord. Fordi RNA både kan lagre og overføre genetisk information (ligesom DNA) og katalysere kemiske reaktioner (ligesom proteinenzymer), mener mange forskere, at primitive celler brugte RNA-molekyler til at udfylde både genetiske og enzymatiske roller.
I slutningen af 1960’erne foreslog den britiske videnskabsmand Leslie Orgel, at RNA, eller noget lignende, kunne have været det første molekyle på Jorden, der replikerede og udviklede sig. Dette blev kendt som “RNA World”-hypotesen. Orgel og andre arbejdede i årtier på at forstå, hvordan kæder af RNA kunne være kommet sammen og replikeret, men deres bestræbelser var ikke helt vellykkede. “Der var mange fremskridt i begyndelsen, og så gik det bare i stå, fordi der var et dusin forskellige problemer, og på det tidspunkt var der ikke noget indlysende svar på nogen af dem”, forklarer Szostak. “Stort set alle blev frustrerede og tænkte: ‘Måske startede livet ikke med RNA. Måske er der noget, der er enklere, nemmere at lave og nemmere at replikere.”
“Vi ved så meget mere nu, og bare ved at bryde tingene ned i individuelle, mindre problemer har vi været i stand til at løse nogle af dem.”
Forskerne ledte efter alternativer til RNA, “og det førte til 10-20 år med virkelig interessant kemi, hvor vi fandt frem til en masse interessante molekyler,” bemærker Szostak. “Men indtil videre er der ikke fundet noget enklere eller bedre end RNA, der virkelig virker.” Nogle forskere støtter en “metabolisme-først”-hypotese, der antyder, at livet kunne være startet uden genetisk materiale gennem en række selvbærende reaktioner, men Szostak og andre er fortsat ikke overbeviste. For omkring syv år siden begyndte han at se tilbage på de forhindringer, som Orgel og hans samtidige stod over for, da de skulle forstå RNA-syntesen. “Vi ved så meget mere nu,” forklarer han, “og bare ved at bryde tingene ned i individuelle, mindre problemer har vi været i stand til at løse nogle af dem.”
Szostaks laboratorium fokuserer nu næsten udelukkende på, hvordan oprindeligt RNA kan have kopieret sig selv. Moderne RNA bliver sat sammen på meget regelmæssige, forudsigelige måder, hvor nukleotidbygningsblokke klikker sammen som en kæde. Hver blok indeholder et sukkerstof (ribose), et fosfat og en af fire nukleobaser (også kaldet nitrogenbaser) -adenin, cytosin, guanin og uracil (normalt kaldet A, C, G og U). Ribose-fosfat-enhederne er forbundet sammen til RNA-“rygraden”. I moderne celler katalyserer proteinenzymer den reaktion, der sammenføjer nukleotid-enhederne til RNA-kæder.
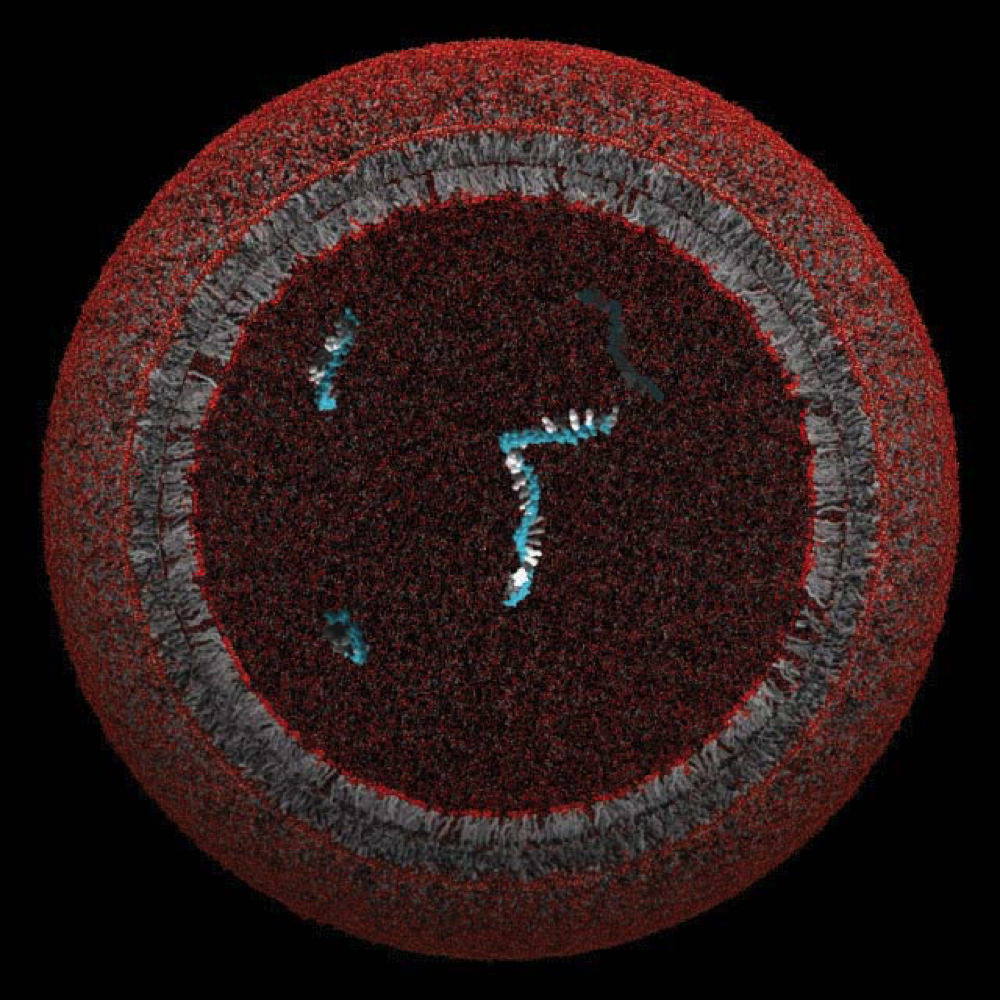
En modelprotocelle, hvis lipidemembran kan have omsluttet og beskyttet et enkelt gen
Billede venligst udlånt af Szostak Laboratory
I protoceller på den tidlige Jord ville RNA-kæden have fungeret som en skabelon, hvorpå en ny, komplementær kæde af nukleotider samles, inden den løsnes for at blive en yderligere skabelon, hvorpå andre frit svævende nukleotider kan klikkes sammen. Men i modsætning til det forudsigelige moderne RNA havde det tidlige RNA ikke gavn af proteiner til at katalysere opbygningsprocessen. (Fordi proteiner ikke kan dannes uden det komplekse og højt udviklede cellulære maskineri, der kræves til deres syntese, mener de fleste forskere, at det er usandsynligt, at de fandtes på den primordiale Jord). Tidlig RNA var derfor sandsynligvis mere uoverskueligt med meget mere variation i sukkerryggen og baserne, siger Szostak. Hans hold eksperimenterer i øjeblikket “for at få en idé om, hvilken variabilitet der ville blive tolereret, og hvad der ville blive sorteret fra”. Vores nuværende model er, at man starter med noget, der er rodet og har mange forskellige variationer, og i løbet af replikationscyklusser ender man med noget, der er tættere på moderne homogent RNA.”
En artikel fra 2018 af Szostak og ph.d.-studerende Seohyun Kim illustrerer den mulige variabilitet af tidligt RNA og dets A, C, G og U-byggeklodser. Forskere har gjort fremskridt med at forstå, hvordan C og U kan være blevet genereret af præbiotiske kemiske reaktioner, men de har haft svært ved A og G. Szostak og Kim foreslår, at RNA kan være startet med forskellige nukleobaser, og deres eksperimenter har vist, at nukleosiden inosin, som kan laves af A (adenin), fungerer effektivt i stedet for G (guanosin). “Det forenkler det overordnede problem”, forklarer Szostak. “Nu skal vi bare vide, hvordan vi laver A.”
Andre nylige eksperimenter i laboratoriet har fokuseret på de metalioner, der er nødvendige for at sætte gang i RNA-kopieringsprocessen. Forskerne bruger typisk magnesium, “men vi er nødt til at bruge det i meget høje koncentrationer,” hvilket har negative bivirkninger, idet det udløser nedbrydning af RNA eller ødelæggelse af cellemembranen. “Forhåbentlig finder vi en enkel, plausibel måde at få det hele til at fungere med mindre magnesium, eller måske skal vi genoverveje hele problemet og gå til det fra en anden retning”, forklarer Szostak. “Vi føler os bare rundt i mørket og prøver at se, hvor der måske er en vej til en løsning.”

Vulkanisme, som f.eks. ved Yellowstones Grand Prismatic Spring, ville have gjort det lettere for RNA at udvikle sig tidligt.
Foto af Istock Images
Nogle af vejene fungerer ikke, og nogle af dem giver endda fejl. I 2016 offentliggjorde Szostaks laboratorium en artikel i Nature Chemistry, der viste, at et peptid kunne have hjulpet RNA med at replikere uden enzymer. Kort efter sluttede forskerkollega Tivoli Olsen sig til laboratoriet og kunne ikke reproducere disse resultater. Hendes gennemgang af artiklen viste, at holdet havde fejlfortolket dataene, og Szostak trak artiklen tilbage. “Vi arbejder på svære problemer, og det sværeste inden for videnskaben er, som jeg tror, Feynman sagde, at man ikke må narre sig selv”, siger Szostak. Den potentielle løsning var spændende, “og jeg tror, at den bare gjorde os blinde for, hvad der foregik.” Den “frelsende nåde”, tilføjer han, er, at de selv opdagede fejlene, selv om han ville ønske, at det var sket “før papiret blev offentliggjort i stedet for bagefter”. Jeg vil sige, at mange af vores idéer ender med at være forkerte, men det opdager vi normalt ret hurtigt.”
Han er optimistisk med hensyn til potentialet i de seneste opdagelser i andre laboratorier; for eksempel har John Sutherland fra Medical Research Council (MRC) Laboratory of Molecular Biology i Cambridge, England, for nylig opdaget en ny teknik til aktivering af nukleotider – kemisk ændring af disse byggesten for at sætte gang i replikationsprocessen. Sutherland delte disse resultater med Szostaks laboratorium, før de blev offentliggjort, og Szostak siger, at de er ved at undersøge mulighederne for at inkorporere denne teknik i deres egne eksperimenter.
Når hans hold har samlet fungerende protoceller, der indeholder stykker af RNA, forventer de, at information i nogle specifikke RNA-sekvenser vil give nogle fordele til den protocelle, der omgiver den. For eksempel tyder tidligere arbejde på, at nogle RNA-sekvenser kan foldes til at blive til et ribozym, der kan lave lidt mere avancerede lipider til cellemembranen. “Enhver RNA-sekvens, der gør noget, der hjælper dens egne celler med at overleve eller replikere hurtigere, vil begynde at overtage populationen”, forklarer Szostak. “Det er begyndelsen på den darwinistiske evolution. Og så er vi tilbage til at være biologer igen.”
Efter at have vundet Nobelprisen kunne Szostak have forladt laboratoriet for at hellige sig rejser og foredragsinvitationer, men “han holder sig fokuseret på videnskaben”, siger Gerald Joyce. “Det er det, jeg beundrer mest ved ham.” Nogle vil måske betragte grundforskning som en intellektuel luksus, men dens udøvere hævder, at al anvendt videnskab starter med grundvidenskabelige resultater. “Da Crick og Watson satte sig ned og begyndte at lave papmodeller af DNA’s struktur, havde de ingen anelse om, at det 70 år senere ville afføde en industri til en værdi af milliarder af dollars,” bemærker John Sutherland.
Szostak er fortsat fast besluttet på at arbejde videre med de store, udfordrende spørgsmål og fortsætte årtiers arbejde. “Jeg håber at kunne opbygge et udviklende cellulært system, inden jeg går på pension,” siger han. Han er optimistisk med hensyn til sine chancer. “Jeg tror, at vi er ved at nå dertil. Der er et par svære problemer mere, og så tror jeg, at alt forhåbentlig vil være løst om et par år.”