- Baggrund
- Normal fysiologi og patofysiologi for kalium
- Aktionspotentialet i en ikke-pacemaker kardiomyocyt
- Aktionspotentialet i en hjertets pacemakercelle
- Stridsledning
- Refraktær periode
- Hyperkaliæmi, klassifikation og årsager
- Klassifikation
- Orsager
- Virkninger af hyperkaliæmi
- Metaboliske virkninger
- Natrium-kalium-pumpe
- Konklusion
Baggrund
Kalium er et blødt, sølvhvidt, meget reaktivt kation, der tilhører gruppen af alkalimetaller i det periodiske system. Det er den hyppigst forekommende kation i det menneskelige legeme som helhed og den mest udbredte ion i dets intracellulære rum.
En vestlig kost indeholder i gennemsnit 80-100 mEq kalium om dagen, og under normale fysiologiske forhold absorberes 90 % af kalium passivt, så der kun er 9,0 mmol tilbage til fækal udskillelse. De 3500-4000 mmol, der opbevares i kroppen, står i misforhold til døgnets plasmakaliumniveauer, som normalt holdes i intervallet 3,5-5,3 mmol/L gennem en stram homeostase-mekanisme med de laveste niveauer om natten og i de tidlige morgentimer og det højeste topniveau i eftermiddagstimerne.
Når det er absorberet i blodbanen, bliver det nyrens rolle at matche kaliumindtaget med kaliumudtaget; det kræver flere timer, hvor den “interne kaliumbalance” under indflydelse af insulin og katekolaminer opretholder midlertidig homøostase ved at flytte kalium mellem det intracellulære og det ekstracellulære rum. Stimulering af alfa-receptorerne hæmmer kaliumindgangen i cellerne, og stimulering af betareceptorerne fremmer den ved at aktivere natrium-kalium-ATPase-pumpen.
Natrium-kalium-ATPase-pumpen er det gate-keeper-enzym, der er placeret i sarcolemmaet. Det er med til at sikre 98 % af det kalium (ca. 144,0 mmol), der tilbageholdes i cellen. Dette sikrer bevarelsen af den vitale potentialforskel på tværs af cellemembranerne, der er nødvendig for en korrekt cellefunktion, især de exciterbare celler som f.eks. nerveceller og hjertemuskelceller.
Normal fysiologi og patofysiologi for kalium
Efter den hurtige optagelse er kalium med til at orkestrere kroppens egne niveauer gennem frigivelse af insulin og aldosteron. Andre iboende kropsstimuli, der også har vist sig at styre kroppens kaliumniveauer, omfatter beta-2 adrenerge receptorer, alkalisk blod PH og cellulær anabolisme.
Fremlæggelse af insulin og aldosteron: Indtaget kalium kommer hurtigt ind i kredsløbet. Når det når portalkredsløbet, stimulerer det bugspytkirtlen til at frigive insulin. Samtidig medfører det cirkulerende kalium, der når frem til de juxtaglomerulære celler, frigivelse af renin. Når renin når frem til leveren, omdannes det til angiotensin I. Angiotensin I bevæger sig til lungerne, hvor det omdannes til angiotensin II. Angiotensin II fuldfører derefter sin rejse tilbage til nyrerne gennem det cirkulerende blod for at stimulere zona glomerulosa til at udskille aldosteron.
Intern kaliumbalance: Det insulin, der frigives postprandialt, virker primært på skeletmuskulaturen og aktiverer to veje, den AKT-afhængige vej, der er ansvarlig for indsættelse af glukosetransportøren GLUT4, og APK-vejen, der aktiverer den cellulære natrium-kalium-ATPase for at flytte kaliumet til det intracellulære rum. I modsætning til den AKT-afhængige vej er APK-vejen ikke forringet af hverken metabolisk syndrom eller kronisk nyresygdom (figur 1).
Udskillelse: Kalium, der filtreres af nyrernes glomeruli, reabsorberes passivt i den proximale tubulus og Henle-løkken i forhold til den leverede mængde natrium og vand. Normalt når kun ca. 10 % af den filtrerede belastning frem til det distale nefron.
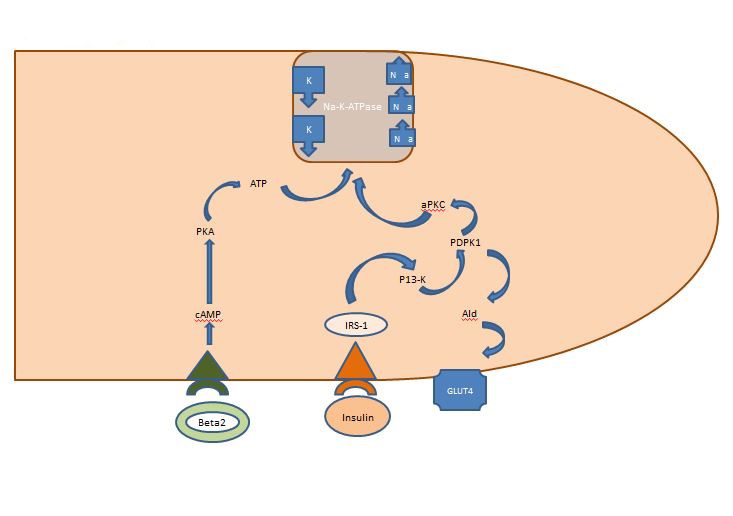
Figur 1. Insulins virkning på en skeletmuskelcelle. Insulin frigivet postprandialt aktiverer to veje i skeletmuskulaturen, den AKT-afhængige vej, der er ansvarlig for indsættelsen af glukosetransporteren GLUT4, og APK-vejen, der aktiverer den cellulære natrium-kalium-ATPase for at flytte kaliumet ind i det intracellulære rum.
I begyndelsen af det distale konvolut tubulus begynder sekretionen af overskydende kalium og øges gradvist, efterhånden som den bevæger sig længere frem mod det distale nefron og ind i samlekanalen. Dette medieres af opregulering af hydrogenkalium ATPase på de alfa-interkalerede celler .
Anstedeværelsen af højere kaliumniveauer i de peritubulære celler i nyrerne aktiverer RAAS-systemet til at frigive aldosteron, som aktiverer natrium-kalium ATPase i den basolaterale membran, hvilket resulterer i et fald i det intracellulære natrium, hvilket fører til øget elektrogene transport af kaliumoptagelse ved at hyperpolarisere membranens spænding og tillade dets udskillelse i urinen .
I hyperkaliæmi kan den kvote af kalium, der udskilles gennem tyktarmen, stige med op til 30 %, f.eks, i tilfælde af nyresvigt, hvor kaliumet så aktivt optages af den aktiverede natrium-kalium ATPase-pumpe i koloniens enterocytternes basolaterale membran for at blive udskilt på den anden side, ud i koloniens lumen gennem cellernes apikale store calciumafhængige kaliumkanaler.
Det fremgår således af ovenstående, at mekanismen for homeostase af kaliumplasmaniveauet hovedsageligt er bestemt af samspillet mellem tre samtidige transaktioner – kaliumindtagelse, kalium intra/ekstracellulære forskydninger og kaliumudskillelse via urinen, som alle i sidste ende er afhængige af natrium-kaliumpumpen.
For at forstå mekanismen bag den overhængende fare ved hyperkaliæmi og håndteringen heraf må man forstå aktionspotentialets fysiologi og indmaden i natrium-kalium ATPase-enzymet.
Elektrofysiologi af aktionspotentialet, dvs, ionisk bevægelse gennem cellemembranerne, bestemmes af forskellen mellem to potentialer, et “kemisk potentiale”, hvor ionerne bevæger sig nedad deres koncentrationsgradient, og et “elektrisk potentiale”, hvor ioner og molekyler frastøder ens ladninger, hvilket giver transmembranpotentialet (TMP), som siges at være +ve, når nettobevægelsen af +ve-ioner er til ydersiden af cellen og omvendt.
Aktionspotentialet i en ikke-pacemaker kardiomyocyt
Der er fem faser i et aktionspotentiale, som begynder og slutter ved fase 4. De pumper, der er involveret i denne proces, omfatter sarcolemma-natrium-kalcium-udveksleren, calcium-ATPase og i sidste ende natrium-kalium-ATPase.
- Fase 4. Hvilefasen: Denne fase har et hvilepotentiale på -90 mV som følge af den konstante udadgående bevægelse af kalium via de indadgående rektificatorkanaler. I denne fase er både natrium- og calciumkanalerne lukkede.
- Fase 0. Depolarisationsfasen: Affyring af en pacemakercelle eller dens ledelse gennem en nabocelle udløser stigningen af TMP til over -90 mV. På dette tidspunkt begynder de “hurtige natriumkanaler” at åbne en efter en, så natrium kan trænge ind i cellen, hvilket øger TMP, og når tilstrækkeligt mange hurtige natriumkanaler er åbnet til at give -70 mV, sættes en selvbærende indadgående natriumstrøm i gang, TMP depolariseres hurtigt til 0 mV i en forbigående overgangsperiode, der kaldes “overshoot”, hvorefter de tidsafhængige hurtige natriumkanaler lukker og de “langtidsåbne” calciumkanaler åbner for at hæve TMP til -40 mV og tillade en lille stabil calciumtilstrømning ned ad koncentrationsgradienten.
- Fase 1. Den tidlige repolariseringsfase: Denne fase starter med den svagt +ve TMP og den korte åbning af nogle kaliumkanaler, der resulterer i, at kalium strømmer til ydersiden af cellen, hvilket bringer TMP tilbage til ca. 0 mV.
- Phase 2. Plateaufasen: Her er de to modstrømme elektrisk afbalancerede og resulterer i, at TMP’en holdes afbalanceret lige under 0 mV. “De langåbnede calciumkanaler” er stadig åbne, hvilket resulterer i en konstant calciumstrøm ind i cellen. Den forsinkede rectifikator-kaliumkanal tillader passage af kalium til ydersiden af cellen ned ad dens koncentrationsgradient.
- Fase 3. Repolariseringsfasen: I denne fase inaktiveres calciumkanalerne gradvist, og den vedvarende kaliumstrøm til ydersiden af cellen overstiger således den indadgående calciumstrøm, hvorved kaliumet returneres til det intracellulære rum og natrium og calcium til ydersiden af cellen.
Aktionspotentialet i en hjertets pacemakercelle
Hjertets pacemakerceller har en medfødt automatik, der tillader deres depolarisering i rytmiske cykler. Den sinoatriale knude (SAN) har den højeste selvinitierede depolariserende rytme med en hastighed på 60-90/min, efterfulgt af atrioventrikulærknuden (AVN) med en hastighed på 40-60/min og derefter Purkinjefibrene og ventrikelmusklen med 20-40/min.
Pacemakercellernes membranpotentialer er ustabile, og deres aktionspotentialer har ingen klart afgrænsede faser. De har færre indadrettede kaliumkanaler, og deres TMP falder aldrig til under -60 mV, hvilket eliminerer den rolle, som de hurtige natriumkanaler spiller, der kræver en TMP på -90 mV, hvilket resulterer i fraværet af den hurtige depolarisationsfase.
Ved TMP >-60 mV sættes “funny/pacemaker”-strømmen i gang med en spontan strøm af ioner gennem de langsomme natriumkanaler, der depolariserer TMP til <-50 mV og derefter tilbage til -60 mV, når kalciumkanalerne lukker.
Stridsledning
Alle kardiomyocytter er elektrisk koblet gennem gapjunctionen, herunder pacemakercellen. Dette letter den udbredte depolarisering af alle naboceller, hvilket gør hjertet til én funktionel enhed, hvor cellen med den højeste iboende hastighed bliver “pacemaker”.
Refraktær periode
Den længere refraktær periode under det lange plateau i fase 2 på grund af de langsomme calciumkanaler giver den nødvendige tid til fuldstændig tømning af ventriklerne før den næste kontraktion. Refraktærperioder kan være absolutte (ARP), effektive (ERP) eller relative (RRP). I en ARP er cellen absolut uopnåelig.
En ERP varer fra ARP til det korte segment af fase 3. En stimulus på dette tidspunkt kan minimalt depolarisere cellen, men depolarisationsniveauet er svagere end at propagere et aktionspotentiale til nabocellerne.
RRP fremkaldes af en stimulus, der ligger over det normale, og som fører til depolarisering af cellen og produktion af et aktionspotentiale.
En “supra-normal periode” er en hyperexciterbar tilstand, hvor en svagere stimulus end normalt kan føre til en arytmi, hvilket gør det nødvendigt at synkronisere under kardioversion for at undgå ventrikelflimmer (figur 2).
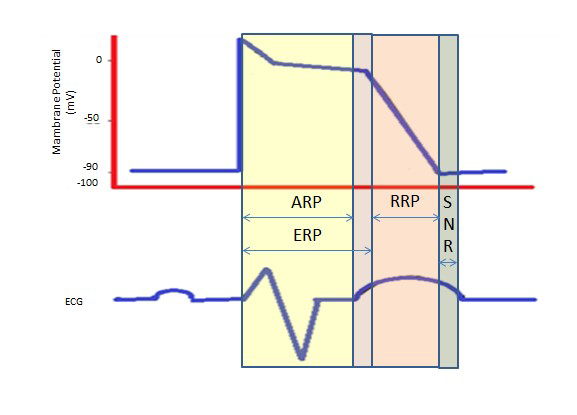
Figur 2. Refraktære perioder. ARP: Absolute refraktærperiode; ERP: Effektiv refraktær periode; RRP: Relativ refraktær periode; SNR: Supranormal refraktær periode
Hyperkaliæmi, klassifikation og årsager
Klassifikation
Hyperkaliæmi klassificeres som mild, når niveauerne ligger i intervallet 5,5-6,0 mmol/L, moderat fra 6,1-6,9 mmol/L og svær ved niveauer på 7.0 mmol/L eller derover, og ved ethvert niveau, hvor der forekommer EKG-forandringer.
Orsager
Hyperkaliæmi opstår, når kompensationsmekanismer ikke længere er i stand til at klare ubalancen, hvorfor den normalt er multifaktoriel.
- Stigning i indtag af kalium via en hvilken som helst vej, f.eks, oralt indtag via kosten eller intravenøs indgift af kaliumholdige væsker som penicillin G.
- Retention i nyrerne: Da kaliumudskillelsen afhænger af aldosteron og tilførsel af en tilstrækkelig distal mængde natrium og vand i nefronerne, kan tilstande som nyresvigt, binyrebarkinsufficiens (Addisons sygdom) , hyporeninæmisk hypoaldosteronisme type IV, renal tubulær acidose, især hos patienter med diabetisk nefropati, samt enhver tilstand, der fremmer hypoperfusion som ved volumenudtømning og kongestiv hjertesvigt, vil påvirke den indviklede kaliumbalance i kroppen og prædisponere for hyperkaliæmi.
- Adrenalinsufficiens: Dette skal udelukkes hos hyperkaliæmiske patienter, især ved tilstedeværelse af hyponatriæmi og muskelsvaghed. For at screene for primær binyrebarkinsufficiens udføres en standard cosyntropinstimuleringstest, hvor 0,25 mg syntetisk cosyntropin gives som en intravenøs bolus efterfulgt af plasmakortisolmåling 45 minutter til 1 time senere. Værdier på mindre end 20 mcg/dL tyder på binyrebarkinsufficiens.
- Medikamenter, der tilbageholder kalium: receptpligtige lægemidler, der reducerer natrium-kalium ATPaseaktiviteten, såsom beta-adrenerge receptorblokkere, og lægemidler, der reducerer aldosteronsekretionen, såsom ACE- og ARB-hæmmere, ikke-steroide antiinflammatoriske lægemidler og kaliumsparende diuretika, kræver nøje opfølgning for at undgå iatrogen hyperkaliæmi, især i den geriatriske aldersgruppe med deres progressive fald i nyrefunktionen som en del af aldringsprocessen.
- Forstyrrelser i den transcellulære forskydning af kalium: Dette kan forekomme ved acidose, hyperglykæmi, hyperosmolalitet, svær motion, vævsnedbrydning, hyperkaliæmisk periodisk paralyse og med beta-adrenerge blokkere. For hvert fald på 0,1 enhed i blodets PH-værdi stiger serumkalium med ca. 0,6 mmol/L (mindre, hvis acidosen er forårsaget af organiske syrer) .
- Pseudo-hypoaldosteronisme er en medfødt autosomal recessiv sygdom, hvor nyrerne er resistente over for virkningerne af aldosteron.
- Pseudo-hyperkaliæmi må heller ikke overses: Som navnet antyder, forekommer dette, når der er forhøjet serumkalium i tilstedeværelse af normalt plasmakalium. Det kan ses ved hæmolyseret blod, langvarig stram tourniquet under en blodprøvetagningsprocedure, hvilket medfører ekstracellulær frigivelse af kalium, ved gentagen knytning af næven under flebotomi, traumatisk venepunktur, ved leukocytose og trombocytose og ved nogle ualmindelige genetiske syndromer som f.eks. familiær pseudo-hyperkaliæmi og hereditær sfærocytose. Det kan dog også blot være et resultat af en simpel laboratoriefejl.
Virkninger af hyperkaliæmi
Mild hyperkaliæmi er ofte asymptomatisk og opdages tilfældigt ved laboratorieprøver på grund af sine vage symptomer som f.eks. utilpashed, muskelsvaghed og paræstesier. Alvorlig hyperkaliæmi vil påvirke den neuromuskulære funktion i form af svaghed og lammelse af skeletmuskulaturen; dette er dog ikke en hyppig præsentation, da den kardiale toksicitet dominerer billedet og er den foreløbige præsentation. Kardiel toksicitet vil normalt præsentere sig på EKG’et på følgende trinvis eskalerende måde, selv om det ikke nødvendigvis er tilfældet, afhængigt af ætiologien:
- Ved niveauer større end 5,5 mEq/L øger stigningen i kaliumkanalernes konduktans lkr-strømmen, hvilket fører til hurtig repolarisering i form af en toppet T-bølge på overflade-EKG’et. Disse T-bølger kan adskilles fra dem ved myokardieinfarkt og CVA ved deres korte varighed på mellem 150-250 msek.
- Ved kaliumniveauer på over 6,5 mEq/L opstår der en tilstand af vedvarende subthreshold-depolarisering, hvilket medfører en forsinkelse i atriel og ventrikulær depolarisering. Faldet i fase 0 af aktionspotentialet fører til et længere aktionspotentiale, hvilket medfører en forsinkelse af den intraventrikulære og atrioventrikulære ledning. På overflade-EKG’et vil dette vise sig ved en udfladning og tab af P-bølger og udvidelse af QRS-komplekserne. Med stigende forsinkelse i den intraventrikulære ledelse begynder overflade-EKG’et at vise tegn på venstre og højre bundledningsblok. Dette kan adskilles fra bundle branch disease ved, at forsinkelsen ved hyperkaliæmi fortsætter i hele QRS-komplekset og ikke kun i henholdsvis den indledende eller afsluttende del.
- Ved 10 mEq/L sker der ikke længere sinoatrial ledelse, og den accelererede junctional rytme tager over. Ventrikulære arytmier udvikles med sammensmeltning af de udvidede QRS-komplekser med T-bølgerne til sidst for at danne det klassiske sinusbølgemønster. Når dette sker, er VF og asystoli nært forestående, og hjertestop vil derefter indtræffe.
- I nogle tilfælde kan ændringerne være uregelmæssige og uforudsigelige, og EKG’et vil springe fra normal til asystoli på grund af variabiliteten i de ætiologiske faktorer og deres indflydelsesrige virkninger, f.eks. kaliumændringshastighed, calciumkoncentration, pH- og natriumkoncentration. Hyperkaliæmi bør derfor behandles akut, når kaliumniveauet bliver større end 6,5 mmol/L, eller ved tilstedeværelse af EKG-manifestationer af hyperkaliæmi uanset kaliumniveauet. Andre rapporterede associationer med akut hyperkaliæmi omfatter: billede af pseudo MI på EKG-optagelsen med massivt ST-T-segment som følge af forstyrrelser i myocytrepolarisationen, korte PR- og QT-intervaller, sinus takykardi, sinus bradykardi, idioventrikulær rytme, 1. og 2. grads hjerteblok .
Metaboliske virkninger
Hyperkaliæmi fører til hyperchloræmisk metabolisk acidose, da hyperkaliæmien fremmer den intracellulære optagelse af kalium i bytte for hydrogenioner. Dette skaber intracellulær alkalose, der undertrykker nyreammoniakproduktionen i de proximale tubuli, hvilket fører til et fald i urinammonium- og syreudskillelsen og en renal tubulær acidose af type IV .
Natrium-kalium-pumpe
Natrium-kalium-ATPase blev opdaget i 1957 af Skou, som senere fik en del af Nobelprisen i kemi i 1997 for sin opdagelse.
Skou var den første til at opdage natrium-kalium-ATPase i sarkolemmaet i hjertemuskulaturens celleoverflade. Dens tilstedeværelse blev senere påvist i alle eukaryote encellede og flercellede organismer.
Natrium-kalium-pumpen fungerer ved at forbinde hydrolysen af ATP med den cellulære eksport af tre natriumioner i bytte for to kaliumioner mod deres elektrokemiske gradienter. Den er det molekylære mål for digitalis og digoxin, der har været anvendt siden det 18. århundrede som fingerbølsekstrakter.
Natrium-kalium-pumpens virkning reguleres af et fosfoprotein fosfolemman, hvis affosforylering fører til hæmning af pumpen, og hvis fosforylering fører til en forøgelse af pumpeaktiviteten. Den har tre fosforyleringssteder, to palmitoyleringssteder og et glutathionyleringssted, hvilket forklarer de mange signaler, der er i stand til at stimulere og hæmme pumpen.
Selve natriumkaliumpumpen er et enzym, der består af flere underenheder med flere isoformer. Tilstedeværelsen af alfa- og beta-underenhederne (hovedsagelig B1 i hjertet) er afgørende for dens funktion. For nylig er der blevet identificeret en tredje protein-underenhed gamma i nyrerne, men dens funktion er indtil videre ukendt.
Alfa-underenheden er den katalytiske kerne i natrium-kaliumpumpeenzymet. Den er ca. 100 kDa og indeholder bindingsstederne for natrium, kalium, ATP og kardiotone steroider såsom ouabain. Kun alfa 1 og alfa 2 har en betydelig tilstedeværelse i en normal hjertemyocyt og er funktionelt forbundet med natrium-kalcium-udveksleren (NCX). Alpha 3 er blevet rapporteret til at erstatte alpha 2 i eksperimentelle modeller for hjertesvigt .
Data fra nyere eksperimenter taler for, at begge alpha 1 alpha 2 underenheder af pumpen er involveret i reguleringen af excitation-kontraktion (E-C) koblingen. Alpha 1, som viste sig at være mere jævnt fordelt over sarkolemmaet, menes at spille mere en “husholdningsrolle” og kontrollere både kontraktilitet og den bulk intracellulære natrium, mens alfa 2, hvis udtryk er koncentreret i T-tubuli sammen med andre nøglekomponenter i E-C koblingen, menes at fokusere hovedsageligt på kontraktilitet .
Kendte faktorer, der kan kontrollere natrium-kaliumpumpen, omfatter: ATP, intracellulært natrium, sub-sarcolemmale barrierer og uklare rum, membranpotentiale, intracellulære signalveje (adrenerge signalveje, proteinkinase A & C, nitrogenoxid, phospholemman), direkte regulering af små molekyler (lipider, endogene kardiotoniske steroider), andre associerede proteiner (caveolae og caveoliner og ankyrin).
Konklusion
Hyperkaliæmi er en klinisk udfordring og kan forekomme hos op til 10 % af indlagte patienter . Dens slutresultat er livstruende. Da alle celler i kroppen i sidste ende påvirkes af natrium-kaliumpumpen, og iskæmiske hjertemuskler er kendt for at ekstrudere deres kalium ekstracellulært, hvilket fører til en reduktion af arytmetærsklen med mulighed for ventrikulære arytmier, der forværrer hypopolariseringen og sænker tærsklen endnu mere, skal flere undersøgelser fokuseres på manipulation af natrium-kaliumpumenzymet, da dets kontrol kunne ændre resultaterne af hjertestop gunstigt og omskrive de nuværende HLR-retningslinjer.