GENERAL CHEMISTRY TOPICS
Energi: Grundlæggende begreber
Energiformer: Kinetisk og potentiel.Arbejde og energi.Varme og temperatur.Elektrostatisk potentiel energi.
Energi: kinetisk og potentiel
Energibegrebet er grundlæggende for de fysiske videnskaber. Her er det vores mål at opstille nogle første principper vedrørende energi og at introducere nogle af de former, som energi antager, og som er af særlig betydning for kemi. Først og fremmest er det ofte meget nyttigt at definere et system som en bestemt del af universet, som vores observationer er foretaget på. Systemet består af et objekt eller en samling af objekter og adskiller sig fra resten af universet – som vi kalder omgivelserne – ved en reel eller imaginær grænse.
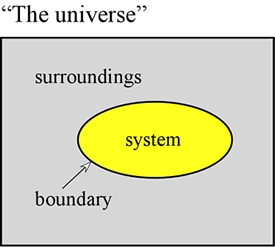
En gasprøve, der holdes inden for et fast volumen, f.eks. en metalcylinder, er et eksempel på et system – et system, som vil være relevant for os, når vi tager fat på studiet af gassers generelle egenskaber. Andre eksempler er en gasprøve inde i en ballon eller en forbrændingsblanding i en cylinder med et stempel. I begge disse tilfælde er systemet omsluttet af en fysisk, men bevægelig grænse, således at systemets volumen ikke er fast. Et andet eksempel, som vi ofte vil se på, er en blanding af stoffer i opløsning, der undergår en kemisk reaktion i et reagensglas eller bægerglas. Den terminologi, der er indført her, er af særlig betydning for studiet af, hvordan energi manifesterer sig i kemiske systemer, som i vid udstrækning falder ind under termodynamikken.
I den almindelige kemi er de systemer, vi betragter som relevante, typisk i hvile, og tyngdevirkninger ignoreres. Ofte er vi mest interesseret i systemer, hvori der finder kemiske reaktioner sted, og hvor systemets kemiske sammensætning ændrer sig med tiden. Lad os dog i øjeblikket anlægge et bredere perspektiv ved at bruge mekaniske systemer som f.eks. et svingende pendul eller billardkugler, der ruller og kolliderer, til at hjælpe os med at forstå generelle principper vedrørende energi.
Et system kan siges at besidde energi på to forskellige måder, som vi kalder kinetisk og potentiel energi. Kinetisk energi er energien i stof i bevægelse. Fysikken giver en nøjagtig matematisk definition af kinetisk energi (KE), som er vist i ligningen (nedenfor til venstre).
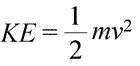
Her er et objekts kinetiske energi repræsenteret som et produkt af objektets masse (m) og kvadratet på dets hastighed (v), også multipliceret med konstanten ½. Hvis systemet består af mere end ét objekt, kan den samlede kinetiske energi udtrykkes som en sum af de enkelte objekters kinetiske energier.
Vi kan udlede enheder for energi ud fra denne definition. SI-enheden for energi er joule (J), som er defineret som:
1 J = 1 kg-m-s-2
Potentialeenergi er et systems energi, der typisk kan omdannes til kinetisk energi i en eller anden form og i stand til i et eller andet omfang at producere en størrelse kaldet arbejde (diskuteres yderligere nedenfor). Et klart eksempel på potentiel energi er en mursten på afsatsen af en bygning. Murstenen har en vis mængde potentiel energi i kraft af sin højde – dens placering i forhold til et gravitationsfelt. Hvis vi giver murstenen et skub, så den falder ned fra afsatsen, bevæger den sig spontant i retning af lavere potentiel tyngdeenergi, og når den gør det, får den kinetisk energi. Et andet eksempel er den elektriske potentielle energi i et batteri (som udtrykkes som spænding). Når der oprettes et kredsløb med en ledning og en pære, som forbinder de to poler i et batteri, får forskellen i elektrisk potentiale mellem dem elektronerne i ledningen til at bevæge sig (kinetisk energi), hvilket resulterer i produktion af både varme og lys.
Et vigtigt generelt princip om energi er, at den hverken kan skabes eller ødelægges. Dette er kendt som loven om bevarelse af energi. Kvantitativt betyder det, at i et system som f.eks. en faldende mursten eller et pendul i et ur er summen af kinetisk og potentiel energi konstant. Dette er lidt af en abstraktion, da der i et rigtigt pendul hele tiden går noget af energien tabt på grund af friktion, og der skal tilføres en lille mængde energi til pendulet for at holde det i svingning (og uret i gang). Men hvis man ved omhyggelige eksperimentelle målinger tager højde for denne “tabte” energi (som i virkeligheden viser sig som en stigning i varmeenergien i de omgivende luftmolekyler), viser det sig, at energien faktisk altid er bevaret. Et andet forbehold er opsummeret i Einsteins berømte ligning E = mc2, som udtrykker en grundlæggende ækvivalens mellem masse og energi. En mere generel form af loven om bevarelse af energi, som kan kaldes loven om bevarelse af masse-energi, tager højde for denne ækvivalens. Hvis vi vender tilbage til den almindelige kemi, er sådanne stof-energi-omdannelser ikke typisk dens område, hvorimod studiet af kernereaktioner og radioaktivitet hører under kernefysikken.
Hvis vi betragter en kemisk reaktion, hvor kemiske ændringer ledsages af varmeproduktion, opstår der et spørgsmål: Hvad med bevarelse af energien i dette tilfælde? Svaret er, at der findes en form for potentiel energi, som vi kan kalde kemisk potentiel energi (eller blot kemisk potentiale), som kan tænkes at ligge i reaktanternes molekylære sammensætning. Denne potentielle energi omdannes derefter til energi i form af varme, men det viser sig, at nettomængden af den tilstedeværende energi forbliver konstant, når vi er i stand til at definere og måle varmeproduktionen. Et dagligdags eksempel på det, vi nu kan forstå som kemisk potentiel energi, er en benzinmotor, hvor blandingen af benzin og ilt indeholder en latent form for energi. Denne latente energi i blandingen af benzin og ilt bruges til at producere den kinetiske energi i en bil.
Arbejde og energi
Arbejde er et andet begreb, der tillader en præcis definition i fysikken. Desuden kan mekanikkens love knyttes sammen med energi ved hjælp af arbejdskraft-energi-teoremet. Et spark med en fodbold, eller et hvilket som helst antal lignende eksempler, illustrerer ideen om, at et objekts kinetiske energi kan øges ved påføring af en kraft. Arbejdsenergisætningen, som er en generalisering af denne idé, kan groft sagt formuleres på følgende måde: Ændringen i den energi, som et objekt besidder, er lig med størrelsen af den kraft, der virker på det, ganget med den afstand, som kraften virker igennem.
Den energiforandring, der sker i et system som følge af arbejde, kan være positiv eller negativ, set fra systemets synsvinkel. Arbejdet kan udføres af et system, eller et system kan få udført arbejde på sig af omgivelserne. Hvis der udføres arbejde af et system, mister det energi til omgivelserne. Hvis der udføres arbejde på systemet, øges systemets energi. Når f.eks. en gnist, der udløser en forbrændingsblanding i en cylinder med et bevægeligt stempel, forårsager en hurtig ekspansion af systemet, og ekspansionen er mekanisk koblet til bevægelsen af en stang i omgivelserne, udfører cylinderens system arbejde på omgivelserne og taber derved energi. Dette er naturligvis en del af den måde, hvorpå en forbrændingsmotor omdanner kemisk potentiel energi til den kinetiske energi i en bil i bevægelse.
En af implikationerne af teoremet om arbejde og energi gælder enheder, nemlig at arbejde kan måles i de samme enheder som energi. Da Newtons anden lov er kraft = masse × acceleration, er newton (N), SI-enheden for kraft, afledt som M × L × T -2, og dermed er 1 N = 1 kg m s-2. Kraft gange afstand har størrelserne M × L2 × T -2, og derfor er SI-enheden for energi, joule (J), defineret som 1 J = 1 kg m2 s-2. På dette tidspunkt bør du selv kontrollere, at ligningen for kinetisk energi omfatter den samme kombination af de grundlæggende størrelser masse (M), længde (eller afstand, L) og tid (T).
Varme og temperatur
Vi bruger ordene varme og temperatur ret ofte, og vi taler ofte om varme som en form for energi. Vi har alle en intuitiv fornemmelse af, hvad disse ting er, men her ønsker vi at tænke mere videnskabeligt over dem og give dem mere formelle definitioner, hvis vi kan. Dette er en nødvendig optakt til kvantificeringen af den energi, der svarer til varme, og dermed til de målinger, der skal foretages for at verificere loven om bevarelse af energi. Vi finder ud af, at varmeenergien i et system kan sammenlignes med den samlede kinetiske energi (som defineret ovenfor) af de atomer og molekyler, som det består af. Temperaturen af en genstand eller et system er faktisk et mål for den gennemsnitlige kinetiske energi af de enkelte atomer og/eller molekyler, der udgør den. (NB: Temperaturen er ikke nøjagtigt lig med den gennemsnitlige molekylære kinetiske energi, men er direkte proportional med den. For yderligere oplysninger henvises til webstedet om kinetisk molekylær teori).
En måde at visualisere, hvad vi mener med varme og temperatur, og forskellen mellem dem, er at overveje en billardkugleanalogi. I nogle enkle sammenhænge er billardkuglernes adfærd en passende model for en samling af atomer eller molekyler, f.eks. i en prøve af en gas. Ligesom billardkugler, der netop er blevet ramt af en billardkugle i hurtig bevægelse, bevæger gasmolekylerne sig rundt og preller af på hinanden og på væggene i den beholder, hvori de befinder sig. Billardkuglernes samlede kinetiske energi, som blot er summen af de enkelte kuglers individuelle kinetiske energier, svarer til indholdet af termisk energi i en prøve af gasmolekyler. Ved et “break” i starten af et billardspil fordeles den oprindelige kinetiske energi fra stødkuglen på alle kuglerne på bordet. Nogle bevæger sig ret hurtigt, og andre bevæger sig ikke så hurtigt, men analogien til “varme” eller “termisk energi” for systemet af billardkugler er blot summen af disse kinetiske energier. På den anden side ville temperaturen i billardkuglesystemet være proportional med den gennemsnitlige kinetiske energi for alle kuglerne.
Elektrostatisk potentiel energi
Loven om elektrostatisk tiltrækning og frastødning, eller Coulombs lov, beskriver den kraft, der udøves på et ladet objekt som følge af tilstedeværelsen af et andet ladet objekt. Kraften er lettest at beregne, når ladningerne kan behandles som meget små punktladninger. Størrelsen af den kraft, som et ladet objekt “mærker”, er proportional med produktet af ladningerne (SI-enheden for elektrisk ladning er Coulomb, C) og omvendt proportional med kvadratet på afstanden mellem ladningerne (r i figuren til højre). Kraften er en tiltrækkende kraft (ligesom tyngdekraften og angivet med indadrettede pilespidser i figuren), hvis ladningerne har modsat fortegn, og frastødende, når ladningerne har samme fortegn.
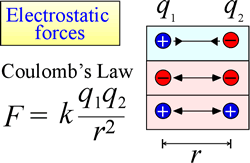
Når kræfter (såsom elektrostatiske, magnetiske og gravitationelle kræfter) kan virke på afstand (gennem rummet, uden mekanisk kontakt), siges de objekter, der er underlagt sådanne kræfter, at befinde sig i et potentielt energifelt. Vi talte om gravitationel potentiel energi ovenfor, og på samme måde vil et ladet objekt i tilfælde af elektrostatiske kræfter have elektrostatisk potentiel energi i kraft af sin placering i et elektrisk felt. Et sådant felt findes i nærheden af enhver anden ladning eller andre ladninger.
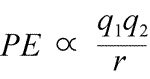
Sammenligning for elektrostatisk potentiel energi: PE er proportional med ladningerne q1 og q2 og omvendt proportional med separationsafstanden r. Formen af den potentielle energifunktion følger matematisk af kraftudtrykket, Coulombs lov.
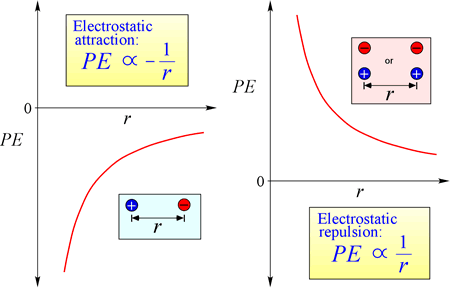
Givet de modsatrettede tegn på ladninger i tiltrækningen er den potentielle energi altid negativ, og jo tættere ladningerne nærmer sig hinanden, jo mere negativ – dvs. jo lavere – bliver den potentielle energi. Når separationsafstanden, r nærmer sig nul, bliver den potentielle energi uendelig negativ. For ladninger med samme fortegn er den potentielle energi ved frastødning altid positiv og bliver uendeligt positiv, når separationsafstanden r nærmer sig nul.
Elektrostatisk potentiel energi er en vigtig faktor i kemi. En forståelse af atomets natur, kemisk binding og intermolekylære kræfter er alle absolut afhængige af at tage højde for indflydelsen af ladning-ladningsinteraktioner, der bidrager til et systems energi.
Vigtige enheder
Energi (SI-enhed) 1 joule = 1 J = 1 kg-m-s-2
Elementarladning, e = 1,60218 × 10-19 C (coulomb, C)
Faraday-konstant: F = NAe = 9,64853 × 104 C-mol-1
Elektrisk potentiale: volt, V 1 V = 1 J C-1