Kerne- og valenselektroner
Når vi fortsætter gennem det periodiske system på denne måde og skriver elektronkonfigurationer for større og større atomer, bliver det trættende at blive ved med at kopiere konfigurationer af de fyldte indre underskaller. I praksis forenkler kemikere notationen ved at bruge et ædelgassymbol i parentes for at repræsentere konfigurationen af ædelgassen fra den foregående række, fordi alle orbitalerne i en ædelgas er fyldte. For eksempel repræsenterer 1s2 2s2 2p6-elektronkonfigurationen for neon (Z = 10), så elektronkonfigurationen for natrium, med Z = 11, som er 1s2 2s2 2p6 3s1, skrives som 3s1
| Fuld elektronkonfiguration | Nobel Gas Shorthand | |||
| Neon | Z = 10 | Ne: 1s2 2s2 2p6 | Ne: 2s2 2p6 | |
| Natrium | Z = 11 |
Na: 1s2 2s2 2s2 2p6 3s1 |
Na: 3s1 |
Elektroner i fyldte indre orbitaler er tættere på kernen og mere tæt bundet til den, og derfor er de sjældent involveret i kemiske reaktioner. Vi vil kalde disse kerneelektroner. For de repræsentative grundstoffer (kolonne 1, 2 og 13-18 i det periodiske system) er kerneelektronerne alle elektroner med en n-værdi, der er lavere end den maksimale n-værdi i elektronkonfigurationen. For eksempel er den højeste n-værdi i natriumatomet 3. Kerneelektronerne er således dem i atomorbitalerne med n < 3, dvs. dem i 1s-, 2s- og 2p-orbitalerne. Natrium har altså 10 kerneelektroner. Vi vil senere tage denne definition af kerneelektroner op igen for overgangsmetaller.
Det betyder, at et atoms kemi hovedsagelig afhænger af elektronerne i dets yderste skal, dem med den højeste n-værdi, som kaldes valenselektronerne. Den forenklede notation gør det nemmere at se valenselektronernes konfiguration. Hvis vi bruger denne notation til at sammenligne elektronkonfigurationen for natrium og lithium, får vi følgende:
| Natrium | 1s2 2s2 2p6 3s1 | 3s1 |
| Lithium | 1s2 2s1 | 2s1 |
Det er let at se, at både natrium og lithium har en s-elektron i deres valensskal. Vi ville derfor forudsige, at natrium og lithium har meget ens kemi, hvilket også er tilfældet.
Da vi fortsætter med at opbygge de otte grundstoffer i periode 3, bliver 3s og 3p orbitalerne fyldt, en elektron ad gangen. Denne række afsluttes med ædelgassen argon, som har elektronkonfiguration 3s2 3p6, hvilket svarer til en fyldt valensskal.
Eksempel 2.2.2.2
Tegn et orbitaldiagram og brug det til at udlede elektronkonfigurationen for fosfor, Z = 15. Hvad er dens valenselektronkonfiguration?
Givet: atomnummer
Spørgsmål: Orbitaldiagram og valenselektronkonfiguration for fosfor
Strategi:
- Lokaliser den nærmeste ædelgas, der går forud for fosfor i det periodiske system. Træk derefter dens antal elektroner fra antallet af elektroner i fosfor for at få antallet af valenselektroner i fosfor.
- Tegn med henvisning til figur 2.1.1 et orbitaldiagram, der repræsenterer disse valensorbitaler. Efter Hund’s regel placeres valenselektronerne i de tilgængelige orbitaler, idet man begynder med den orbital, der har den laveste energi. Skriv elektronkonfigurationen fra dit orbitaldiagram.
- Ignorer de indre orbitaler (dem, der svarer til elektronkonfigurationen for den nærmeste ædelgas), og skriv valenselektronkonfigurationen for fosfor.
Løsning:
A Fordi fosfor står i tredje række i det periodiske system, ved vi, at det har en lukket skal med 10 elektroner. Vi begynder med at trække 10 elektroner fra de 15 elektroner i fosfor.
B De yderligere fem elektroner placeres i de næste tilgængelige orbitaler, som Figur 2.1.1 fortæller os, at det er 3s og 3p orbitalerne:
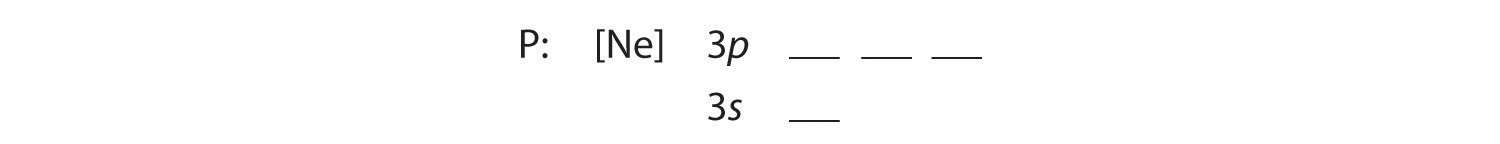
Da 3s orbitalet har lavere energi end 3p orbitalerne, fylder vi det først:
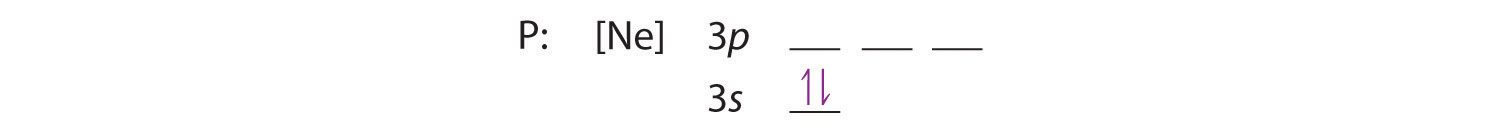
Hund’s regel fortæller os, at de resterende tre elektroner vil besætte de degenererede 3p-orbitaler hver for sig, men med deres spins justeret:
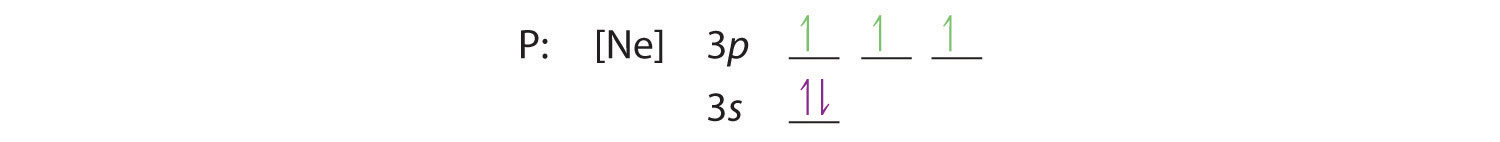
Elektronkonfigurationen er 3s2 3p3.
C Vi får valenselektronkonfigurationen ved at se bort fra de indre orbitaler, hvilket for fosfor betyder, at vi ser bort fra den lukkede skal. Dette giver en valenselektronkonfiguration på 3s2 3p3.
Ovelse 2.2.2.2
Tegn et orbitaldiagram og brug det til at udlede elektronkonfigurationen for klor, Z = 17. Hvad er dets valenselektronkonfiguration?
Svar: Svar: 3s2 3p5
Valenceelektronkonfiguration: 3s23p5
Den generelle rækkefølge, i hvilken orbitalerne er fyldt, er vist i figur 2.2.1. Underskaller, der svarer til hver værdi af n, er skrevet fra venstre mod højre på på på hinanden følgende vandrette linjer, hvor hver række repræsenterer en række i det periodiske system. Den rækkefølge, i hvilken orbitalerne udfyldes, er angivet ved de diagonale linjer, der går fra øverst til højre til nederst til venstre. Således udfyldes 4s orbitalet før 3d orbitalet på grund af afskærmnings- og penetrationseffekter. Følgelig er elektronkonfigurationen for kalium, som indleder den fjerde periode, 4s1, og konfigurationen for calcium er 4s2. Fem 3d-orbitaler udfyldes af de næste 10 grundstoffer, overgangsmetallerne, efterfulgt af tre 4p-orbitaler. Bemærk, at det sidste medlem af denne række er ædelgassen krypton (Z = 36), Kr: 4s2 3d10 4p6, som har fyldte 4s, 3d og 4p orbitaler. Den femte række i det periodiske system er stort set den samme som den fjerde, bortset fra at 5s-, 4d- og 5p-orbitalerne er fyldt i rækkefølge.
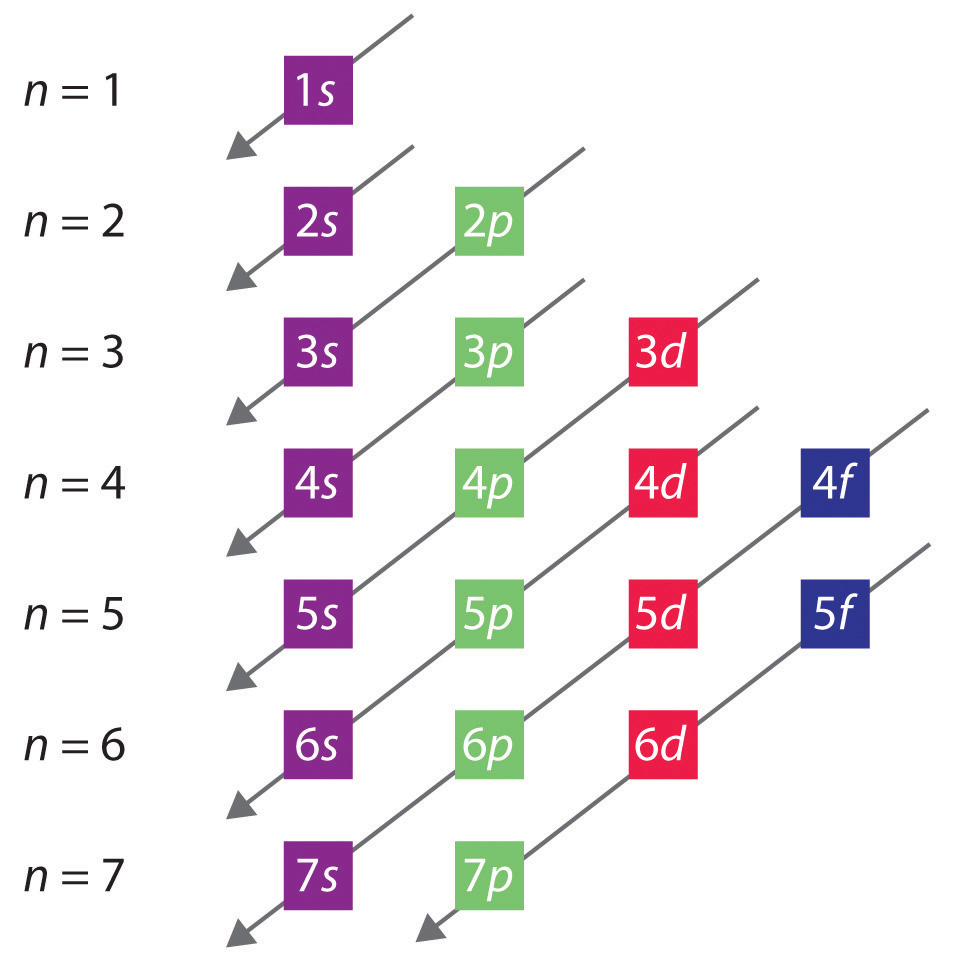
Figur 2.2.1 Forudsigelse af rækkefølgen, i hvilken orbitalerne er fyldt i multielektronatomer. Hvis man skriver underskalerne for hver værdi af hovedkvantetallet på på hinanden følgende linjer, angives den observerede rækkefølge, i hvilken de fyldes, af en række diagonale linjer, der går fra øverst til højre til nederst til venstre.
Den sjette række i det periodiske system vil være forskellig fra de to foregående, fordi 4f-orbitalerne, som kan rumme 14 elektroner, fyldes mellem 6s og 5d-orbitalerne. De grundstoffer, der indeholder 4f-orbitaler i deres valensskal, er lanthaniderne. Når 6p-orbitalerne endelig er fyldt op, er vi nået til den næste (og sidste kendte) ædelgas, radon (Z = 86), Rn: 6s2 4f14 5d10 6p6. I den sidste række er 5f-orbitalerne fyldt mellem 7s- og 6d-orbitalerne, hvilket giver de 14 actinidelementer. Fordi det store antal protoner gør deres kerner ustabile, er alle actiniderne radioaktive.
Eksempel 2.2.3
Skriv kviksølvs elektronkonfiguration (Z = 80), der viser alle de indre orbitaler.
Givet: atomnummer
Spørgsmål: fuldstændig elektronkonfiguration
Strategi:
Med orbitaldiagrammet i figur 2.2.1 og det periodiske system som vejledning skal du udfylde orbitalerne, indtil alle 80 elektroner er placeret.
Løsning:
Gennem at placere elektronerne i orbitalerne i den rækkefølge, der er vist i figur 2.2.1 og ved hjælp af det periodiske system som en vejledning, får vi
| 1s2 | række 1 | 2 elektroner | |
| 2s22p6 | række 2 | 8 elektroner | |
| 3s23p6 | rækken 3 | 8 elektroner | |
| 4s23d104p6 | række 4 | 18 elektroner | |
| 5s24d105p6 | række 5 | 18 elektroner | |
| Række 1-5 | 54 elektroner |
Når de første fem rækker er udfyldt, har vi stadig 80 – 54 = 26 flere elektroner at få plads til. Ifølge figur 2.2.2.2 skal vi udfylde 6s (2 elektroner), 4f (14 elektroner) og 5d (10 elektroner) orbitalerne. Resultatet er kviksølvs elektronkonfiguration:
Hg: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10
Hg: 6s2 4f14 5d10
med en fyldt 5d-underskal, en 6s2 4f14 5d10 valensskalkonfiguration og i alt 80 elektroner. (Du skal altid kontrollere, at det samlede antal elektroner er lig med atomnummeret.)
Ovelse 2.2.3
Og selv om grundstof 114 ikke er stabilt nok til at forekomme i naturen, blev to isotoper af grundstof 114 for første gang skabt i en atomreaktor i 1999 af et hold af russiske og amerikanske forskere. Skriv den fuldstændige elektronkonfiguration for grundstof 114.
Svar: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p2
Elektronkonfigurationerne for grundstofferne er vist i figur 2.2.3, som viser orbitalerne i den rækkefølge, hvori de er fyldt. I flere tilfælde er grundtilstandens elektronkonfigurationer forskellige fra dem, der forudsiges af figur 2.2.1. Nogle af disse anomalier opstår, når 3d-orbitalerne fyldes. For eksempel er den observerede elektronkonfiguration i grundtilstanden for chrom 4s1 3d5 i stedet for den forudsagte 4s2 3d4. På samme måde er den observerede elektronkonfiguration for kobber 4s1 3d10 i stedet for s2 3d9. Den faktiske elektronkonfiguration kan rationaliseres i form af en ekstra stabilitet i forbindelse med en halvfyldt (ns1, np3, nd5, nf7) eller fyldt (ns2, np6, nd10, nf14) underskal. I betragtning af de små forskelle mellem højere energiniveauer er denne ekstra stabilitet nok til at flytte en elektron fra en orbital til en anden. I tungere grundstoffer kan andre mere komplekse virkninger også være vigtige, hvilket fører til nogle af de yderligere anomalier, der er angivet i figur 2.2.3. For eksempel har cerium en elektronkonfiguration på 6s2 4f1 5d1, som er umulig at rationalisere i enkle vendinger. I de fleste tilfælde har disse tilsyneladende anomalier dog ikke vigtige kemiske konsekvenser.
Note
Den ekstra stabilitet er forbundet med halvfyldte eller fyldte delskaller.