Vattens egenskaper
En av de saker som gör vår planet speciell är förekomsten av flytande vatten. Vatten är grundläggande för allt liv; utan det skulle alla levande varelser dö.
Vatten täcker cirka 70 % av jordens yta och utgör 65-75 % av våra kroppar (82 % av vårt blod består av vatten). Även om vatten kan verka tråkigt – utan färg, smak eller lukt – har det fantastiska egenskaper som gör det nödvändigt för att upprätthålla livet.
(Vårt behov av vatten och de havsdjur som lever i vatten är det som gör oljeutsläpp så skadliga.)
Vattnets kemiska sammansättning är H2O – två väteatomer och en syreatom. Vattnets egenskaper är speciella på grund av hur dess atomer binder ihop till en vattenmolekyl och hur molekylerna interagerar med varandra.
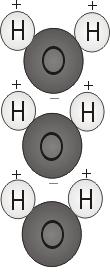
Vattens polaritet
När de två väteatomerna binder ihop sig med syret fäster de på toppen av molekylen ungefär som Musse Pigg-öron. Denna molekylstruktur ger vattenmolekylen polaritet, eller en skev elektrisk laddning som drar till sig andra atomer.
Molekylens ände med de två väteatomerna är positivt laddad. Den andra änden, med syret, är negativt laddad. Precis som i en magnet, där nordpoler dras till sydpoler (”motsatser dras till varandra”), kommer den positiva änden av vattenmolekylen att ansluta sig till den negativa änden av andra molekyler.
Vad betyder detta för oss? Vattens polaritet gör att det mycket lätt kan lösa upp andra polära ämnen. När ett polärt ämne läggs i vatten dras de positiva ändarna av dess molekyler till de negativa ändarna av vattenmolekylerna, och vice versa. Attraktionerna gör att molekylerna i det nya ämnet blandas jämnt med vattenmolekylerna.
Vatten löser upp fler ämnen än någon annan vätska – till och med den starkaste syran! På grund av detta kallas det ofta för det ”universella lösningsmedlet”. Vattnets upplösningsförmåga är mycket viktig för livet på jorden. Vart än vatten går bär det med sig upplösta kemikalier, mineraler och näringsämnen som används för att stödja levande varelser.
På grund av sin polaritet dras vattenmolekylerna starkt till varandra, vilket ger vatten en hög ytspänning. Molekylerna på vattenytan ”klibbar ihop” och bildar en slags ”hud” på vattnet som är tillräckligt stark för att bära upp mycket lätta föremål. Insekter som går på vatten utnyttjar denna ytspänning.
Ytesspänningen gör att vatten klumpar ihop sig i droppar i stället för att spridas ut i ett tunt lager.
Det gör också att vatten kan röra sig genom växters rötter och stjälkar, termometrar och de minsta blodkärlen i din kropp. När en molekyl rör sig uppåt ”drar” den med sig de andra.
Tre ämnestillstånd
Vatten är ett av fyra grundämnen och det enda naturliga ämne som kan existera i alla tre ämnestillstånden – fast, flytande och gas – vid de temperaturer som normalt finns på jorden.
Många andra ämnen måste överhettas eller -kylas för att byta tillstånd.
Vattens gasformiga tillstånd finns ständigt i vår atmosfär som vattenånga. Det flytande tillståndet finns överallt i floder, sjöar och hav.
Vattens fasta tillstånd, is, är unikt. De flesta vätskor drar ihop sig när de kyls, eftersom molekylerna rör sig långsammare och har mindre energi för att motstå attraktion till varandra. När de fryser till fasta ämnen bildar de tätt packade kristaller som är mycket tätare än vad vätskan ursprungligen var.
Vatten beter sig inte på detta sätt. När det fryser expanderar det: molekylerna ställer sig på rad och bildar en mycket ”öppen” kristallstruktur som är mindre tät än flytande vatten.
Detta är anledningen till att is flyter. Och det är bra att den gör det! Om vatten skulle bete sig som de flesta andra vätskor skulle sjöar och floder frysa fast och allt liv i dem skulle dö.
Tre andra egenskaper hos vatten
Vatten har en hög specifik värme. Det vill säga, till skillnad från luft kan vatten absorbera mycket värme utan att ändra temperatur. Det är därför simning känns så uppfriskande en varm dag.
Vatten förlorar också värme långsammare än luft. Resultatet är att sjö- och havsvatten på sommaren vanligtvis är kallast tidigt på säsongen och varmast sent på säsongen (efter att ha absorberat solens energi i många dagar).
Vattens kokpunkt (212° F eller 100°C på havsnivå) påverkas av höjden. I allmänhet gäller att ju högre höjd desto lägre är vattnets kokpunkt. I Denver, CO (5 280 fot) kokar vattnet till exempel vid 202,4° F. På Mount Everest i Nepal (29 012 fot) kokar vattnet vid 156° F.
Vattenvetenskapliga projekt:
- Vattnets kretslopp
- Vattenhjulet
- Superkylt vatten
- Vattenbehållare
- Vattenbehållare