Atomer kan få eller förlora elektroner för att bilda joner i en process som kallas jonisering (föreningar som bildas på detta sätt kallas joniska föreningar). När joniska föreningar löses upp i vatten separeras deras joner från varandra i en process som kallas dissociation. En intressant egenskap hos vatten och många andra kovalenta föreningar är att även de kan dissociera till joner. Till skillnad från joniska föreningar, till exempel natriumklorid, joniseras de inte innan de dissocieras, utan de åstadkommer jonisering och dissociation samtidigt.
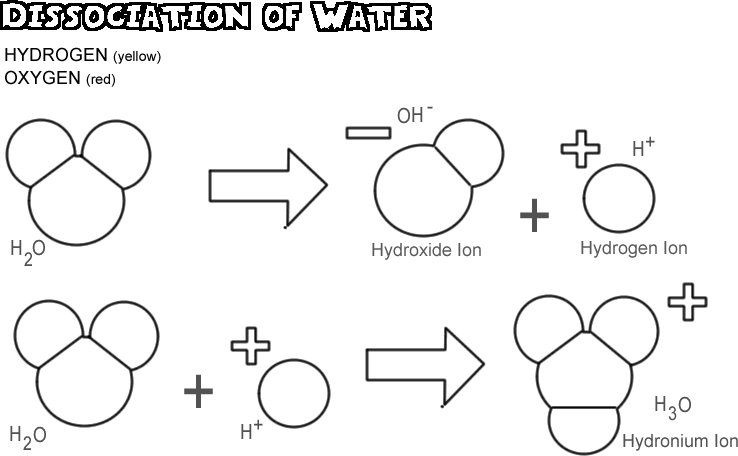
Vattens dissociation
När vatten dissocieras lämnar en av vätekärnorna sin elektron bakom sig tillsammans med syreatomen för att bli en vätejon, medan syre- och de andra väteatomerna blir en hydroxidjon. Eftersom vätejonen inte har någon elektron som neutraliserar den positiva laddningen på dess proton har den en hel enhet positiv laddning och symboliseras som H+. Hydroxidjonen behåller den elektron som lämnats kvar och har därför en hel enhet av negativ laddning och symboliseras med OH-. Vätejonen (proton) vandrar inte länge av sig själv innan den fäster vid syreatomen i en andra ojoniserad vattenmolekyl för att bilda en hydroniumjon (H3O +)
I varje vattenprov är det mycket få av molekylerna som dissocieras vid varje tillfälle: i själva verket bara ungefär en på 550 miljoner. Det sker dock en ständig förändring; när en vätejon återfäster en hydroxidjon för att bilda en vattenmolekyl, dissocieras en annan vattenmolekyl för att ersätta vätejonen och hydroxidjonen i lösningen.
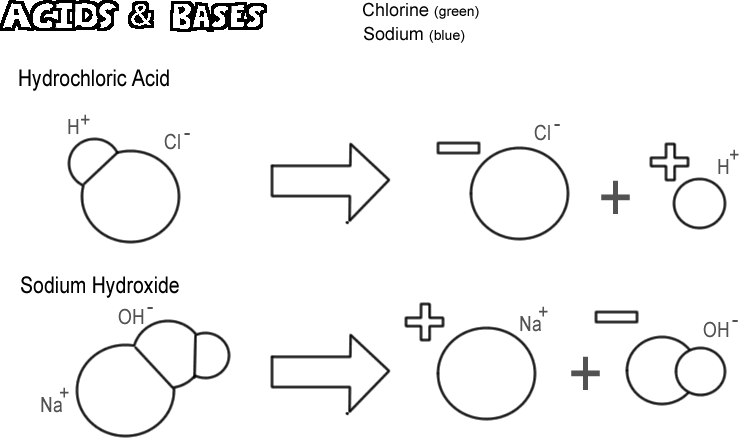
Hydrochloridsyra
Vissa molekyler, joniska och kovalenta, dissocieras på ett sådant sätt att de frigör en vätejon utan att frigöra en hydroxidjon. Dessa ämnen kallas syror. Eftersom en vätejon egentligen bara är en enda proton i de flesta fall är kemistens definition av en syra en ”protongivare”. Om väldigt många protoner (vätejoner) ”doneras” kan effekten bli mycket djupgående, t.ex. att huden bränns eller att metall löses upp. Den syra som illustreras är saltsyra. Ren saltsyra är en gas, men den löser sig lätt i vatten för att ge en lösning av vätejoner och kloridjoner. Eftersom nästan all den löses upp i vatten kallas den för en stark syra. Syror som inte dissocieras fullständigt kallas för svaga syror.
Natriumhydroxid
Motpolen till en syra är en bas, även kallad alkali. En typisk stark bas är natriumhydroxid, huvudkomponenten i lut. Natriumhydroxid dissocieras för att bilda en natriumjon och en hydroxidjon. En bas definieras som en ”protonmottagare”. De vanligaste baserna producerar hydroxidjoner när de dissocierar, och det är hydroxidjonen som accepterar protonerna. En stark bas kan ge din hud en mycket värre brännskada än en syra.
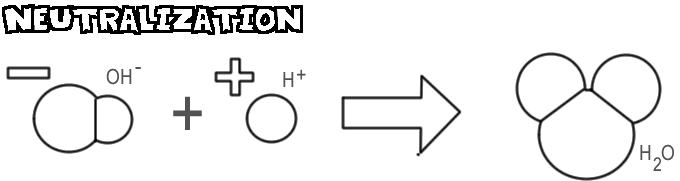
Neutralisering
När en bas och en syra blandas kombineras hydroxidjonen och basen med vätejonen från syran för att bilda vatten. Denna process kallas för neutralisering.
Frågor:
1. Vad händer när en atom får eller förlorar en elektron?