Vi är alla mutanter. Varje egenskap som definierar vår art är resultatet av en genetisk mutation någonstans i evolutionens historia. Och detsamma gäller för alla andra organismer på planeten. Ändå tänker vi oftast på mutationer som något dåligt, som leder till handikapp eller sjukdom. Så hur ofta är dessa förändringar i DNA skadligt och hur många av dem är potentiellt nyttiga? En ny studie tyder på att dödliga mutationer kan vara mycket mindre vanliga än vi tidigare trott, åtminstone hos bakterier.
De flesta DNA-mutationer orsakas av misstag som sker när en cell gör en kopia av all sin genetiska information så att den kan dela sig i två nya celler. Bakterier som E. coli måste kopiera omkring fem miljoner bokstäver i DNA-koden. För människor handlar det om cirka 3,2 miljarder DNA-bokstäver i ägg och sperma, och dubbelt så många i andra kroppsceller.
Trots sofistikerade system för att upptäcka och reparera kopieringsfel när de inträffar, så glider några ibland igenom nätet. De flesta resulterar i vad som kallas ”punktmutationer”, eftersom de innebär att bara en enda DNA-bokstav ändras. Men även dessa kan ibland leda till stora förändringar och förändra gener och de proteiner de producerar. Detta kan i sin tur påverka hur kroppen växer eller fungerar.
Mutationer kan driva på evolutionen, om de ger en individ en fördel som innebär att de har större chans att överleva och få barn och föra den muterade genen vidare. Chansen att slumpmässiga mutationer i miljontals eller miljarder bokstäver i koden är fördelaktiga kan tyckas liten. Men livet på jorden har funnits i fyra miljarder år, så evolutionens tidsskalor är enorma.
Mellertid kan mutationer också orsaka allvarliga hälsoproblem, varav en del också kan vara ärftliga. Forskare i Frankrike försökte nyligen ta reda på hur ofta mutationer faktiskt är skadliga, med E. coli-bakterier som modell. Lydia Roberts och hennes kollegor använde en genial teknik som gjorde det möjligt för dem att visualisera DNA-förändringar som skedde medan bakterierna faktiskt delade sig.
Det vanliga sättet att uppskatta mutationsfrekvensen hos bakterier innebär att man odlar dem på agarplattor, plastskålar som innehåller en näringsrik gelé för mikrober. Men problemet med detta tillvägagångssätt är att alla bakterier som får en dödlig mutation uppenbarligen dör, så information om dessa genetiska förändringar går permanent förlorad.
För att komma runt detta använde de franska forskarna ett litet chip som innehåller 1 000 mikroskopiska kanaler, i vilka flytande näringsbuljong levereras. Nya celler som produceras efter varje celldelning stannar kvar i kanalerna, oavsett skadliga mutationer som kan påverka deras överlevnad.
Teamet använde sig sedan av tidsförloppsbilder i kombination med en fluorescerande markör som blinkade varje gång en mutation inträffade. Detta gav imponerande videor av de förökande, muterande bakterierna som påminner om de kodrader som porträtteras i sci-fi-filmen The Matrix.
Resultaten, som publiceras i Science, tyder på att punktmutationer i bakterier uppkommer i en konstant takt på ungefär en var 600:e timme. Till forskarnas förvåning upptäckte de också att endast cirka 1 % av dessa DNA-förändringar var dödliga för bakterierna – mycket färre än man tidigare trott.
Det verkar som om de flesta mutationer, åtminstone i bakterier, inte har någon effekt på överlevnaden överhuvudtaget. De är varken ”dåliga” eller ”goda”, utan helt enkelt evolutionära åskådare. Forskare som arbetar med att förstå hur genetiska mutationer orsakar sjukdomar hos människor ställer sig liknande frågor. Resultaten från stora projekt som det brittiska 100 000 Genomes-projektet bör bidra till att avslöja vilka mutationer som orsakar sjukdom och vilka som inte har någon betydelse.
Bortom bra och dåligt
Men vi vet också att det ibland kan vara mycket svårt att kategorisera mutationer som bra eller dåliga. Ofta beror det på sammanhanget, till exempel om mutationen hjälper organismen att använda en viss födokälla eller bekämpa en sjukdom som förekommer under dess livstid. Och vissa mutationer kan vara fördelaktiga om bara en kopia ärvs, men skadliga om två kopior ärvs. Ett exempel på en genmutation som är föremål för denna typ av ”balanserande urval” är sicklecellsjukdom.
Personer med sicklecellsjukdom har en genmutation som ger upphov till en förändrad form av hemoglobin, det protein i röda blodkroppar som transporterar syre runt i kroppen. Det förändrade hemoglobinet ger långa sickleformade blodkroppar som kan fastna i små blodkärl. Detta orsakar smärta i bröstet och lederna samt blodbrist, ökad risk för infektioner och andra problem.
Men trots dessa potentiellt förödande hälsoeffekter är sjukdomen relativt vanlig i vissa länder. Uppskattningsvis 300 000 spädbarn som ärver två kopior av genmutationen sickle-cell (en från varje förälder) föds med sjukdomen varje år, främst i Nigeria, Demokratiska republiken Kongo och Indien.
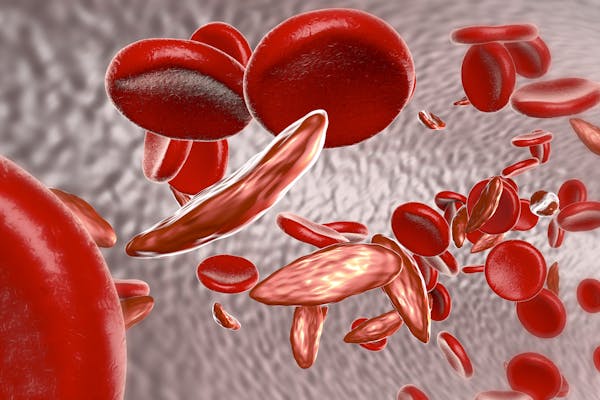
Detta beror på att personer med en kopia av mutationen är resistenta mot malaria och har därför större chans att överleva till vuxen ålder och föra den muterade genen vidare till sina barn. Så även om det är en evolutionär nackdel att ha sicklesjuka har icke drabbade bärare av genmutationen en överlevnadsfördel i länder där malaria var (eller fortfarande är) vanligt förekommande.
En färsk amerikansk studie tyder på att alla människor som lever med sicklesjuka i dag härstammar från en enda förfader som levde för cirka 7 300 år sedan i antingen Sahara eller väst-centrala Afrika. Detta visar hur en enskild mutation kan spridas till många, många individer i en population om den ger en betydande fördel, även om den också har potential att göra skada. På samma sätt finns det bevis för att en enda kopia av mutationen i cystisk fibrosis-genen kan ha gett våra förfäder resistens mot kolera, och att bärare av Tay-Sachs-sjukdomen har tuberkulosresistens.
En bättre förståelse för effekterna av mutationer skulle kunna spela en stor roll i behandlingen av sjukdomar. Att studera mutationsfrekvensen i olika celltyper skulle till exempel kunna kasta ljus över hur cancer uppstår i olika kroppsvävnader. Och att förstå bakteriella mutationshastigheter skulle kunna hjälpa forskare att bekämpa mikrober som har utvecklat resistens mot antibiotika. Detta kommer så småningom att bidra till att inleda en ny era inom medicinen, där många sjukdomar kommer att kunna diagnostiseras och behandlas med hjälp av genetisk information. Och det måste vara bra.