J Cancer 2020; 11(6):1341-1350. doi:10.7150/jca.40817
Forskningsrapport
Amy C. Moreno1, Yan Heather Lin2, Isabelle Bedrosian3, Yu Shen2, Gildy V. Babiera3, Simona F. Shaitelman1 ![]()
1. Department of Radiation Oncology, The University of Texas MD Anderson Cancer Center, Houston, TX.
2. Department of Biostatistics, The University of Texas MD Anderson Cancer Center, Houston, TX.
3. Department of Surgical Oncology, The University of Texas MD Anderson Cancer Center, Houston, TX.
Moreno AC, Lin YH, Bedrosian I, Shen Y, Babiera GV, Shaitelman SF. Resultat efter behandling av metaplastisk kontra andra bröstcancer-subtyper. J Cancer 2020; 11(6):1341-1350. doi:10.7150/jca.40817. Available from https://www.jcancer.org/v11p1341.htm
Syfte: Metaplastisk bröstcancer (BC) är en ovanlig men aggressiv histologisk subtyp av BC. Vi försökte identifiera faktorer som är förknippade med dess diagnos och jämföra hanteringen och resultaten av metaplastisk BC med dem av annan BC och trippelnegativt invasivt duktalt karcinom i synnerhet med tanke på hur ofta den har en trippelnegativ fenotyp.
Patienter och metoder: Vi identifierade kvinnor som diagnostiserats med invasiv BC 2010-2014 i National Cancer Data Base och använde univariat analys för att jämföra baslinjepatient- och tumörkarakteristika per BC-subtyp. Den totala överlevnaden (OS) uppskattades med Kaplan-Meier-metoden, och multivariata Cox proportional hazard-modeller användes för att identifiera oberoende prediktorer för OS.
Resultat: Av 247 355 fall var 2 084 (0,8 %) metaplastiska BC, 55 998 (23 %) trippelnegativa BC och 77 % andra BC. I förhållande till icke-metaplastisk BC var kvinnor med metaplastisk BC mer benägna att vara äldre vid diagnosen (medianålder, 62 vs 59 år), ha ≥1 komorbida tillstånd (22 % vs 18 %) och vara på Medicare (41 % vs 33 %; P<0,001). Metaplastiska BC tenderade att vara basalliknande (77 %), och i förhållande till trippelnegativa eller andra BC var metaplastiska BC förknippade med högre klinisk T-status (cT3-4, 18 % vs. 11 %, 8 %), ingen klinisk nodal inblandning (cN0, 86 %, 77 %, 80 %), ingen lymfkärlsinvasion (72 %, 65 %, 62 %) och höggradiga tumörer (71 %, 77 %, 35 %) (P<0,001). De flesta metaplastiska BC behandlades med mastektomi (58 %), sentinell lymfkörteldissektion (65 %), bestrålning av bröstvägg eller bröst (74 %) och kemoterapi (75 %) som adjuvant behandling (60 %). Vid en medianuppföljningstid på 44,5 månader var OS-frekvensen lägre för metaplastisk BC än för trippelnegativ eller annan BC i alla kliniska stadier efter 5 år (stadium I, 85 %, 87 %, 91 %; II, 73 %, 77 %, 87 %; III, 43 %, 53 %, 75 %) och efter 3 år (stadium IV, 15 %, 22 %, 64 %; P<0,001). Vid multivariat analys var stigande ålder, avancerat kliniskt stadium, lymfovaskulär invasion, axillär (vs. sentinel) noddissektion och ingen strålning eller kemoterapi förknippade med sämre resultat i metaplastisk BC. Omfattningen av kirurgi påverkade överlevnaden för trippelnegativa och andra BC men inte för metaplastiska BC.
Slutsats: Resultaten för metaplastiskt BC fortsätter att vara sämre än för andra BC-subtyper trots moderna behandlingar. Optimering av systemiska behandlingsalternativ, som var en betydande prediktor för överlevnad, bör prioriteras vid hantering av metaplastisk BC.
Nyckelord: metaplastisk bröstcancer, trippelnegativ bröstcancer, resultat av bröstcancer, strålbehandling, kemoterapi.
Introduktion
Om bröstcancer är den vanligaste cancerdiagnosen som drabbar kvinnor, med mer än 268 000 dokumenterade fall per år, utgör metaplastisk bröstcancer (BC) mindre än 1 %-2 % av alla bröstcancerfall. Kliniskt visar sig metaplastisk bröstcancer som en snabbt växande bröstmassa med komplex ekogenicitet (dvs. solida och cystiska komponenter) på ultraljud och en massa med hög densitet på mammografi. Histologiskt består metaplastisk BC av en heterogen population av tumörer som kan klassificeras genom förekomsten av icke-glandulära eller mesenkymala celltyper eller genom ytterligare kategorisering i subtyper beroende på förekomsten av olika kännetecken som osteoklastiska jätteceller eller spindelceller.
Vid presentationen är graden av klinisk lymfkörtelinblandning vid metaplastisk BC vanligtvis låg. Metaplastisk BC diagnostiseras dock oftare i avancerade kliniska stadier på grund av större primära tumörer jämfört med andra BC och förknippas med högre grad av kemoresistens, fjärrmetastasering och sämre total överlevnad (OS). Metaplastisk BC har en särskilt hög prevalens av trippelnegativ receptorstatus eller avsaknad av östrogenreceptor, progesteronreceptor och amplifiering av human epidermal tillväxtfaktorreceptor 2 (HER2). Utan målinriktade proteiner är metaplastisk BC fortfarande en utmaning att behandla. Prospektiva data är begränsade för att välja den bästa behandlingen för metaplastisk BC med tanke på att diagnosen är sällsynt. I stället har en stor del av den nuvarande vårdstandarden för metaplastisk BC extrapolerats från resultat från små serier eller fallrapporter från en enda institution. Vi använde därför National Cancer Data Base (NCDB), som omfattar cirka 70 % av alla diagnostiserade cancerfall i USA, för att utvärdera egenskaper, hantering och resultat baserat på behandling och tumöregenskaper hos patienter med metaplastisk BC jämfört med patienter med trippelnegativ BC och alla andra BC-subtyper. Vi använde också multivariat analys för att identifiera oberoende prediktorer för överlevnad för kvinnor med metaplastisk BC.
Datakälla och kohortval
NCDB är ett gemensamt projekt som inrättades 1989 av Commission on Cancer of the American College of Surgeons och American Cancer Society, och som har samlat in onkologiska data från cirka 1500 ackrediterade inrättningar i USA, med totalt över 34 miljoner poster. Tillgänglig patientinformation är avidentifierad och är därför undantagen från den institutionella granskningsnämndens övervakning av skyddet av människor.
De urvalskriterier som användes för denna studie beskrivs i figur 1. Kvinnor i åldern 18 år och äldre som fick diagnosen invasiv bröstcancer mellan 2010 och 2014 inkluderades. Patienter med okänd hormonreceptorstatus (östrogen och progesteron) (HR) exkluderades. Ytterligare skäl till uteslutning var saknad information om kirurgi, kemoterapi eller klinisk stadieindelning enligt American Joint Committee On Cancer (AJCC) 6:e eller 7:e upplagan. Patienterna stratifierades sedan i tre grupper: 1-metaplastisk BC (med histologikoderna 8575 eller 8573), 2- trippelnegativ BC (TNBC, som endast omfattade icke-metaplastiska histologier) och 3-alla andra återstående typer av BC. Termen ”icke-metaplastisk BC” användes för att hänvisa till trippelnegativ BC och annan BC tillsammans.
CONSORT-diagram. BC, bröstcancer.
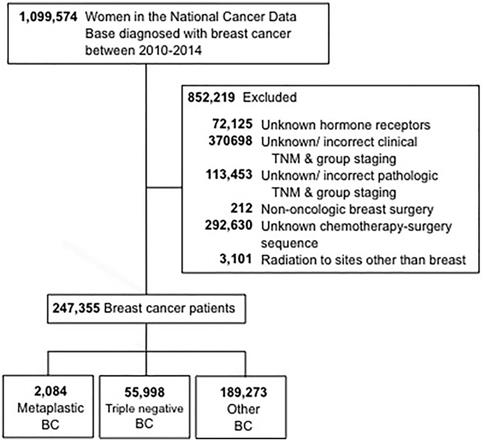 (Klicka på bilden för att förstora den.)
(Klicka på bilden för att förstora den.)
Variabler
Information som erhållits och analyserats från NCDB omfattade patientens ålder vid diagnosen, diagnosår, ras, Charlson/Deyo komorbiditetsindex, sjukförsäkringsstatus, medianhushållsinkomst och typ av behandlande inrättning (dikotomiserat i akademisk/forskningsmässig kontra icke-akademisk). Klinikopatologiska egenskaper omfattade AJCC:s kliniska T- och N-beteckning (nodal), övergripande klinisk AJCC-stadiegrupp, HR-status, HER2-receptorstatus, tumörgrad och lymfkärlsinvasion (LVSI). Molekylära subtyper definierades som HR(+)/HER2(-), HER2(+), trippelnegativ (östrogenreceptor(-), progesteronreceptor(-), HER2(-)) eller okänd. Patienter med metaplastisk BC med trippelnegativ receptorstatus betecknades som tn-metaplastisk BC för att skilja dem från icke-metaplastisk TNBC. Den primära behandlingen omfattade kirurgi (antingen bröstbevarande, mastektomi eller ingen), strålbehandling med eller utan inkludering av regional nodal bestrålning, användning av kemoterapi (neoadjuvant, adjuvant eller ingen) och hormonbehandling. Kirurgisk behandling av axillan definierades som antingen en axillär noddissektion (ALND), med 10 lymfkörtlar eller mer borttagna, eller en sentinell lymfkörteldissektion (SLND), när <10 lymfkörtlar avlägsnades.
Statistisk analys
Univariabel analys användes för att utvärdera potentiella associationer mellan demografiska, tumörmässiga och kliniska egenskaper och en diagnos av metaplastisk BC, med hjälp av chi-två-test för kategoriska variabler och t-test/variansanalys eller deras motsvarigheter till de icke-parametriska metoderna (Wilcoxon rank-summa eller Kruskal-Wallis) för kontinuerliga variabler. OS definierades som tiden från tidpunkten för diagnos till dödstillfället. OS-tiden för de överlevande patienterna var högercensurerad vid tidpunkten för den sista kontakten. Fördelningen av OS uppskattades med Kaplan-Meier-metoden. Log-rank-testet användes för att testa skillnaden i överlevnad mellan grupperna. Regressionsanalyser av överlevnadsdata baserade på Cox proportional hazard-modellen utfördes på OS. En multivariat Cox proportional hazard-modell erhölls genom att först inkludera en första uppsättning kandidatprediktorvariabler med ett P-värde < 0,05 i den univariata analysen. Stegvis bakåtriktad eliminering användes sedan, med 0,05 som signifikansnivå för Wald chi-square för att en effekt ska stanna kvar i modellen.
Överlevnadsanalyser genomfördes inom var och en av cancertyperna separat.
Habilitetens placering och typ ingick inte i urvalet av modellen för metaplastisk BC, eftersom ingen av faktorerna var statistiskt signifikanta för denna grupp vid den univariata inställningen och data inte var fullt tillgängliga för patienter yngre än 40 år. För att undersöka om detaljer i systemisk terapi och strålningsleverans påverkade utfallet bland patienter med metaplastisk BC utförde vi undergruppsanalyser på denna kohort för att utvärdera det potentiella inflytandet av sekvensering av kemoterapi och omfattningen av strålningsmålen på OS. Alla tester var tvåsidiga och statistisk signifikans definierades som ett P-värde <0,05. SAS version 9.4 (SAS Institute, Cary, NC) och S-Plus version 8.2 (TIBCO Software Inc, Palo Alto, CA) användes för att utföra beräkningarna för alla analyser.
Kohort- och tumörkarakteristika
Vi identifierade 247 355 kvinnor med en diagnos av invasiv bröstcancer 2010-2014, av vilka 0,8 % (n=2 084) hade metaplastisk BC, 23 % (n=55 998) TNBC och 77 % (n=189 273) hade annan BC. Patienternas sociodemografiska, kliniska och patologiska tumöregenskaper och behandlingsegenskaper efter BC-typ visas i tabell 1. Medianåldern var 63 år (intervall 22-90) för kvinnor med metaplastiskt BC och 59 år (intervall 18-90) år för både TNBC och annat BC. Kvinnor med metaplastisk BC hade oftare en komorbiditetspoäng ≥1 (22 % vs. 18 % TNBC vs. 16 % annan BC) och hade offentlig försäkring (50 % vs. 42 % TNBC vs. 41 % annan BC) (alla P<0,001). Diagnosen metaplastisk BC eller TNBC var oftare förknippad med svart ras än annan BC (18 % vs. 21 % vs. 11 %, P<0,001).
Signifikanta skillnader i kliniskt sjukdomsstadium och tumördrag sågs per cancertyp. Metaplastisk BC diagnostiserades ofta i mer avancerade stadier, där endast 31 % av patienterna med metaplastisk BC hade kliniskt sjukdomsstadium I jämfört med 46 % av TNBC och 54 % av annan BC (P<0,001). Detta mönster tycktes korrelera med högre andel större tumörer i den metaplastiska BC-gruppen (cT3-4, 18 % jämfört med 11 % respektive 8 %), men förekomsten av klinisk nodal involvering var lägst för metaplastisk BC (cN1-3, 14 % jämfört med 23 % respektive 20 %) (alla P<0,001). I motsats till den kliniska nodala statusen var graden av patologisk nodal involvering något lägre för metaplastisk BC och TNBC, men fördubblades för annan BC (pN1-3, 18 % vs. 26 % vs. 40 %, respektive, P<0,001). När det gäller receptorstatus hade 77 % av den metaplastiska BC-gruppen tn-metaplastisk BC, vilket är 3,4 gånger högre än den icke-metaplastiska BC-gruppen (23 %), varav HR(+)/HER2(-) var den vanligaste molekylära subtypen med 59 % (P<0,001). Dessutom var endast 5 % av metaplastiska BC HER2(+) jämfört med 16 % av icke-metaplastiska BC. Både metaplastisk BC och TNBC hade nästan dubbelt så stor andel tumörer av grad 3 i förhållande till annan BC (71 %, 77 % respektive 35 %, P<0,001), och metaplastisk BC hade lägre andel LVSI i förhållande till TNBC och annan BC (13 %, 20 % respektive 24 %, P<0,001).
Patient- och behandlingsegenskaper.
| Karakteristik | Metaplastisk BC, nr (%) | Triple-Negative BC, nr (%) | Andra BC, nr. (%) | P-värde | |
|---|---|---|---|---|---|
| Medianålder, år (intervall) | 62 (22-90) | 59 (18-90) | 59 (18-90) | <0.001 | |
| Race | |||||
| White | 1623 (77.9) | 41791 (74.6) | 158406 (83.7) | <0.001 | |
| Svart | 368 (17.7) | 11771 (21) | 20722 (10.9) | ||
| Annat | 80 (3.8) | 2041 (3.6) | 8507 (4.5) | ||
| Okänd | 13 (0.6) | 395 (0.7) | 1638 (0.9) | ||
| Komorbiditetspoäng | |||||
| 0 | 1635 (78.5) | 45882 (81.9) | 158177 (83.6) | <0.001 | |
| 1 | 349 (16.7) | 8107 (14.5) | 25524 (13.5) | ||
| >=2 | 100 (4.8) | 2009 (3.6) | 5572 (2.9) | ||
| Medianinkomst | |||||
| <30 000 dollar | 251 (12) | 7110 (12.7) | 19154 (10.) | <0.001 | |
| $30,000-$34,999 | 332 (15.9) | 9081 (16.2) | 28472 (15) | ||
| $35,000-$45,999 | 580 (27.8) | 15084 (26.9) | 48845 (25.8) | ||
| $46,000+ | 858 (41.2) | 23050 (41.2) | 86637 (45.8) | ||
| Okänd | 63 (3) | 1673 (3) | 6165 (3.3) | ||
| Medicinsk försäkring | |||||
| Privat | 975 (46.8) | 30263 (54) | 105839 (55.9) | <0.001 | |
| Medicaid | 154 (7.4) | 4716 (8.4) | 13267 (7) | ||
| Medicare | 862 (41.4) | 18355 (32.8) | 61535 (32.5) | ||
| Övrigt | 19 (0.9) | 665 (1.2) | 2212 (1.2) | ||
| Oförsäkrad | 43 (2.1) | 1422 (2.5) | 4163 (2.2) | ||
| Okänd | 31 (1.5) | 577 (1) | 2257 (1.2) | ||
| Länstyp | |||||
| Storstadslän | 1720 (82.5) | 46252 (82.6) | 157058 (83) | 0.152 | |
| Urban | 271 (13) | 7456 (13.3) | 24367 (12.9) | ||
| Landsbygd | 43 (2.1) | 951 (1.7) | 3219 (1.7) | ||
| Okänd | 50 (2.4) | 1339 (2.4) | 4629 (2.4) | ||
| Inrättningstyp | |||||
| Akademisk | 668 (32.1) | 16117 (28.8) | 52120 (27.5) | <0.001 | |
| Icke-akademisk | 1318 (63.2) | 35472 (63.3) | 126101 (66.6) | ||
| Okänd | 98 (4.7) | 4409 (7.9) | 11052 (5.8) | ||
| Anläggningsort | |||||
| Midwest | 614 (29.5) | 14132 (25.2) | 46644 (24.6) | <0.001 | |
| Nordost | 410 (19.7) | 10411 (18.6) | 37787 (20) | ||
| Syd | 716 (34.4) | 20595 (36.8) | 66519 (35.1) | ||
| Väst | 246 (11.8) | 6451 (11.5) | 27271 (14.4) | ||
| Okänd | 98 (4.7) | 4409 (7.9) | 11052 (5.8) | ||
| Kliniskt sjukdomsstadium | |||||
| I | 639 (30.7) | 25843 (46.1) | 102257 (54) | <0.001 | |
| II | 1215 (58.3) | 23912 (42.7) | 70846 (37.4) | ||
| III | 201 (9.6) | 5579 (10) | 14283 (7.5) | ||
| IV | 29 (1.4) | 664 (1.2) | 1887 (1) | ||
| Klinisk T-status | |||||
| cT0 | 5 (0.2) | 131 (0.2) | 341 (0.2) | <0.001 | |
| cT1 | 674 (32.3) | 28452 (50.8) | 113113 (59.8) | ||
| cT2 | 1026 (49.2) | 21530 (38.4) | 61145 (32.3) | ||
| cT3 | 252 (12.1) | 3702 (6.6) | 10061 (5.3) | ||
| cT4 | 127 (6.1) | 2183 (3.9) | 4613 (2.4) | ||
| Klinisk N-status | |||||
| cN0 | 1787 (85.7) | 43357 (77.4) | 150890 (79.7) | <0.001 | |
| cN1 | 224 (10.7) | 9659 (17.2) | 30427 (16.1) | ||
| cN2 | 51 (2.4) | 1804 (3.2) | 5414 (2.9) | ||
| cN3 | 22 (1.1) | 1178 (2.1) | 2542 (1.3) | ||
| Patologiskt stadium | |||||
| 0 | 45 (2.2) | 4314 (7.7) | 5361 (2.8) | <0.001 | |
| 1 | 582 (27.9) | 24787 (44.3) | 81680 (43.2) | ||
| 2 | 1223 (58.7) | 20790 (37.1) | 72445 (38.3) | ||
| 3 | 210 (10.1) | 5675( 10.1) | 28323 (15) | ||
| 4 | 24 (1.2) | 432 (0.8) | 1464 (0.8) | ||
| Patologisk T-status | |||||
| pTis | 7 (0.3) | 432 (0.8) | 1862 (1) | <0.001 | |
| pT0 | 42 (2) | 4250 (7.6) | 3972 (2.1) | ||
| pT1 | 634 (30.4) | 29055 (51.9) | 106130 (56.1) | ||
| pT2 | 1017 (48.8) | 18530 (33.1) | 63484 (33.5) | ||
| pT3 | 290 (13.9) | 2540 (4.5) | 10588 (5.6) | ||
| pT4 | 93 (4.5) | 1097 (2) | 2892 (1.5) | ||
| pTX | 1 (0) | 94 (0.2) | 345 (0.2) | ||
| Patologisk N-status | |||||
| pN0 | 1705 (81.9) | 41587 (74.3) | 113787 (60.2) | <0.001 | |
| pN1 | 284 (13.6) | 9725 (17.4) | 51483 (27.2) | ||
| pN2 | 66 (3.2) | 3031 (5.4) | 16111 (8.5) | ||
| pN3 | 27 (1.3) | 1607 (2.9) | 7685 (4.1) | ||
| Receptorgruppering | |||||
| HR(+)/HER2(-)) | 334 (16) | 0 (0) | 143687 (75.9) | <0.001 | |
| Trippelnegativ | 1604 (77) | 55998 (100) | 0 (0) | ||
| HER2(+) | 97 (4.7) | 0 (0) | 38726 (20.5) | ||
| Okänd | 49 (2.4) | 0 (0) | 6860 (3.6) | ||
| Tumörgrad | |||||
| 1 | 41 (2) | 988 (1.8) | 32015 (16.9) | <0.001 | |
| 2 | 237 (11.4) | 9050 (16.2) | 80590 (42.6) | ||
| 3 | 1485 (71.3) | 42930 (76.7) | 65482 (34.6) | ||
| 4 | 37 (1.8) | 286 (0.5) | 438 (0.2) | ||
| Okänd | 284 (13.6) | 3030 (5.4) | 11186 (5.9) | ||
| LVSI | |||||
| Inte närvarande | 1505 (72.2) | 36400 (65) | 118082 (62.4) | <0.001 | |
| Förekommande | 263 (12.6) | 11091 (19.8) | 45681 (24.1) | ||
| Okänd | 316 (15.2) | 8507 (15.1) | 25510 (13.4) | ||
| Typ av operation | |||||
| BCS | 876 (42) | 29142 (52) | 92022 (48.6) | <0.001 | |
| Mastektomi | 1200 (57.6) | 26561 (47.4) | 95910 (50.7) | ||
| Ingen operation | 8 (0.4) | 295 (0.5) | 1341 (0.7) | ||
| Axillär kirurgi | |||||
| Ingen operation | 47 (2.3) | 1034 (1.8) | 4433 (2.3) | <.001 | |
| SLND | 1353 (64.9) | 34880 (62.3) | 109718 (58) | ||
| ALND | 666 (32) | 19229 (34.3) | 73181 (38.7) | ||
| Okänd | 18 (0.9) | 855 (1.5) | 1941 (1) | ||
| Strålebehandling | |||||
| Ja | 1087 (52.2) | 33938 (60.6) | 109268 (57.7) | <.001 | |
| Nej | 989 (47.5) | 21860 (39) | 79375 (41.9) | ||
| Okänd | 8 (0.4) | 200 (0.4) | 630 (0.3) | ||
| Stålningsmål | |||||
| Endast bröst/CW | 803 (73.9) | 24704 (72.8) | 72410 (66.3) | <0.001 | |
| Bröst/CW + Regionala noder | 284 (26.1) | 9234 (27.2) | 36858 (33.7) | ||
| Kemoterapi | |||||
| Ja | 1571 (75.4) | 44321 (79.1) | 133965 (70.8) | <0.001 | |
| Nej | 499 (23.9) | 11195 (20) | 53062 (28) | ||
| Okänd | 14 (0.7) | 482 (0.9) | 2246 (1.2) | ||
| Följning från kemoterapi till kirurgi | |||||
| Adjuvant | 1241 (59.5) | 31519 (56.3) | 116645 (61.6) | <0.001 | |
| Neoadjuvant | 324 (15.5) | 12581 (22.5) | 16717 (8.8) | ||
| Ingen | 519 (24.9) | 11898 (21.2) | 55911 (29.5) | ||
| Hormonbehandling | |||||
| Ja | 220 (10.6) | 1178 (2.1) | 103906 (54.9) | <0.001 | |
| Nej | 1798 (86.3) | 53274 (95.1) | 76820 (40.6) | ||
| Okänd | 66 (3.2) | 1546 (2.8) | 8547 (4.5) | ||
| Diagnosår | |||||
| 2010 | 309 (14.8) | 9605 (17.2) | 36712 (19.4) | <0.001 | |
| 2011 | 393 (18.9) | 11163 (19.9) | 38815 (20.5) | ||
| 2012 | 458 (22) | 11205 (20) | 39364 (20.8) | ||
| 2013 | 463 (22.2) | 11992 (21.4) | 37764 (20) | ||
| 2014 | 461 (22.1) | 12033 (21.5) | 36618 (19.3) |
Abkortningar: BC, bröstcancer; ALND, axillär lymfkörteldissektion; BCS, bröstbevarande kirurgi; CW, bröstvägg; HER2, human epidermal tillväxtfaktorreceptor; HR, hormonreceptor; LVSI, lymfkärlsinvasion; SLND, sentinell lymfkörteldissektion.
Behandling efter bröstcancertyp
De flesta patienter (99 %) genomgick onkologisk bröstkirurgi, inklusive kirurgisk utvärdering av axillan (97 %). Mastektomi användes oftare i den metaplastiska BC-gruppen (58 % vs 47 % TNBC vs 51 % annan BC, P<0,001), liksom SLND (65 % vs 62 % TNBC vs 58 % annan BC; P<0,001). Regional nodal bestrålning användes oftare som en del av behandlingen för andra BC än för metaplastiska BC och TNBC (26 %, 27 % respektive 34 %; P<0,001).
Med avseende på systemisk behandling användes neoadjuvant kemoterapi nästan dubbelt så ofta för metaplastiska BC och TNBC som för andra BC (16 %, 23 % respektive 9 %; P<0,001), och ungefär en fjärdedel av alla kvinnor fick ingen kemoterapi. Hormonbehandling användes minst ofta för TNBC (2 %) men ingick i behandlingsparadigmet för 11 % av metaplastiska BC och 55 % av övriga BC-fall.
Survival Analysis
Medianuppföljningstiden var 44,5 månader. Patienter med metaplastiskt BC hade signifikant sämre ojusterad OS oavsett kliniskt stadium (fig. 2). De uppskattade 5-års OS för patienter med metaplastisk BC, TNBC och andra BC-patienter med sjukdomsstadium I var 85 %, 87 % och 91 %; de för stadium II var 73 %, 77 % och 87 %; och de för stadium III var 43 %, 53 % och 75 % (P<0,001). 3 års OS-frekvensen för patienter med metastaserande sjukdom var 2-4 gånger högre för TNBC- och andra BC-grupper på 30 % och 64 % jämfört med 15 % för metaplastisk BC (P<0,001). Överlevnad efter molekylär subtyp analyserades också (fig. 3). Bland patienter med metaplastisk BC syntes inga skillnader i OS efter molekylär subtyp (HR(+)/HER2(-), HER2(+) eller tn-metaplastisk BC) (P=0,778). För icke-metaplastisk BC var däremot den trippelnegativa subtypen förknippad med sämre OS än HER+- och HR(+)/HER2(-)-subtyperna (P<0,001). Ras verkade inte heller ha något samband med överlevnad bland patienter med metaplastisk BC (5 års OS-frekvens 73 % för vita jämfört med 74 % för svarta, P=0,876), medan ras var förknippat med OS i både TNBC- (P<0,001) och andra BC-grupper (P<0,001; Fig. 4).
Genomsnittliga överlevnadskurvor för bröstcancertyper efter kliniskt stadium, med granskning av metaplastisk, trippelnegativ och annan bröstcancer. Förkortning: MBC, metaplastisk bröstcancer.
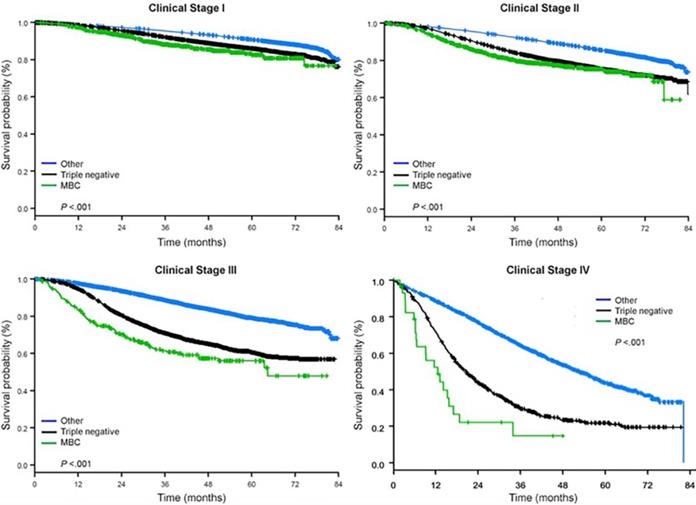 (Klicka på bilden för att förstora den.)
(Klicka på bilden för att förstora den.)
Allmänna överlevnadskurvor för patienter med metaplastisk och icke-metaplastisk bröstcancer stratifierade efter receptorstatus. Förkortningar: HER2, Human epidermal growth factor receptor 2; HR, hormonreceptor; MBC, metaplastisk bröstcancer.
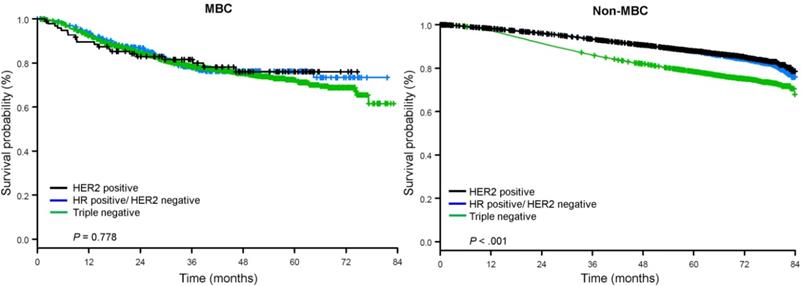 (Klicka på bilden för att förstora den.)
(Klicka på bilden för att förstora den.)
Överlevnadskurvor för patienter med metaplastisk, trippelnegativ och annan bröstcancer stratifierade efter ras. Förkortningar: (Klicka på bilden för att förstora den.)
Multivariabel analys av faktorer som är förknippade med total överlevnad för patienter med metaplastisk BC.
| Faktorer som är associerade med total överlevnad vid metaplastisk BC | ||||
|---|---|---|---|---|
| Variabel (referens) | Hasard Ratio (95% konfidensintervall) | P-värde | ||
| Ålder | Per år ökning | 1.024 (1.015-1.033) | <0.0001 | |
| Lymphovaskulär invasion (Ingen) | Present | 1.307 (1.017-1.679) | 0.0364 | |
| Klinisk N-status (cN0) | cN+ | 1.758 (1.328-2.326) | <0.0001 | |
| Klinisk T-status (cT1) | cT0 | 2.226 (0.301-16.447) | <0.0001 | |
| cT2 | 1.454 (1.102-1.918) | |||
| cT3 | 3.029 (2.183-4.204) | |||
| cT4 | 3.145 (2.124-4.657) | |||
| Klinisk M-status (cM0) | cM1 | 3.330 (2.020-5.488) | <0.0001 | |
| Axillär kirurgi (SLND) | ALND | 1.333 (1.065-1.670) | 0.0247 | |
| Ingen kirurgi | 1.538 (0.884-2.675) | |||
| Bestrålning (Nej) | Ja | 0.709 (0.572-0.878) | 0.0016 | |
| Kemoterapi (Nej) | Ja | 0.579 (0.446-0.752) | <0.0001 | |
Abkortningar: ALND, Axillary lymph node dissection; BC, bröstcancer; SLND, sentinel lymph node dissection.
I en multivariat analys korrelerade ökad ålder, högre klinisk T-klassificering, förekomst av klinisk nodal sjukdom eller LVSI och behandling med ALND med sämre utfall för patienter med metaplastisk BC, TNBC och annan BC (kompletterande tabell 1). Tillägg av kemoterapi och strålbehandling förbättrade båda oberoende av varandra OS oavsett bröstcancertyp. Andra patient- och tumöregenskaper som var förknippade med överlevnad i TNBC och annan BC, inklusive ras, komorbiditeter och tumörgrad, var inte förknippade med överlevnadsutfallet för metaplastisk BC vid multivariat analys.
Med tanke på det relativt dåliga utfallet bland patienter med metaplastisk BC gjordes subgruppsanalyser på gruppen metaplastisk BC för att bedöma om några behandlingsmodaliteter var förknippade med förbättrat utfall. Efter justering för nodal status (cN0 vs N+) var behandling med mer aggressiv axillär kirurgi (ALND vs SLND) förknippad med sämre utfall, ett fenomen som också sågs bland TNBC och andra BC (tabell 2). Bland dem som fick strålbehandling påverkade behandling med regional nodal bestrålning jämfört med enbart bröst- eller bröstväggsbestrålning inte utfallet signifikant bland patienter med metaplastisk BC (P=0,077 och 0,200 för klinisk N0 respektive N+). Mottagande av neoadjuvant kemoterapi var förknippat med sämre resultat än adjuvant kemoterapi bland patienter med kliniskt nodnegativ metaplastisk BC (HR 1,9, 95 % CI 1,3-2,6, P<0.001), men inte för dem med kliniskt nodpositiv metaplastisk BC (P=0,43).
Diskussion
Metaplastisk bröstcancer är en sällsynt men ändå särskilt aggressiv form av bröstcancer, särskilt om man jämför med andra brösttumör-subtyper. Denna sjukdomsenhet har varit relativt underrepresenterad i litteraturen. En omfattande sökning av Rayson et al. av publikationer från 1966 till 1997 gav sammanlagt endast 27 fall. Stora nationella databaser som NCDB är fördelaktiga för att studera sällsynta cancerformer som metaplastisk BC. Incidensen av metaplastisk BC-diagnos i Förenta staterna enligt dessa databaser är dock fortfarande låg med mindre än 500 fall per år. I vår studie fann vi att metaplastisk BC oftast diagnostiserades som en stor tumör med negativa riskegenskaper såsom dåligt differentierad tumörgrad och trippelnegativ receptorstatus. Patienter med metaplastisk BC hade signifikant sämre överlevnad oavsett stadium vid presentationen jämfört med trippelnegativ och annan BC. Mottagande av kemoterapi och strålbehandling var oberoende prediktorer för bättre OS, men sekvenseringen av kemoterapi verkade påverka resultaten, särskilt för patienter med metaplastisk BC utan klinisk nodal inblandning, med erkännande av att en del av dessa patienter hade patologisk nodal inblandning. Våra resultat kan dock återspegla potentiell heterogenitet i de underliggande biologiska mekanismerna som driver svaren på behandlingar i denna speciella grupp av BC-patienter och belyser behovet av bättre riskstratifiering och systemiska terapialternativ för att förbättra resultaten.
Och även om de flesta metaplastiska BC har en trippelnegativ fenotyp, verkar beteendet hos metaplastiska BC vara unikt jämfört med andra TNBC. TNBC tenderar att ha en sämre prognos än andra typer av BC, och uppfattningen att metaplastiskt BC är mer aggressivt än TNBC har bekräftats av flera mindre, retrospektiva undersökningar. Sådana studier har visat liknande mönster av diagnos i avancerade stadier för metaplastisk BC jämfört med TNBC, på grund av högre andel cT3-4-sjukdom snarare än nodal involvering, och i en granskning av 46 fall av metaplastisk BC från en enda institution hade patienter med metaplastisk BC en signifikant högre risk för lokalt sjukdomsrecidiv (30 % jämfört med 15 %; P=0,004). Dessa egenskaper korrelerade i slutändan med sämre 5 års sjukdomsfri överlevnad (30 % vs. 90 %; P<0,001) och OS (65 % vs. 87 %; P=0,002) för patienter med metaplastisk BC i förhållande till TNBC. En Surveillance Epidemiology and End Results-studie av 1 1112 patienter med metaplastisk BC visade också sämre cancerspecifik överlevnad efter 3 år för metaplastisk BC än för TNBC (78 % vs. 84 %). Vid undersökning av tn-metaplastisk BC fann Li et al. sämre sjukdomsfri överlevnad (HR 1,48, 95 % CI 1,19-1,84, P<0,01) och OS (HR 1,42 ; P<0,01) för tn-metaplastisk BC jämfört med TNBC. Vår studie, som inkluderade en av de största grupperna av patienter med metaplastisk BC hittills (n=2 084), förstärker dessa resultat och belyser att receptorstatus inte är en oberoende prediktor för överlevnad för metaplastisk BC (P=0.778) som den är för icke-metaplastisk BC.
En kritisk terapeutisk komponent som är förknippad med förbättrade resultat för alla metaplastiska BC-patienter i vår studie var användningen av kemoterapi (HR 0,58, 95 % CI 0,45-0,75, P<0,001). Vår rapport är den första såvitt vi vet som rapporterar om utfallet för metaplastisk BC baserat på sekvensering av kemoterapi. Påfallande nog visade vår subanalys att för patienter med cN0 metaplastisk BC i synnerhet var neoadjuvant kemoterapi förknippad med sämre OS jämfört med adjuvant kemoterapi (HR 1,88, 95 % KI 1,34-2,64, P<0,001), medan sekvensering av kemoterapi inte hade någon effekt på kliniskt node-positiv metaplastisk BC. En möjlig förklaring till detta kan vara att våra patienter med metaplastisk BC hade högre klinisk T-status, vilket i andra rapporter har förknippats med lägre andel patologiskt fullständigt svar och därefter sämre överlevnadsresultat. Dessutom kan kliniska stadieindelningsmetoder (dvs. enbart fysisk undersökning, införlivande av ultraljud) införa heterogenitet i en klinisk N0-population genom att missa verklig nodal sjukdomsbörda, vilket i sig kan förknippas med sämre resultat. Sammantaget har metaplastisk BC svar på neoadjuvant kemoterapi rapporterats vara så lågt som 18 %, vilket är mycket lägre än kända svarsfrekvenser för TNBC på antracyklin- och taxanbaserade kemoterapiregimer.
Baserat på den sämre överlevnaden och den relativt snabba utvecklingen av fjärrmetastatisk spridning jämfört med andra bröstcancersubtyper som noterats i vår studie och i andra rapporter, är behovet av bättre systemiska behandlingsalternativ klart uppenbart för metaplastisk BC. Transkriptionsprofilering har visat att denna cancersubtyp uppvisar en tumörigen signatur med stamcellsliknande egenskaper, frekventa avvikelser i PI3K/AKT/mTOR-vägen och överuttryck av vaskulär endotelisk tillväxtfaktor (VEGF). Dessa egenskaper liknar dem som finns i mesenkymala TNBC. Det pågår lovande insatser för att identifiera alternativa systemiska behandlingsregimer för dessa patienter, inklusive en nyligen genomförd fas I-studie som visade förbättrade objektiva svarsfrekvenser för liposomalt doxorubicin, bevacizumab (monoklonal antikropp mot VEGF-A) och everolimus (mTOR-hämmare) hos patienter med metaplastisk TNBC med en avvikelse i PI3K-vägen.
Med avseende på lokala behandlingar var mastektomi vanligare i vår studie för metaplastisk BC men var inte förknippad med förbättrad överlevnad i förhållande till bröstbevarande kirurgi. Inte heller hittades någon överlevnadsfördel från behandling som innefattade ALND jämfört med SLND. Strålbehandling var dock en betydande prediktor för överlevnad, där metaplastiska BC-patienter som behandlades med adjuvant strålbehandling hade 30 % lägre sannolikhet att dö än de som inte fick strålning. Relevanta begränsningar i vår analys av strålbehandling inkluderar okända detaljer om behandlingsplanering, vald modalitet, kvalitetssäkring eller om tekniker som djup inspirerande andningsuppehåll användes. Även om lokalregionalt återfall inte kan undersökas i NCDB, visade en institutionell serie av 113 patienter med metaplastisk BC (54 % som fick strålbehandling) att strålning var den enda faktor som korrelerade med minskat lokalregionalt återfall (relativ risk utan strålning 3.1; 95 % KI 1,13-9,88, P=0,027).
Våra resultat bör tolkas med försiktighet med tanke på de stora begränsningarna i att vi inte vet vilka kemoterapieregimer som användes, behandlingarnas varaktighet eller svaret på neoadjuvant kemoterapi, eftersom denna information inte finns tillgänglig i NCDB. Vi är också medvetna om begränsningarna i fråga om klinisk-katologiska riskfaktorer som fångas upp i NCDB, utan vilka det kanske inte är möjligt att fullt ut karakterisera kliniska skillnader som driver några av de resultatskillnader som vi har funnit, såsom sämre överlevnadsresultat med ALND även när man kontrollerar för lymfkörtelstatus. Även om vårt urval av metaplastiska BC-patienter var litet i förhållande till icke-metaplastiska BC-studier, är det paradoxalt nog också sannolikt den största existerande studien hittills som undersöker denna fråga med tanke på det begränsade antalet patienter med metaplastisk BC som rapporterats i institutionella serier. Ytterligare undersökningar behövs för att förstå den biologiska predilektionen för metastatisk spridning i metaplastisk BC och validera våra resultat i separata dataset av metaplastiska BC-patienter.
Vår nuvarande vårdstandard är uppenbarligen inte tillräcklig för denna unika cancerpopulation, och för att få fram randomiserade data om metaplastisk BC i framtiden kommer det att krävas samarbetsinsatser på grund av det lilla antalet patienter. NCDB erbjuder en anmärkningsvärd styrka, nämligen möjligheten att studera behandlingsmönster och resultat i samband med en sällsynt diagnos. Med 2 084 individer med metaplastisk BC i denna kohort är detta en av de största metaplastiska BC-undersökningar som rapporterats i modern tid. Överlevnaden för dessa patienter är dålig i förhållande till dem med alla andra BC-typer, och även om detta faktum sannolikt föranleder införandet av aggressiv behandling, tyder vår studie på att mer omfattande lokalregional behandling (t.ex. ALND eller bestrålning av regionala noder) bör övervägas noggrant från fall till fall. Sammantaget är användningen av systemisk terapi avgörande för hanteringen av metaplastisk BC oavsett nodal belastning, och utvecklingen av effektiva riktade terapier baserade på analys av tumörgenomprofilering är lovande för framtiden.
Supplementary Material
![]()
Supplementary table.
Acknowledgements
Speciellt tack till Christine Wogan för redaktionell hjälp.
Finansiering
Stöds delvis av Cancer Center Support (Biostatistics Core) Grant CA016672 från National Cancer Institute, National Institutes of Health, till The University of Texas MD Anderson Cancer Center.
Competing Interests
Författarna har förklarat att det inte finns några konkurrerande intressen.
1. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA Cancer J Clin. 2018;68(1):7-30
2. Yerushalmi R, Hayes MM, Gelmon KA. Bröstcancer – sällsynta typer: genomgång av litteraturen. Ann Oncol. 2009;20(11):1763-1770
3. Günhan-Bilgen I, Memiş A, Ustün EE, Zekioglu O, Ozdemir N. Metaplastiskt karcinom i bröstet: kliniska, mammografiska och sonografiska fynd med histopatologisk korrelation. AJR Am J Roentgenol. 2002;178(6):1421-1425
4. Jung S-Y, Kim HY, Nam B-H. et al. Sämre prognos för metaplastiska bröstcancerpatienter än andra patienter med trippelnegativ bröstcancer. Breast Cancer Res Treat. 2010;120(3):627-637
5. Wargotz ES, Norris HJ. Metaplastiska karcinom i bröstet: V. Metaplastiskt karcinom med osteoklastiska jätteceller. Hum Pathol. 1990;21(11):1142-1150
6. Wargotz ES, Norris HJ. Metaplastiska karcinom i bröstet. I. Matrixproducerande karcinom. Hum Pathol. 1989;20(7):628-635
7. Wargotz ES, Deos PH, Norris HJ. Metaplastiska karcinom i bröstet. II. Spindelcellscancer. Hum Pathol. 1989;20(8):732-740
8. Lee H, Jung S-Y, Ro JY. et al. Metaplastisk bröstcancer: klinisk-patologiska egenskaper och dess prognos. J Clin Pathol. 2012;65(5):441-446
9. He X, Ji J, Dong R. et al. Prognos i olika subtyper av metaplastisk bröstcancer: en befolkningsbaserad analys. Breast Cancer Res Treat. Oktober. 2018
10. National Cancer Database.
11. Chagpar AB, Scoggins CR, Martin RCG. et al. Factors Determining Adequacy of Axillary Node Dissection in Breast Cancer Patients. Breast J. 2007;13(3):233-237
12. Bembenek A, Schlag PM. Lymfkörteldissektion vid bröstcancer. Langenbeck’s Arch Surg. 2000;385(4):236-245
13. Woolson RF. Statistiska metoder för analys av biomedicinska data. New York, USA: John Wiley & Sons. 1987
14. Kaplan EL, Meier P. Nonparametric Estimation from Incomplete Observations NONPARAMETRIC ESTIMATION FROM INCOMPLETE OBSERVATIONS*. Källa J Am Stat Assoc. 1958;53(282):457-481
15. Mantel N. Evaluation of survival data and two new rank order statistics arising in its consideration. Cancer Chemother Rep. 1966;50(3):163-170
16. D.R. C. Regressionsmodeller och livstabeller. Cox livstabeller. 1972;2:187-220
17. Rayson D, Adjei AA, Suman VJ, Wold LE, Ingle JN. Metaplastisk bröstcancer: prognos och svar på systemisk behandling. Ann Oncol Off J Eur Soc Med Oncol. 1999;10(4):413-419
18. Bilimoria KY, Stewart AK, Winchester DP, Ko CY. National Cancer Data Base: ett kraftfullt initiativ för att förbättra cancervården i USA. Ann Surg Oncol. 2008;15(3):683-690
19. Ong CT, Campbell BM, Thomas SM. et al. Metaplastisk bröstcancer Behandling och resultat hos 2500 patienter: En retrospektiv analys av en nationell onkologidatabas. Ann Surg Oncol. 2018;25(8):2249-2260
20. Dietze EC, Sistrunk C, Miranda-Carboni G, O’Regan R, Seewaldt VL. Trippelnegativ bröstcancer hos afroamerikanska kvinnor: olikheter kontra biologi. Nat Rev Cancer. 2015;15(4):248-254
21. Rakha EA, El-Sayed ME, Green AR, Lee AHS, Robertson JF, Ellis IO. Prognostiska markörer i trippelnegativ bröstcancer. Cancer. 2007;109(1):25-32
22. ROJAS K, STUCKEY A. Epidemiologi och riskfaktorer för bröstcancer. Clin Obstet Gynecol. 2016;59(4):651-672
23. Liao H-Y, Zhang W-W, Sun J-Y, Li F-Y, He Z-Y, Wu S-G. De klinisk-patologiska egenskaperna och överlevnadsresultaten för olika histologiska subtyper i trippelnegativ bröstcancer. J Cancer. 2018;9(2):296-303
24. El Zein D, Hughes M, Kumar S. et al. Metaplastic Carcinoma of the Breast Is More Aggressive Than Triple-negative Breast Cancer: En studie från en enskild institution och en genomgång av litteraturen. Clin Breast Cancer. 2017;17(5):382-391
25. Liedtke C, Mazouni C, Hess KR. et al. Svar på neoadjuvant behandling och långtidsöverlevnad hos patienter med trippelnegativ bröstcancer. J Clin Oncol. 2008;26(8):1275-1281
26. Cortazar P, Zhang L, Untch M. et al. Pathological complete response and long-term clinical benefit in breast cancer: the CTNeoBC pooled analysis. Lancet. 2014;384(9938):164-172
27. Fisher B, Brown A, Mamounas E. et al. Effekten av preoperativ kemoterapi på lokalregional sjukdom hos kvinnor med operabel bröstcancer: resultat från National Surgical Adjuvant Breast and Bowel Project B-18. J Clin Oncol. 1997;15(7):2483-2493
28. Chen IC, Lin CH, Huang CS. et al. Bristande effekt av systemisk kemoterapi för behandling av metaplastiskt bröstcancer i modern tid. Breast Cancer Res Treat. 2011;130(1):345-351
29. Hennessy BT, Gonzalez-Angulo A-M, Stemke-Hale K. et al. Karaktärisering av en naturligt förekommande bröstcancerundergrupp som är berikad i epitelial-till-mesenkymal övergång och stamcellsegenskaper. Cancer Res. 2009;69(10):4116-4124
30. Prat A, Parker JS, Karginova O. et al. Fenotypisk och molekylär karakterisering av den inneboende subtypen av bröstcancer med lågt claudinvärde. Breast Cancer Res. 2010;12(5):R68
31. Yu K-D, Zhu R, Zhan M. et al. Identifiering av prognostiskt relevanta undergrupper hos patienter med kemoresistent trippelnegativ bröstcancer. Clin Cancer Res. 2013;19(10):2723-2733
32. Basho RK, Yam C, Gilcrease M. et al. Comparative Effectiveness of an mTOR-Based Systemic Therapy Regimen in Advanced, Metaplastic and Nonmetaplastic Triple-Negative Breast Cancer. Oncologist. 2018;23(11):1300-1309
33. Basho RK, Gilcrease M, Murthy RK. et al. Targeting the PI3K/AKT/mTOR Pathway for the Treatment of Mesenchymal Triple-Negative Breast Cancer. JAMA Oncol. 2017;3(4):509
34. Bergom C, Currey A, Desai N, Tai A, Strauss JB. Deep Inspiration Breath Hold: Tekniker och fördelar för att skona hjärtat vid bröstcancerbestrålning. Front Oncol. 2018;8:87
35. Latty D, Stuart KE, Wang W, Ahern V. Review of deep inspiration breath-hold techniques for the treatment of breast cancer. J Med Radiat Sci. 2015;62(1):74-81
36. Leyrer CM, Berriochoa CA, Agrawal S. et al. Predictive factors on outcomes in metaplastic breast cancer. Breast Cancer Res Treat. 2017;165(3):499-504
37. Takala S, Heikkilä P, Nevanlinna H, Blomqvist C, Mattson J. Metaplastisk bröstcancer: Prognos och svar på systemisk behandling vid metastaserad sjukdom. Breast J. 2019;25(3):418-424
38. Harper NW, Hodges KB, Stewart RL. et al. Adjuvant behandling av trippelnegativ metaplastisk bröstcancer med veckovis paklitaxel- och platinkemoterapi: Retrospektiv fallöversikt från en enda institution. Clin Breast Cancer. May. 2019