Generiskt namn: lidokainhydroklorid
Doseringsform: oral lösning
Rx only
Ett aktuellt bedövningsmedel för munnens och svalgets slemhinnor.
Fall efter marknadsintroduktion av kramper, hjärt- och lungstillestånd och dödsfall hos patienter under 3 år har rapporterats vid användning av Lidocaine Viscous 2 % när det inte administrerats i strikt överensstämmelse med rekommendationerna för dosering och administrering. Vid tandvärk ska Lidocaine Viscous 2 % i allmänhet inte användas. För andra tillstånd bör användningen av produkten hos patienter under 3 år begränsas till de situationer där säkrare alternativ inte finns tillgängliga eller har prövats men misslyckats.
För att minska risken för allvarliga biverkningar vid användning av Lidocaine Viscous 2%, instruera vårdpersonalen att strikt följa den föreskrivna dosen och administreringsfrekvensen och förvara receptflaskan säkert utom räckhåll för barn.
- BESKRIVNING
- Lidokain topisk oral lösning – klinisk farmakologi
- Aktionsmekanism
- Hemodynamik
- Farmakokinetik och metabolism
- Indikationer och användning för Lidokain topisk oral lösning
- Kontraindikationer
- Varningar
- Livshotande och dödliga händelser hos spädbarn och småbarn
- Methemoglobinemi
- Försiktighetsåtgärder
- Läkemedelsinteraktioner
- Carcinogenes, mutagenes, nedsatt fertilitet
- Graviditet
- Sjuksköterskor
- Biverkningar
- Centrala nervsystemet
- Överdosering
- Hantering av nödsituationer med lokalbedövningsmedel
- DOSERING OCH ADMINISTRATION
- Vuxen
- Pediatrisk
- HUR DET ÄR KOMPLETTERAT
- Package/Label Display Panel
- Package/Label Display Panel
BESKRIVNING
Lidocaine Viscous 2% (Lidocaine Hydrochloride Oral Topical Solution USP) innehåller ett lokalbedövningsmedel och administreras lokalt. Lidocaine Viscous 2% (Lidocaine Hydrochloride Oral Topical Solution USP) innehåller lidokainhydroklorid, som kemiskt betecknas som acetamid, 2-(dietylamino)-N-(2,6-dimetylfenyl)-,monohydroklorid, och har följande strukturformel:
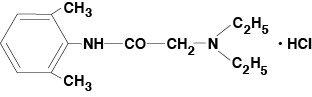
Molekylformeln för lidokain är C14H22N2O. Molekylvikten är 234,34.
Lösningens sammansättning:
Varje ml innehåller 20 mg (2 %) lidokainhydroklorid USP och följande inaktiva beståndsdelar: natriumkarboximetylcellulosa, aromämnen, metylparaben, propylparaben, renat vatten och natriumsackarin.
Lidokain topisk oral lösning – klinisk farmakologi
Aktionsmekanism
Lidokain stabiliserar neuronmembranet genom att hämma de jonflöden som krävs för initiering och ledning av impulser, och därigenom åstadkomma en lokalbedövande verkan.
Hemodynamik
Överdrivna blodnivåer kan orsaka förändringar av hjärtminutvolym, total perifer resistans och genomsnittligt arteriellt tryck. Dessa förändringar kan bero på en direkt deprimerande effekt av det lokalanestetiska medlet på olika komponenter i det kardiovaskulära systemet. Nettoeffekten är normalt en blygsam hypotension när de rekommenderade doserna inte överskrids.
Farmakokinetik och metabolism
Lidokain absorberas efter topisk administrering på slemhinnor, och dess absorptionshastighet och omfattning är beroende av koncentrationen och den totala dosen som administreras, den specifika applikationsstället och exponeringens längd. I allmänhet sker absorptionen av lokalanestetiska medel efter topisk applicering snabbast efter intratrakeal administrering. Lidokain absorberas också väl från mag-tarmkanalen, men lite intakt läkemedel förekommer i cirkulationen på grund av biotransformation i levern. Plasmabindningen av lidokain är beroende av läkemedelskoncentrationen, och den bundna fraktionen minskar med ökande koncentration. Vid koncentrationer på 1 till 4 mcg fri bas per mL är 60 till 80 procent av lidokainet proteinbundet. Bindningen är också beroende av plasmakoncentrationen av alfa-1-syraglykoprotein.
Lidokain passerar blod-hjärn- och placentabarriärerna, förmodligen genom passiv diffusion.
Lidokain metaboliseras snabbt av levern, och metaboliter och oförändrat läkemedel utsöndras av njurarna. Biotransformationen omfattar oxidativ N-dealkylering, ringhydroxylering, klyvning av amidbindningen och konjugering. N-dealkylering, en viktig väg för biotransformation, ger metaboliterna monoetylglycinexylidididid och glycinexylididid. De farmakologiska/toxikologiska effekterna av dessa metaboliter liknar lidokain, men är mindre potenta än lidokain. Ungefär 90 % av det administrerade lidokainet utsöndras i form av olika metaboliter och mindre än 10 % utsöndras oförändrat. Den primära metaboliten i urinen är en konjugat av 4-hydroxi-2, 6-dimetylanilin.
Den eliminerande halveringstiden för lidokain efter en intravenös bolusinjektion är vanligtvis 1,5 till 2 timmar. På grund av den snabba hastigheten med vilken lidokain metaboliseras kan alla tillstånd som påverkar leverfunktionen förändra lidokainkinetiken. Halveringstiden kan förlängas två gånger eller mer hos patienter med leverdysfunktion. Njurdysfunktion påverkar inte lidokainkinetiken men kan öka ackumuleringen av metaboliter.
Faktorer som acidos och användning av CNS-stimulerande och depressiva medel påverkar de CNSnivåer av lidokain som krävs för att ge uppenbara systemiska effekter. Objektiva negativa manifestationer blir allt tydligare med ökande venösa plasmanivåer över 6 mcg fri bas per mL. Hos rhesusapan har arteriella blodnivåer på 18 till 21 mcg/ml visat sig vara tröskelvärde för krampaktig aktivitet.
Indikationer och användning för Lidokain topisk oral lösning
Lidokain är indicerat för framställning av topisk anestesi av irriterade eller inflammerade slemhinnor i mun och svalg. Det är också användbart för att minska kväljningar vid tagning av röntgenbilder och tandavtryck.
Kontraindikationer
Lidokain är kontraindicerat hos patienter med en känd historia av överkänslighet mot lokalbedövningsmedel av amidtyp, eller mot andra komponenter i lösningen.
Varningar
EXCESSIV DOSERING, ELLER KORTA INTERVALLER MELLAN DOSERNA, KAN FÖREBARA HÖGA PLASMAKVALITETSKONSEKVENSER OCH SERIOSA BIDRAGSREPLIKATIONER. PATIENTERNA SKA INSTRUERAS ATT STRIKT FÖLJA DE REKOMMENDERADE RIKTLINJERNA FÖR DOSERING OCH ADMINISTRERING SOM ANGES I DENNA BIPACKSEDEL. HANTERINGEN AV SERIÖSA BOTNA REAKTIONER KAN KRAVA ANVÄNDNING AV RESUSKITATIVA UTRUSTNINGAR, OXYGEN OCH ANDRA RESUSKITATIVA LÄKEMEDEL.
Lidokain ska användas med yttersta försiktighet om slemhinnan i applikationsområdet har traumatiserats, eftersom det under sådana förhållanden finns en potential för snabb systemisk absorption.
Livshotande och dödliga händelser hos spädbarn och småbarn
Postmarknadsföringsfall av kramper, hjärt- och lungstillestånd och dödsfall hos patienter under 3 år har rapporterats vid användning av Lidocaine Viscous 2 % när det inte administrerades i strikt överensstämmelse med rekommendationerna för dosering och administrering. Vid tandvärk ska Lidocaine Viscous 2 % i allmänhet inte användas. För andra tillstånd bör användningen av produkten hos patienter under 3 år begränsas till de situationer där säkrare alternativ inte finns tillgängliga eller har prövats men misslyckats.
Methemoglobinemi
Fall av methemoglobinemi har rapporterats i samband med användning av lokalanestetika. Även om alla patienter löper risk för methemoglobinemi är patienter med glukos-6-fosfatdehydrogenasbrist, medfödd eller idiopatisk methemoglobinemi, hjärt- eller lungkompromiss, spädbarn under 6 månaders ålder och samtidig exponering för oxiderande ämnen eller deras metaboliter mer mottagliga för att utveckla kliniska manifestationer av tillståndet. Om lokalanestetika måste användas hos dessa patienter rekommenderas noggrann övervakning av symtom och tecken på methemoglobinemi.
Signaler på methemoglobinemi kan uppträda omedelbart eller fördröjas några timmar efter exponering och kännetecknas av en cyanotisk hudmissfärgning och/eller onormal färgning av blodet. Methemoglobinnivåerna kan fortsätta att stiga; därför krävs omedelbar behandling för att avvärja allvarligare biverkningar av centrala nervsystemet och kardiovaskulära effekter, inklusive kramper, koma, arytmier och död. Avbryt Lidocaine Viscous 2 % och alla andra oxiderande medel. Beroende på hur allvarliga tecknen och symtomen är kan patienterna svara på understödjande vård, dvs. syrgasbehandling, hydrering. En allvarligare klinisk presentation kan kräva behandling med metylenblått, utbytestransfusion eller hyperbart syre.
Försiktighetsåtgärder
Information till patienter
Föräldrar och vårdgivare bör varnas för följande:
– För patienter under 3 år måste särskild uppmärksamhet ägnas åt att noggrant mäta den föreskrivna dosen och att inte administrera produkten oftare än vad som föreskrivs. – För att säkerställa noggrannhet rekommenderar vi att du använder en mätanordning för att noggrant mäta rätt volym. – Produkten ska endast användas för den föreskrivna indikationen. – För att minska risken för oavsiktligt intag ska produktbehållaren vara tätt stängd och produkten ska förvaras väl utom räckhåll för alla barn omedelbart efter varje användning. – Om patienten visar tecken på systemisk toxicitet (t.ex. letargi, ytlig andning, krampaktivitet) ska akut läkarvård omedelbart tillkallas och ingen ytterligare produkt ska administreras. – Oanvänd produkt ska kasseras på ett sätt som förhindrar eventuell exponering av barn och husdjur.
Alla patienter ska vara medvetna om att när lokalbedövningsmedel används i munnen eller svalget kan produktionen av lokalbedövning försämra sväljningen och därmed öka risken för aspiration. Av denna anledning bör mat inte intas under 60 minuter efter användning av lokalanestetiska preparat i mun- eller halsområdet. Detta är särskilt viktigt hos barn på grund av att de äter så ofta.
Nymning av tungan eller munslemhinnan kan öka risken för bitande trauma. Av denna anledning ska mat och/eller tuggummi inte användas medan mun- eller halsområdet är sövt.
Informera patienterna om att användning av lokalbedövningsmedel kan orsaka methemoglobinemi, ett allvarligt tillstånd som måste behandlas omgående. Informera patienter eller vårdgivare att söka omedelbar läkarvård om de eller någon i deras vård upplever följande tecken eller symtom: blek, grå eller blåfärgad hud (cyanos), huvudvärk, snabb hjärtfrekvens, andfåddhet, yrsel eller trötthet.
Allmänt
Säkerheten och effekten av lidokain är beroende av korrekt dosering, korrekt teknik, adekvata försiktighetsåtgärder och beredskap för nödsituationer (se VARNINGAR och BIDRAGSREAKTIONER). Den lägsta dosen som leder till effektiv anestesi ska användas för att undvika höga plasmanivåer och allvarliga biverkningar. Upprepade doser av lidokain kan orsaka betydande ökningar av blodnivåerna med varje upprepad dos på grund av långsam ackumulering av läkemedlet och/eller dess metaboliter. Toleransen varierar med patientens status. Svaga, äldre patienter, akut sjuka patienter och barn ska ges reducerade doser i proportion till deras ålder, vikt och fysiska tillstånd. Lidokain ska också användas med försiktighet hos patienter med svår chock eller hjärtblock.
Lidokain ska användas med försiktighet hos personer med känd läkemedelsöverkänslighet. Patienter som är allergiska mot paraaminobensoesyraderivat (prokain, tetrakain, bensokain etc.) har inte visat korsöverkänslighet mot lidokain.
Läkemedelsinteraktioner
Patienter som administreras lokalbedövningsmedel löper ökad risk att utveckla methemoglobinemi när de samtidigt exponeras för följande läkemedel, vilket kan inkludera andra lokalbedövningsmedel:
Exempel på läkemedel associerade med methemoglobinemi:
|
Klass |
Exempel |
|
Nitrater/Nitriter |
nitroglycerin, nitroprussid, kväveoxid, lustgas |
|
Lokalbedövningsmedel |
benzokain, lidokain, bupivakain, mepivakain, tetrakain, prilokain, prokain, artikain, ropivakain |
|
Antineoplastiska medel |
cyklofosfamid, flutamid, rasburikas, ifosfamid, hydroxyurea |
|
Antibiotika |
dapson, sulfonamider, nitrofurantoin, para-aminosalicylsyra |
|
Antimalariamedel |
klorokin, primaquin |
|
Antikonvulsiva medel |
fenytoin, natriumvalproat, fenobarbital |
|
Andra läkemedel |
Acetaminophen, metoklopramid, sulfasalazin, kinin |
Carcinogenes, mutagenes, nedsatt fertilitet
Studier av lidokain på djur för att utvärdera den carcinogena och mutagena potentialen eller effekten på fertiliteten har inte genomförts.
Graviditet
Teratogena effekter
Graviditet Kategori B: Reproduktionsstudier har utförts på råttor i doser upp till 6,6 gånger den humana dosen och har inte visat några tecken på att lidokain skulle skada fostret. Det finns dock inga adekvata och välkontrollerade studier på gravida kvinnor. Eftersom reproduktionsstudier på djur inte alltid är förutsägande för responsen hos människor ska detta läkemedel användas under graviditet endast om det är klart nödvändigt.
Sjuksköterskor
Det är inte känt om detta läkemedel utsöndras i humanmjölk. Eftersom många läkemedel utsöndras i humanmjölk ska försiktighet iakttas när lidokain administreras till ammande kvinnor.
Pediatrisk användning
Doseringen till barn ska minskas, i proportion till ålder, kroppsvikt och fysiska förhållanden. Se DOSERING OCH ADMINISTRATION.
Biverkningar
Biverkningar efter administrering av lidokain är av liknande slag som de som observerats med andra lokalanestetiska amidmedel. Dessa biverkningar är i allmänhet dosrelaterade och kan bero på höga plasmanivåer orsakade av överdriven dosering eller snabb absorption, eller kan bero på en överkänslighet, idiosynkrasi eller minskad tolerans hos patienten. Allvarliga biverkningar är i allmänhet systemiska till sin natur. Följande typer är de vanligast rapporterade:
Centrala nervsystemet
CNSmanifestationer är excitatoriska och/eller depressiva och kan kännetecknas av yrsel, nervositet, oro, eufori, förvirring, yrsel, dåsighet, tinnitus, dimsyn eller dimsyn, kräkningar, värme-, köld- eller känselförnimmelser, ryckningar, skakningar, kramper, konvulsioner, medvetslöshet, andningsdepression och andningsstillestånd. De excitatoriska manifestationerna kan vara mycket korta eller inte förekomma alls, i vilket fall den första manifestationen av toxicitet kan vara dåsighet som övergår i medvetslöshet och andningsstillestånd.
Sömnighet efter administrering av lidokain är vanligtvis ett tidigt tecken på en hög blodnivå av läkemedlet och kan uppstå som en följd av snabb absorption.
Kardiovaskulärt system
Kardiovaskulära manifestationer är vanligen depressiva och kännetecknas av bradykardi, hypotoni och kardiovaskulär kollaps, vilket kan leda till hjärtstillestånd.
Allergiska
Allergiska reaktioner kännetecknas av kutana lesioner, urtikaria, ödem eller anafylaktoida reaktioner. Allergiska reaktioner kan uppstå till följd av känslighet antingen för det lokalanestetiska medlet eller för metylparaben och/eller propylparaben som används i denna formulering. Allergiska reaktioner till följd av känslighet för lidokain är extremt sällsynta och om de inträffar ska de hanteras med konventionella metoder. Detektion av känslighet genom hudtest är av tveksamt värde.
Överdosering
Akut akuta nödsituationer av lokalanestetika är i allmänhet relaterade till höga plasmanivåer som påträffas vid terapeutisk användning av lokalanestetika. (Se BÖRSELREAKTIONER, VARNINGAR och FÖRSKRIVNINGAR)
Hantering av nödsituationer med lokalbedövningsmedel
Det första övervägandet är att förebygga, vilket bäst uppnås genom noggrann och konstant övervakning av kardiovaskulära och respiratoriska vitala tecken och patientens medvetandetillstånd efter varje administrering av lokalbedövningsmedel.
Det första steget i hanteringen av konvulsioner består i att man omedelbart uppmärksammar upprätthållandet av en öppen luftväg och assisterad eller kontrollerad ventilation med syrgas. I situationer där utbildad personal är lättillgänglig bör ventilationen upprätthållas och syre bör tillföras genom ett system som kan möjliggöra omedelbart positivt luftvägstryck via mask. Omedelbart efter det att dessa ventilationsåtgärder har vidtagits bör man utvärdera om cirkulationen är tillräcklig, med tanke på att läkemedel som används för att behandla kramper ibland sänker cirkulationen när de administreras intravenöst. Om kramperna kvarstår trots adekvat andningsstöd, och om cirkulationen tillåter det, kan små doser av en ultrakortverkande barbiturat (t.ex. tiopental eller tiamylal) eller en bensodiazepin (t.ex. diazepam) administreras intravenöst. Klinikern bör känna till dessa antikonvulsiva läkemedel innan lokalbedövning används. Understödjande behandling av cirkulationsdepression kan kräva administrering av intravenösa vätskor och, när det är lämpligt, en vasopressor som indikeras av den kliniska situationen (t.ex. efedrin).
Om inte behandling sker omedelbart kan både kramper och kardiovaskulär depression leda till hypoxi, acidos, bradykardi, arytmier och hjärtstillestånd. Om hjärtstillestånd skulle inträffa ska standardåtgärder för kardiopulmonell återupplivning sättas in.
Dialys är av försumbart värde vid behandling av akut överdosering med lidokain.
Den orala LD50-värdet för lidokain hos icke-nötta honråttor är 459 (346-773) mg/kg (som salt) och 214 (159-324) mg/kg (som salt) hos fastande honråttor.
DOSERING OCH ADMINISTRATION
Vuxen
Den maximala rekommenderade engångsdosen lidokain för friska vuxna bör vara sådan att lidokaindosen inte överstiger 4.5 mg/kg eller 2 mg/lb kroppsvikt och inte i något fall överstiger totalt 300 mg.
För symtomatisk behandling av irriterade eller inflammerade slemhinnor i mun och svalg är den vanliga vuxendosen för vuxna 15 ml outspädd. För användning i munnen ska lösningen svabbas runt i munnen och spottas ut. Vid användning i svalget ska den outspädda lösningen gurglas och kan sväljas. Denna dos bör inte administreras med mindre än tre timmars mellanrum och inte fler än åtta doser bör ges under en 24-timmarsperiod. Dosen ska justeras i förhållande till patientens ålder, vikt och fysiska tillstånd (se FÖRSKRIVNINGAR).
Pediatrisk
Vård måste vidtas för att säkerställa korrekt dosering hos alla pediatriska patienter eftersom det har förekommit fall av överdosering på grund av olämplig dosering.
Det är svårt att rekommendera en maximal dos av något läkemedel för barn eftersom denna varierar som en funktion av ålder och vikt. För barn över 3 år som har en normal muskelmassa och normal kroppsutveckling bestäms den maximala dosen av barnets vikt eller ålder. Till exempel: hos ett barn på 5 år som väger 50 pund bör dosen lidokain inte överstiga 75 till 100 mg (3,7 till 5 ml lidokain).
För spädbarn och hos barn under 3 år bör lösningen mätas noggrant och inte mer än 1,2 ml appliceras på det omedelbara området med en applikator med bomullsspets. Vänta minst 3 timmar innan nästa dos ges; högst fyra doser får ges under en 12-timmarsperiod. Lidokain ska endast användas om det underliggande tillståndet kräver behandling med en produktvolym som är mindre än eller lika med 1,2 mL.
HUR DET ÄR KOMPLETTERAT
Lidokain Viscous 2 % (Lidokainhydroklorid oral topisk lösning USP)
Den orala topiska lösningen på 2 % levereras som en klar, färglös, viskös lösning.
NDC 0054-0548-44: Pressflaska med 20 ml
NDC 0054-3500-49: Pressflaska med 100 ml
Lagra vid 20° till 25°C (68° till 77°F).
Dispensera i en barnskyddad behållare enligt definitionen i USP/NF.
Skölj väl före användning.
Distr. av: West-Ward
Pharmaceuticals Corp.
Eatontown, NJ 07724
Revised October 2018
Package/Label Display Panel
NDC 0054-3500-49 Lidocaine Viscous (Lidocaine Hydrochloride Oral Topical Solution USP) 100mL

Package/Label Display Panel
NDC 0054-0548-44 Lidokain Viscous (Lidokainhydroklorid oral topisk lösning USP) 15mL

| LIDOKAIN VISCOUS lidokainhydrokloridlösning |
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
| LIDOCAINE VISCOUS lidokainhydroklorid lösning |
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
Etikett – West-Ward Pharmaceuticals Corp. (080189610)
| Etablering | |||
| Namn | Adress | ID/FEI | Verksamhet |
| West-Ward Columbus Inc. | 058839929 | MANUFACTURE(0054-3500, 0054-0548) | |
Medicinsk ansvarsfriskrivning