Ett forskningsprogram genomfördes för att förbättra bearbetningstekniken för utvinning av aluminiumoxid från icke-bauxit. Framgången med detta program hade gett den teknik som krävs för att producera en adekvat tillgång till högkvalitativ aluminiumoxid från inhemska källor och därmed tillgodose nationella ekonomiska och strategiska behov i förhållande till aluminiumproduktion. Saltsyraprocessen för att utvinna aluminiumoxid från lågkvalitativa malmer är en av de processer som undersöks i forskningsprogrammet.
En fas i denna process utnyttjar effekten av kloridjonkoncentrationen på aluminiumjonens löslighet i lösning. Vid 25° C är AlCl3:s löslighet i rent vatten ungefär 31 viktprocent och minskar med ökande koncentration av saltsyra (HCl) och blir 0,1 viktprocent när HCl-koncentrationen ökar till 37 viktprocent. Detta beteende har varit föremål för många undersökningar, processer och patent. Det är således möjligt att laka ut en icke bauxitisk malm med HCl, dekantera och filtrera vätskan och tillsätta gasformig HCl för att utfälla AlCl3-6H2O. Den återstående syralösningen kan sedan användas för att laka ytterligare malm och den utfällda AlCl3-6H2O kan brännas för att erhålla Al2O3 . En omfattande diskussion och utvärdering av denna process presenteras av Peters, Johnson och Kirby. Termodynamiska data, t.ex. jonaktivitet och löslighet, som krävs för en fullständig analys, tolkning och förbättring av denna process är sällsynta, och de befintliga uppgifterna om löslighet är begränsade till ett snävt temperaturintervall. Syftet med denna undersökning var därför (1) att bestämma AlCl3:s löslighet i ett temperaturområde från 25° till 85° C med en HCl-koncentration från 0,0 till 37 %.2 pct; (2) att beräkna aktiviteterna av AlCl3 och av H2O i lösningar som innehåller olika elektrolyter , och jämviktskonstanten för upplösning av AlCl3-6H2O; och (3) att föreslå forskningsområden för att generera användbara data.
- Apparat
- Experimentellt förfarande
- Analys
- Resultat
- Sammanjämkning med andra data
- Thermodynamisk behandling
- Löslighetsprodukt och aktiviteter i AlCl3-6H2O-H2O-systemet
- Skattning av aktiviteter i AlCl3-6H2O-H2O-systemet
- Löslighetsprodukt och aktiviteter i AlCl3-6H2O-HCl-H2O-systemet
- Skattning av aktiviteter i AlCl3-6H2O-HCl-H2O-systemet
- AlCl3-FeCl3-KCl-NaCl-HCl-H2O System
- Områden som rekommenderas för forskning
- Aluminiumklorid i vattenhaltiga saltsyrelösningar
Apparat
Apparaten som användes för mätningar av lösligheten visas i figur 1. En 100 ml kolv, A, innehåller en lösning av elektrolyter och lite överskottssalt. Ett fransat glasfilter, B, som är smält på ett Pyrexrör med en diameter på 6 mm, är anslutet till ett yttre rör som är fäst vid två teflonventiler, D och E. Den övre delen är fäst vid A vid C med hjälp av en gängad nylonkompressionskoppling med en 0-ring av neopren. Ett polyetylenrör F-L med en diameter på 6 mm levererar ett prov av den lösning som filtrerats vid B till den andra kolven K när A trycksätts genom avstängningskranen D och E öppnas. Fästningen vid J liknar den vid C. Kolvarna är fastspända på en stång, G, som är fäst vid en gungmekanism, med H som gungaxel för att växelvis skaka kolvarna, A och K, uppåt och nedåt. En täckt termostat, 0, regleras med en noggrannhet på ±0,2° C. En närmare temperaturreglering är onödig eftersom lösligheten är en mycket svag funktion av temperaturen.
Experimentellt förfarande
Mätningar av lösligheten vid 25°, 45°, 65° och 85° C utfördes under betingelser för fasjämvikt med analytiska material av reagenskvalitet. Lämpliga mängder AlCl3-6H2O, 37-procentig HCl-lösning och destillerat vatten placerades i kolv A för att bilda cirka 90 ml lösning med en liten mängd överskott av saltkristaller (nedan avser ”salt” aluminiumkloridhexahydrat). Materialmängderna uppskattades utifrån befintliga uppgifter om löslighet i det ternära systemet AlCl3-6H2O-HCl-H2O. Efter att lösningen bildats i kolv A och apparaten monterats, sänktes den ner i vatten till nivå N och termostaten ställdes in på önskad temperatur. En kontinuerlig mekanisk omrörning av kolvarna användes under varje körning som varade 2-3 dagar. Periodvis användes också kraftig manuell omrörning för att säkerställa
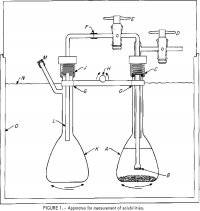
jämvikt, särskilt om saltet kan bilda ett komplext fast salt med HCl. I slutet av jämviktstiden fick kolvarna stå stilla i ett upprätt läge i en timme för att säkerställa att fasta partiklar sedimenterar. Därefter öppnades kranarna D och E för att överföra ungefär hälften av lösningen till provtagningskolven K. Nivån i B under vätskan i A avgjorde vanligen mängden lösning som överfördes till K. Vikten av lösningen i K bestämdes genom att väga kolven innan den monterades och efter det att lösningen släppts in och den monterades isär. En känd mängd destillerat vatten injicerades i kolven genom L för att späda ut provet och lösa upp eventuell ånga i gasfasen. Partialtrycket för HCl i rent vatten överstiger 1 torr vid 25 °C vid molaliteter över 8 m (m efter en siffra i en mening betecknar molal). Vid koncentrationer under 8 m är det därför tveksamt om någon förlust av HCl skulle kunna inträffa under provtagningen. Av denna anledning gjordes några av körningarna vid 25° C, som innehöll mindre än 4 m HCl, med en enda proppflaska, och efter ekvilibrering dekanterades och filtrerades försiktigt en del av lösningen för provtagning.
Analys
Lösningarna analyserades efter lämplig utspädning med avseende på totala koncentrationer av kloridjoner och aluminiumjoner. Den totala kloridjonkoncentrationen bestämdes genom potentiometrisk titrering med Ag+. Al+++-koncentrationen bestämdes genom att först komplexera med ett överskott av etylendiamintetraättiksyra (EDTA) och sedan baktitrera överskottet av EDTA med Cu++ vid ett pH på 3,8.
AlCl3-innehållet beräknades från Al+++-analysen. Genom att subtrahera kloridjonen i den beräknade mängden AlCl3 från den totala kloridjonkoncentrationen kunde HCl-koncentrationen i de mättade lösningarna beräknas.
Denna beräkningsmetod användes för alla analyser utom de där HCl-koncentrationen visste att den var noll, dvs. när AlCl3 var den enda elektrolyten i rent vatten. För dessa analyser beräknades AlCl3-koncentrationen helt enkelt från kloridjonanalysen, som var den noggrannare av de två analyserna, även om både Al+++- och Cl-analyser fortfarande genomfördes för dessa prover.
Skillnaden i Cl-analysen beräknad från den totala Cl-analysen och Cl- från Al+++-analysen för experiment utan tillsatt HCl var ±0,2 viktprocent Cl-. Detta tyder på att analysen av Al+++ i genomsnitt var behäftad med +0,05 viktprocent fel, eftersom Cl-analysen var känd för att vara betydligt noggrannare än Al+++-analysen. I lösningar som innehåller HCl återspeglades ett fel på ±0,05 procent i Al+++-halten som ±0,20 pct i HCl-halten; detta berodde på att även om den totala Cl-halten var mycket noggrann, beräknades den Cl som tillfördes av tillsatt HCl, och därmed molaliteten av HCl, med hjälp av en differens enligt vad som tidigare nämnts.
Resultat
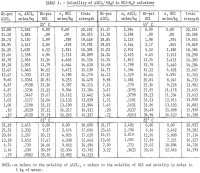
Resultaten sammanfattas i tabell 1 och visas i figur 2. Den maximala HCl-koncentrationen för de data som anges i tabell 1 för 85° C är ungefär 30 viktprocent. Mätningarna avbröts vid denna koncentration på grund av de alltför höga jämviktstrycken i systemet vid högre koncentrationer. Det bör också noteras att färre bestämningar utfördes vid 65° och 85° C än vid 25° och 45° C. Upprepningar utfördes vid de två lägre temperaturerna för att ge en indikation på tillfredsställande repeterbarhet av resultaten. Figur 2 visar att aluminiumsaltets löslighet minskar drastiskt med ökande HCl-koncentration. Det är därför möjligt att laka icke-bauxitiska malmer med HCl-lösning och utfällning av det rena saltet för extraktion av aluminium genom att tillsätta HCl. Resultaten visar att lösligheten inte förändras mycket med temperaturen, och för en temperaturökning på 60° C (25° till 85° C) ökar lösligheten av enbart rent salt i vatten endast med 2,2 pct i förhållande till lösligheten vid 25° C.
Sammanjämkning med andra data
Lösligheten av rent salt i vatten vid 25° C visade sig stämma exakt överens med data från Palitzch och med Ehret och Frere. De resultat som ges av Malquori är ungefär 10 procentenheter högre. Den löslighet som erhållits av Tanaka är ca 3,3 pct högre än i denna undersökning vid 45° och 65° C.
Inverkan av HCl i vatten på saltets löslighet har undersökts av Seidel och Fisher vid 0° C och av Malquori vid 25° C. De förstnämnda forskarnas resultat vid 0° C stämmer mycket väl överens med uppgifterna i tabell 1, extrapolerade till 0° C, medan de sistnämnda forskarnas resultat vid 25° C är något splittrade och avviker ungefär med 3 pet vid låga HCl-koncentrationer; överensstämmelsen i intervallet 5 till 30 viktprocent HCl är dock inom 1 pct.
Thermodynamisk behandling
Löslighetsprodukt och aktiviteter i AlCl3-6H2O-H2O-systemet
Den joniska aktivitetskoefficienten Y12 för AlCl3 i vatten har mätts upp till 1,8 m av Mason, och omräknade värden ges av Robinson och Stokes. Eftersom aktivitetskoefficienten från 1,8 m till mättnadsvärdet på 3,3835 m förväntas öka mer än fem gånger, används mättnadsvärdet för beräkning enligt den metod som beskrivs i detalj i en tidigare rapport (1 m = 1 mol i 1 kg lösningsmedel). Metoden, med dess lämpliga nya tillämpning, sammanfattas kortfattat i denna rapport. Den genomsnittliga joniska aktiviteten hos AlCl3, betecknad som a12, uttrycks genom följande potenserie i termer av molalitet m:

Korresponderande ekvation för aktiviteten hos vatten aw, erhålls genom tillämpning av Gibbs-Duhem-relationen; resultatet är
![]()
Bemärk att exponenterna för m med samma koefficienter för C, D, osv, är 1 högre i ekvation 2 än i ekvation 1, och koefficienten för m i ekvation 2 härrör från Debye-Huckel-teorin som diskuterats av Gokcen.
Reaktionen för upplösning av saltet är
AlCl3-6H2O (S) = Al+++ + 3Cl- + 6H2O (l),………………………….(3)
där (s) betyder fast ämne och (l) vätska.
Den motsvarande jämviktskonstanten är
![]()
där nämnaren, aktiviteten hos fast ämne, tas som enhet eftersom dess sammansättning förblir oförändrad när andra elektrolyter tillsätts i lösning. Vi ersätter a12 i 1n Kp direkt från ekvation 1 och aw från ekvation 2 efter att ha multiplicerat ekvation 2 med 0,108093 för att göra koefficienten för 1n aw lika med 6. Eftersom Kp är sammansättningsoberoende är det uppenbart att
![]()
Efter de nödvändiga substitutionerna från ekvationerna 1 och 2 och sedan substitutionen av medelvärdet m = 3.3835 från de två första körningarna i tabell 1 erhålls en ekvation för att lösa de sex okända koefficienterna i ekvation 1, och de återstående fem ekvationerna erhålls genom att ersätta vart och ett av de fem experimentella värdena för den genomsnittliga joniska aktivitetskoefficienten för AlCl3 , y12 i tabell 2, med
![]()
och sedan ersätta varje resultat i ekvation 1. Sex simultana ekvationer som erhålls på detta sätt löses sedan med hjälp av datorn. Resultaten är följande:
C = -57,5723,
D = +142,0288,
E = -202,5581,
F = +161,1919,
G = -67,7831,
och H = +11,6880.
Substitution av dessa värden i ekvationerna 1, 2 och 4 ger värden för Y12, aw och Kp. Resultaten anges i tabell 3 under rubriken ”Resultat från byrån”. Det bör noteras att vattnets aktivitet nu kan beräknas från ekvation 2, och vattnets ångtryck över lösningen, P, från
aw = P/P°,……………………………….(7)
där P° är ångtrycket för rent vatten vid samma temperatur. Observera att vattnets ångtryck över den mättade lösningen är lite mer än hälften av ångtrycket över rent vatten eftersom aw = 0,509. Ovanstående resultat utgör den första uppsättningen data om aktiviteter baserade på saltets löslighet.
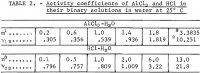
Note.- I denna tabell avser m molaliteten för AlCl3, n molaliteten för HCl, och molaliteten är mol i 1 kg vatten.
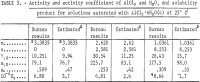
Note.-I denna tabell avser m molaliteten för AlCl3, n molaliteten för HCl och molaliteten är mol i 1 kg vatten.
Skattning av aktiviteter i AlCl3-6H2O-H2O-systemet
Två befintliga tillförlitliga skattningsmetoder används för att få fram aktiviteterna i AlCl3-6H2O-H2O-systemet utöver de befintliga direkta experimentella uppgifterna vid m = 1,8. Den första metoden, som beskrivs av Kusik och Meissner, ger ett uppskattat värde på γ12 = 9,94 vid 3,3835 m. Detta uppskattade värde stämmer väl överens med 10,251, det värde som erhålls i denna undersökning. Motsvarande uppskattade värde för vattnets aktivitet, aw, är 0,47, vilket återigen stämmer väl överens med det värde på 0,509 som hittats i denna undersökning. Jämviktskonstanten Kp beräknad från dessa värden är inte långt ifrån 6,8 x 10 5, med tanke på att den fjärde potensen av a12 och den sjätte potensen av aw multipliceras för att erhålla Kp.
Den andra skattningsmetoden enligt Bromley ger 10,42 för γ12, ett värde som ligger närmare det värde som erhålls med den föregående metoden. Aktivitetskoefficienten för vatten har erhållits av de nuvarande författarna genom att integrera Gibbs-Duhems ekvation i vilken de värden för a12 som uppskattats med Bromley-metoden har använts. Resultatet är aw = 0,540. Medelvärdet för båda metoderna är 0,505, vilket stämmer mycket väl överens med byråns värde på 0,509. Bromley-metoden innehåller dock inte en bekväm metod för bestämning av aw som ingår i Kusik-Meissner-metoden.
Överensstämmelsen mellan de uppskattade värdena och värdena från löslighetsdata är inte alltid så god som visas här för varje elektrolyt vid varje sammansättning. Till exempel, även för AlCl3 vid 1 m skiljer sig de två skattningarna av γ12 med endast 13 procent från varandra.
Löslighetsprodukt och aktiviteter i AlCl3-6H2O-HCl-H2O-systemet
Effekten av en ökande koncentration av HCl på saltets löslighet beror till stor del på den ökande koncentrationen av kloridjonerna. Jämviktskonstanten i detta fall med aktiviteterna a1 och a2 för enskilda joner är
![]()
där γ12 = γ1γ2 genom definition av γ12 från de enskilda joniska aktiviteterna γ1 (för Al+++) och γ2 (för Cl-), och n är molaliteten av HCl. Värdet för Kp är detsamma som för ekvation 4, men den högra sidan i ekvation 8 skiljer sig från den i ekvation 4. Det kan noteras att när n ökar måste m, koncentrationen av Al+++, minska, förutsatt att γ12 och aw inte minskar kraftigt; därför fälls saltet ut, vilket är känt som saltningseffekten.
Beräkningen av aktiviteterna i den ternära lösningen kräver en ekvation som liknar ekvation 1 för HCl. Eftersom data för HCl är exakt kända över ett brett koncentrationsområde är det möjligt att ta en ekvation med så många variabler som önskas. Följande ekvation ger en korrekt återgivning av data för HCl:s aktivitetskoefficient γ32 där subscript 3 står för H+ och 2 för Cl-:
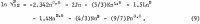
De data som valts ut för detta ändamål från Haase, Naas och Thutnm är listade på den tredje och fjärde raden i tabell 2. Värdena för de koefficienter som beräknats från dessa data är följande:
J = -1,88416,
K = +2,24342,
L = -1,98545,
M = +1,00091,
N = -0,25934,
och P = +0,02634.
Ekvationerna för AlCl3:s och H2O:s aktivitet innehåller dessa koefficienter samt koefficienterna för korsprodukterna (m h/2)(n k/2), där h och k är heltal, och dessa ekvationer är följande:
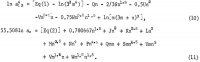
De fem ytterligare koefficienterna i dessa ekvationer bestäms genom att addera ekvation 10 och 6 1n aw från ekvation 11 för att erhålla 1n Kp och genom att använda följande utvalda löslighetsdata från tabell 1:
m: 2.620, 2,016, 1,333, 0,953 och 0,535.
n: 2,581, 4,460, 6,780, 8,397 och 10,063.
De resulterande beräkningarna ger följande värden för koefficienterna i ekvationerna 10 och 11:
Q = +23,27027,
S = -22.47064,
U = +4,29102,
V = -9,76081,
och W = +4,60246.
Resultaten för γ12, a12, aw och Kp beräknade med hjälp av föregående ekvationer anges i tabell 3. Värdena för γ12 från ekvation 9 stämmer överens med värdena från Harned och Gary vid mycket låga koncentrationer av HCl och AlCl3.
Det partiella trycket av HCl(g), P32, över en lösning kan beräknas från följande ekvation (4):
Kp (HCl) = 4.94 x 10 -7 = P32/a²32………………………….(12)
där Kp(HCl) är jämviktskonstanten vid 25° C för H+ + Cl- = HCl(g) och a32 är den genomsnittliga joniska aktiviteten för HCl i lösning. För detta ändamål är det nödvändigt att skriva en ekvation för a32, liknande ekvation 10, genom att använda parametrarna i ekvation 11, vilket visas utförligt på annan plats.
Temperaturens inverkan på saltets löslighet är liten, vilket framgår av tabell 1. Effekten på de joniska aktiviteterna förväntas därför vara liten eftersom alla parametrar i ekvation 11 kunde ha erhållits från löslighetsdata om det experimentella felet var mindre än ±0,01 viktprocent för aluminiumanalysen. I allmänhet är varje parameter en linjär funktion av temperaturen för ett temperaturområde upp till cirka 80° C, och detta beroende kan bestämmas om ekvation 11 var känd vid en annan temperatur som är minst 50° C högre än 25° C.
Skattning av aktiviteter i AlCl3-6H2O-HCl-H2O-systemet
Värdena för aktiviteter, aktivitetskoefficient och löslighetsprodukt som skattats i denna rapport enligt den metod som utarbetats av Kusik och Meissner, är listade i tabell 3. Aktivitetskoefficienten γ12 för AlCl3 är ungefär dubbelt så hög som det uppskattade värdet för de utvalda lösningarna som innehåller HCl. Aktiviteten för vatten, aw, stämmer dock väl överens med de uppskattade värdena utom för m = 2,620. Det är uppenbart att beräkningarna skulle ha varit betydligt mer tillförlitliga om vattnets ångtryck, aw, hade mätts, eftersom aw ingår i Kp som aw, så att små fel i aw orsakar stora fel i γ12 och Kp . För detta ändamål rekommenderas ett begränsat antal ångtrycksmätningar för att testa noggrannheten hos de nuvarande beräkningarna och skattningsmetoderna.
Temperaturberoendet för de termodynamiska egenskaperna i tabell 3 kan uppskattas enligt beskrivningen av Kusik och Meissner. Det är dock troligt att uppskattningen ger en högre grad av temperaturberoende än den som indikeras av det svaga temperaturberoendet för lösligheten. Inget försök kunde göras att beräkna effekten av temperatur med byråns metod eftersom (1) a12 vid låga koncentrationer av AlCl3 inte är känt vid olika temperaturer, (2) AlCl3:s löslighet inte kunde bestämmas med en noggrannhet som närmar sig 0,01 procent i Al+++, och (3) koncentrationsintervallet för HCl vid 65° och 85° C är för litet för att man skall kunna välja ut ett tillräckligt stort antal data om AlCl3:s löslighet som är mycket olika, så att man kan bestämma parametrarna i ekvationerna 10 och 11 med precision.
AlCl3-FeCl3-KCl-NaCl-HCl-H2O System
Förberedande data om lösligheten hos AlCl3, FeCl3 , KCl och NaCl i vattenlösningar som innehåller 24 till 31 viktprocent HCl vid 25° C erhölls för att bedöma kontaminering av AlCl3-6H2O som kan extraheras från icke bauxitiska malmer. För detta ändamål framställdes 2 liter av en lösning som innehöll kända mängder salter, 90 ml av denna lösning placerades i en kolv för varje körning och sedan lades en känd mängd gasformig HCl till för att uppnå 24 till 31 viktprocent löst HCl. I detta intervall av HCl i lösning utfälldes färglösa anisotropa kristaller av AlCl3-6H2O, ljusa anisotropa kristaller av FeCl3-2KCl-H2O och kubiska isotropa genomskinliga kristaller av KCl och NaCl som identifierades genom mikroskopisk undersökning. Förfarandet och analyserna för aluminiumjon- och kloridjonkoncentrationer var desamma som för AlCl3-6H2O-HCl-H2O-systemet som presenterats tidigare i denna rapport. Dessutom bestämdes järnjonkoncentrationen genom standardtitrering med K2Cr2O7, natriumjonkoncentrationen bestämdes genom atomabsorptionsteknik och kaliumjonkoncentrationen bestämdes genom subtraktion av natriumjonkoncentrationen från en bestämning av de kombinerade kaliumjon- och natriumjonkoncentrationerna efter separation genom jonbyte. Resultaten anges i tabell 4 och visas i figur 3. Liknande resultat från Miles visas också i figur 3 för att visa att överensstämmelsen är utmärkt. Publicerade data för relaterade enklare system som innehåller färre komponenter har sammanställts av Linke.
I de evaporativa kristalliseringsprocesserna eller HCl-gaskristalliseringsprocesserna för framställning av rent aluminiumkloridhexahydrat blir kontaminering med andra metallklorider ett problem när föroreningsnivåerna byggs upp i urlakningslösningarna. Figur 3 visar de koncentrationsnivåer där föroreningar som NaCl, KCl och FeCl2-2KCl-H2O också kristalliserar från lösningen som tydliga separata faser och därmed orsakar kontaminering av AlCl3-6H2O-kristallerna. Vid mindre än 2,4 viktprocent FeCl3 i närvaro av 1,6 viktprocent KCl vid 25 °C måste t.ex. koncentrationen av HCl vara mindre än 28 viktprocent för att undvika att AlCl3-6H2O förorenas av dubbelsaltet FeCl3-2KCl-H2O. Figur 3 är också användbar vid omlösning av utfällningen fraktionerad omkristallisering för att rena aluminiumsaltet. Dessutom kan vissa av övergångselementens salter, t.ex. FeCl3, minimeras genom partiell elektrolys för att plana ut en tillräcklig mängd järn före försurning med HCl.
En termodynamisk behandling av systemet med det vanliga felet på ±0,05 viktprocent i kloridjonkoncentrationen är inte genomförbar, särskilt i avsaknad av ångtrycksdata för H2O(g) och HCl(g). Grova uppskattningar av aktiviteterna kan dock göras med Kusik-Meissner-metoden. Man räknar med att sådana uppskattningar endast kan ge grova värden på aktiviteterna för de hydratiserade och komplexa salterna och för vattnet.

Områden som rekommenderas för forskning
Mätningarna av aktiviteterna är användbara för att tolka termodynamik och kinetik vid urlakning, utfällning och rening av önskade beståndsdelar i olika malmer. Det finns två skäl till att aktiviteterna kan bestämmas exakt från mätningar av vattnets ångtryck: (1) Ångtrycket kan mätas med hög precision med hjälp av differentialtrycksgivare för att erhålla aw genom ekvation 7 och sedan beräkna värdena för parametrarna i ekvation 11 så att alla relaterade egenskaper kan beräknas som tidigare diskuterats i detalj. (2) Löslighetsprodukten och aktiviteterna kan båda bestämmas exakt för flervalenta salter som innehåller ett stort antal vattenmolekyler i sina hydratiserade kristaller. Det andra skälet härrör från det faktum att exponenten för vattnets aktivitet i ekvation 4 är lika med molerna vatten i den hydratiserade kristallen.
Aluminiumklorid i vattenhaltiga saltsyrelösningar
En annan intressant typ av experiment för det ternära system som diskuteras här är mätning av partialtrycket av HCl(g) över olika lösningar som innehåller tillräckligt stora mängder löst HCl. Det experimentella förfarandet för detta ändamål beskrivs på annat håll. Salter av grupp IIA, IIIA och övergångsmetaller är utmärkta kandidater för dessa typer av undersökningar eftersom elektrolyter med högre valenser än 1:1 vanligtvis bildar hydrerade salter.
Lösligheten och aktiviteten hos aluminiumkloridhexahydrat, AlCl3-6H2O, i vattenlösningar bestämdes som en del av Bureau of Mines, U.S. Department of the Interior, forskning för att förbättra mineralförädlingstekniken för att återvinna aluminiumoxid från inhemska resurser med låg kvalitet. AlCl3:s löslighet i rent vatten visade sig vara 31,09 och 31,77 viktprocent vid 25° respektive 85° C och minskade drastiskt till 10 och 0,1 viktprocent när 20,3 respektive 37 viktprocent saltsyra (HCl) tillsattes i lösningen. Jämviktskonstanten för hexahydratets löslighet, aktiviteter och aktivitetskoefficienter för AlCl3 och H2O beräknades och jämfördes med resultaten från de tillgängliga skattningsmetoderna. Resultaten visades vara användbara vid urlakning av icke-bauxitiska malmer för utvinning av aluminiumoxid genom att förändra lösligheten hos de ingående salterna vid tillsats av HCl.
Den samtidiga lösligheten hos AlCl3 , FeCl3, KCl och NaCl i HCl-H2O-lösningar bestämdes också, och deras effekter på renheten hos AlCl3-6H2O som kristalliseras från lösningar av blandade salter diskuteras kortfattat.