- Tabell över geometrier
- LÄRMÅL
- NÖJLIGA UPPGIFTER
- Nyckelpunkter
- Nyckelbegrepp
- VSEPR-modellen
- Molekylära geometrier
- Hur man bestämmer molekylär geometri – YouTube: Denna video beskriver en metod för att snabbt hitta de viktigaste geometriska formerna för enkla molekyler.
- Molekylära geometrier
- LÄRMÅL
- NÖJLIGA UPPDRAG
- Nyckelpunkter
- Nyckelbegrepp
- AXE-metoden
- Huvudgeometrier (utan ensamma elektronpar):
- Trigonal planar
- Tetraeder
- Oktaeder
- Interaktivt: Elektrongeometri: Molekyler antar olika former på grund av mönster av delade och odelade elektroner. I dessa exempel delas alla elektroner som påverkar molekylernas form i de kovalenta bindningar som håller ihop atomerna för att bilda molekylerna.
- Enliga elektronpar
- LÄRMÅL
- NÖGRATIGHETER
- Nyckelpunkter
- Nyckelbegrepp
- Molekylära geometrier med lone pair-elektroner
- Koordineringsnummer och den centrala atomen
- Den repulsiva effekten av det ensamma elektronparets elektroner
- Interaktiv: Odelade elektroner och den ”böjda” formen: Använd 3D-modellen för att se hur odelade elektroner stöter bort de delade elektronerna i bindningarna mellan väte och syre, vilket gör att molekylen får en ”böjd” form.
- LICENSER OCH ATTRIBUTIONER
- CC LICENSERAT INNEHÅLL, DELAD FÖRUT
- CC LICENSED CONTENT, SPECIFIC ATTRIBUTION
Tabell över geometrier
VSEPR-teorin bestämmer molekylära geometrier (linjära, trigonala, trigonala bipyramidala, tetraederala och oktaederala).
LÄRMÅL
Använd VSEPR-modellen för att bestämma geometrin hos en molekyl som inte innehåller några ensamma elektronpar på den centrala atomen.
NÖJLIGA UPPGIFTER
Nyckelpunkter
- Fundamentalt sett teoretiserar VSEPR-modellen att områden med negativ elektrisk laddning kommer att stöta bort varandra, vilket gör att de (och de kemiska bindningar som de bildar) håller sig så långt ifrån varandra som möjligt.
- Molekylära geometrier tar hänsyn till antalet atomer och antalet ensamstående parelektroner.
- De viktigaste geometrierna utan ensamstående parelektroner är: linjär, trigonal, tetraedrisk, trigonal bipyramidal och oktaedrisk.
Nyckelbegrepp
- VSEPR-teori: En kemimodell som används för att förutsäga formen på enskilda molekyler baserat på elektrostatisk repulsion av elektronpar
VSEPR-modellen
Modellen för repulsion av elektronpar i valensskalet (VSEPR-modellen) fokuserar på de bindningsbara och icke-bindningsbara elektronpar som finns i det yttersta (valens)skalet hos en atom som är kopplad till två eller flera andra atomer.
Fundamentalt sett bygger VSEPR-modellen på teorin att dessa områden med negativ elektrisk laddning stöter bort varandra, vilket gör att de (och de kemiska bindningar som de bildar) håller sig så långt ifrån varandra som möjligt. Därför kommer de två elektronmoln som ingår i en enkel triatomär molekyl ![]() att sträcka sig ut i motsatta riktningar. Ett vinkelavstånd på 180° placerar de två bindningsorbitalerna så långt ifrån varandra som möjligt; vi förväntar oss därför att de två kemiska bindningarna sträcker sig i motsatta riktningar, vilket ger en linjär molekyl.
att sträcka sig ut i motsatta riktningar. Ett vinkelavstånd på 180° placerar de två bindningsorbitalerna så långt ifrån varandra som möjligt; vi förväntar oss därför att de två kemiska bindningarna sträcker sig i motsatta riktningar, vilket ger en linjär molekyl.

 . De två X-atomerna (i vitt) är 180° från varandra.
. De två X-atomerna (i vitt) är 180° från varandra.Om den centrala atomen också innehåller ett eller flera par icke-bindande elektroner kommer dessa ytterligare områden med negativ laddning att bete sig ungefär som de som är förknippade med de bundna atomerna. De orbitaler som innehåller de olika bindande och icke-bindande paren i valensskalet kommer att sträcka sig ut från den centrala atomen i riktningar som minimerar deras ömsesidiga repulsioner. Om den centrala atomen har delvis ockuperade d-orbitaler kan den kanske rymma fem eller sex elektronpar, vilket bildar vad som ibland kallas en ”expanderad oktett.”
Molekylära geometrier
Molekylära geometrier (linjära, trigonala, tetraedriska, trigonala bipyramidala och oktaedriska) bestäms av VSEPR-teorin. En tabell över geometrier med hjälp av VSEPR-teorin kan underlätta ritning och förståelse av molekyler. Tabellen över molekylgeometrier finns i den första figuren. Den andra figuren fungerar som ett visuellt hjälpmedel för tabellen.


Hur man bestämmer molekylär geometri – YouTube: Denna video beskriver en metod för att snabbt hitta de viktigaste geometriska formerna för enkla molekyler.
Molekylära geometrier
VSEPR-teorin beskriver fem huvudsakliga former för enkla molekyler: linjära, trigonala plana, tetraedriska, trigonala bipyramidala och oktaedriska.
LÄRMÅL
Använd VSEPR-modellen för att bestämma geometrin hos molekyler där den centrala atomen innehåller ett eller flera ensamma elektronpar.
NÖJLIGA UPPDRAG
Nyckelpunkter
- Linjärt: en enkel treatomig molekyl av typen
 ; dess två bindningsorbitaler är 180° från varandra.
; dess två bindningsorbitaler är 180° från varandra. - Trigonalt planärt: triangulärt och i ett plan, med bindningsvinklar på 120°.
- Tetraeder: fyra bindningar på en central atom med bindningsvinklar på 109,5°.
- Trigonal bipyramidal: fem atomer runt den centrala atomen; tre i ett plan med bindningsvinklar på 120° och två i motsatta ändar av molekylen.
- Oktaeder: sex atomer runt den centrala atomen, alla med bindningsvinklar på 90°.
Nyckelbegrepp
- VSEPR-teori: VSEPR-modellen (Valence Shell Electron Pair Repulsion) används för att förutsäga formen på enskilda molekyler baserat på omfattningen av den elektrostatiska repulsionen av elektronpar
AXE-metoden
Ett annat sätt att betrakta molekylära geometrier är genom ”AXE-metoden” för elektronräkning. A i AXE representerar den centrala atomen och har alltid ett implicit subscript one; X representerar antalet sigma-bindningar mellan den centrala atomen och atomerna utanför (flera kovalenta bindningar – dubbla, tredubbla etc. – räknas som ett X); och E representerar antalet ensamma elektronpar som omger den centrala atomen. Summan av X och E, som kallas det steriska talet, är också förknippat med det totala antalet hybridiserade orbitaler som används i teorin om valensbindningar. VSEPR använder det steriska antalet och fördelningen av X och E för att förutsäga molekylära geometriska former.

Bemärk att geometrierna är namngivna endast enligt atompositionerna, inte elektronarrangemanget.

Huvudgeometrier (utan ensamma elektronpar):
I en linjär modell är atomerna kopplade i en rak linje, och en bindningsvinkel är helt enkelt den geometriska vinkeln mellan två intilliggande bindningar. En enkel treatomig molekyl av typen ![]() har sina två bindningsorbitaler 180° från varandra. Exempel på triatomära molekyler för vilka VSEPR-teorin förutsäger en linjär form är
har sina två bindningsorbitaler 180° från varandra. Exempel på triatomära molekyler för vilka VSEPR-teorin förutsäger en linjär form är ![]() (som inte har tillräckligt många elektroner för att följa oktettregeln) och
(som inte har tillräckligt många elektroner för att följa oktettregeln) och ![]() . När du skriver ut elektronpunktsformeln för koldioxid, lägg märke till att C-O-bindningarna är dubbelbindningar; detta gör ingen skillnad för VSEPR-teorin. Den centrala kolatomen är fortfarande bunden till två andra atomer. Elektronmolnen som förbinder de två syreatomerna är 180° från varandra.
. När du skriver ut elektronpunktsformeln för koldioxid, lägg märke till att C-O-bindningarna är dubbelbindningar; detta gör ingen skillnad för VSEPR-teorin. Den centrala kolatomen är fortfarande bunden till två andra atomer. Elektronmolnen som förbinder de två syreatomerna är 180° från varandra.

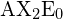 i tabellen.
i tabellen.Trigonal planar
Molekyler med trigonal planar form är triangulära och befinner sig i ett plan, eller en plan yta. En ![]() molekyl som
molekyl som ![]() har tre områden med elektrontäthet som sträcker sig ut från den centrala atomen. Avstötningen mellan dessa kommer att vara minimal när vinkeln mellan två av dem är 120o.
har tre områden med elektrontäthet som sträcker sig ut från den centrala atomen. Avstötningen mellan dessa kommer att vara minimal när vinkeln mellan två av dem är 120o.
Tetraeder
Tetra- betyder fyra, och -hedral avser en yta i ett fast ämne; ”tetraeder” betyder bokstavligt talat ”har fyra ytor”. ”Denna form finns när det finns fyra bindningar på en central atom, utan några ensamma elektronpar. I enlighet med VSEPR-teorin är bindningsvinklarna mellan elektronbindningarna 109,5o. Ett exempel på en tetraedrisk molekyl är metan ![]() . De fyra ekvivalenta bindningarna pekar i fyra geometriskt ekvivalenta riktningar i tre dimensioner, vilket motsvarar de fyra hörnen på en tetraeder med kolatomen i centrum.
. De fyra ekvivalenta bindningarna pekar i fyra geometriskt ekvivalenta riktningar i tre dimensioner, vilket motsvarar de fyra hörnen på en tetraeder med kolatomen i centrum.

En trigonal bipyramidal form bildas när en central atom är omgiven av fem atomer i en molekyl. I geometrin befinner sig tre atomer i samma plan med bindningsvinklar på 120°; de andra två atomerna befinner sig i motsatta ändar av molekylen. Vissa grundämnen i grupp 15 i det periodiska systemet bildar föreningar av typen ![]() ; exempel är
; exempel är ![]() och
och ![]() .
.

Oktaeder
Okta- betyder åtta, och -hedral avser en yta i ett fast ämne, så ”oktaeder” betyder bokstavligt talat ”har åtta ytor”. Bindningsvinklarna är alla 90°, och precis som fyra elektronpar upplever minimal avstötning när de är riktade mot hörnen på en tetraeder, försöker sex elektronpar peka mot hörnen på en oktaeder. Ett exempel på en oktaedrisk molekyl (![]() ) är svavelhexafluorid (
) är svavelhexafluorid (![]() ).
).
https://lab.concord.org/embeddable.html#interactives/jsmol/electron-geometry.json
Interaktivt: Elektrongeometri: Molekyler antar olika former på grund av mönster av delade och odelade elektroner. I dessa exempel delas alla elektroner som påverkar molekylernas form i de kovalenta bindningar som håller ihop atomerna för att bilda molekylerna.
Enliga elektronpar
Obligatoriska elektroner befinner sig i orbitaler som upptar utrymme, stöter bort de andra orbitalerna och ändrar en molekyls form.
LÄRMÅL
Känn igen effekten av ensamma elektronpar på molekylers geometrier.
NÖGRATIGHETER
Nyckelpunkter
- Orbitaler som innehåller de olika bindande och icke-bindande paren i valensskalet kommer att sträcka sig ut från den centrala atomen i riktningar som minimerar deras repulsioner.
- En icke-bindande orbital har ingen atomkärna i sin bortre ände som drar elektronmolnet mot sig. Laddningen i en sådan orbital kommer därför att koncentreras närmare den centrala atomen.
- Nej-bindande orbitaler utövar mer avstötning på andra orbitaler än vad bindande orbitaler gör.
Nyckelbegrepp
- Koordinationsnummer: inom kemi och kristallografi, antalet grannar till en central atom i en molekyl eller kristall
- lone pair: En valensuppsättning av två elektroner som existerar utan bindning eller delning med andra atomer
Molekylära geometrier med lone pair-elektroner
Hostills har vi bara diskuterat geometrier utan några lone pair-elektroner. Som du troligen märkte i tabellen över geometrier och AXE-metoden förändras en molekyls form genom att lägga till ensamma par. Vi nämnde tidigare att om den centrala atomen också innehåller ett eller flera par icke-bindande elektroner kommer dessa ytterligare områden med negativ laddning att bete sig ungefär som de som är förknippade med de bundna atomerna. De orbitaler som innehåller de olika bindande och icke-bindande paren i valensskalet kommer att sträcka sig ut från den centrala atomen i riktningar som minimerar deras ömsesidiga repulsioner.

Koordineringsnummer och den centrala atomen
Koordineringsnummer avser antalet elektronpar som omger en viss atom, ofta kallad den centrala atomen. Geometrierna hos molekyler med ensamstående par kommer att skilja sig från dem utan ensamstående par, eftersom det ensamstående paret ser ut som tomt utrymme i en molekyl. Båda geometriklasserna är uppkallade efter formerna på de imaginära geometriska figurer (oftast regelbundna solida polygoner) som skulle vara centrerade på den centrala atomen och ha ett elektronpar vid varje hörn.
I vattenmolekylen (![]() ) är den centrala atomen
) är den centrala atomen ![]() , och Lewis elektronpunktsformel förutspår att det kommer att finnas två par av icke-bindande elektroner. Syreatomen kommer därför att vara tetraedriskt koordinerad, vilket innebär att den sitter i mitten av tetraedern. Två av koordinationslägena upptas av de delade elektronpar som utgör O-H-bindningarna, och de andra två av de icke-bindande paren. Därför beskrivs
, och Lewis elektronpunktsformel förutspår att det kommer att finnas två par av icke-bindande elektroner. Syreatomen kommer därför att vara tetraedriskt koordinerad, vilket innebär att den sitter i mitten av tetraedern. Två av koordinationslägena upptas av de delade elektronpar som utgör O-H-bindningarna, och de andra två av de icke-bindande paren. Därför beskrivs ![]() -molekylens bindningsgeometri (form) som böjd, även om syreatomen är tetraedriskt koordinerad.
-molekylens bindningsgeometri (form) som böjd, även om syreatomen är tetraedriskt koordinerad.

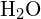 -molekylens bindningsgeometri (form) som böjd.
-molekylens bindningsgeometri (form) som böjd.Den repulsiva effekten av det ensamma elektronparets elektroner
Det finns en viktig skillnad mellan bindande och icke-bindande elektronorbitaler. Eftersom en icke-bindande orbital inte har någon atomkärna i sin bortre ände som drar elektronmolnet mot sig, kommer laddningen i en sådan orbital att koncentreras närmare den centrala atomen; som en följd av detta utövar icke-bindande orbitaler mer avstötning på andra orbitaler än vad bindande orbitaler gör. I ![]() trycker de två icke-bindande orbitalerna de bindande orbitalerna närmare varandra, vilket gör att H-O-H-vinkeln blir 104,5° i stället för den tetraedriska vinkeln på 109,5°.
trycker de två icke-bindande orbitalerna de bindande orbitalerna närmare varandra, vilket gör att H-O-H-vinkeln blir 104,5° i stället för den tetraedriska vinkeln på 109,5°.
Elektronprickstrukturen i ![]() placerar ett par icke-bindande elektroner i kväveatomens valensskal. Detta innebär att det finns tre bundna atomer och ett ensam par för ett koordinationstal på fyra runt kvävet, samma som förekommer i
placerar ett par icke-bindande elektroner i kväveatomens valensskal. Detta innebär att det finns tre bundna atomer och ett ensam par för ett koordinationstal på fyra runt kvävet, samma som förekommer i ![]() .
.

 ..: Det ensamma paret som är knutet till det centrala kvävet skapar bindningsvinklar som skiljer sig från de tetraedriska 109,5 °.
..: Det ensamma paret som är knutet till det centrala kvävet skapar bindningsvinklar som skiljer sig från de tetraedriska 109,5 °.Vi kan därför förutsäga att de tre väteatomerna kommer att ligga i hörnen av en tetraeder centrerad kring kväveatomen. Det ensamma parets orbital kommer att peka mot det fjärde hörnet av tetraedern, men eftersom den positionen kommer att vara vakant kan ![]() -molekylen i sig inte vara tetraedrisk, utan antar istället en pyramidform, närmare bestämt en trigonal pyramid (en pyramid med en triangulär bas). Väteatomerna befinner sig alla i samma plan, med kvävet utanför planet. De icke-bindande elektronerna trycker ihop de bindande orbitalerna något, vilket gör att H-N-H-bindningsvinklarna är ungefär 107°.
-molekylen i sig inte vara tetraedrisk, utan antar istället en pyramidform, närmare bestämt en trigonal pyramid (en pyramid med en triangulär bas). Väteatomerna befinner sig alla i samma plan, med kvävet utanför planet. De icke-bindande elektronerna trycker ihop de bindande orbitalerna något, vilket gör att H-N-H-bindningsvinklarna är ungefär 107°.
I 5-koordinerade molekyler som innehåller ensamstående par kommer dessa icke-bindande orbitaler (som är närmare den centrala atomen och därmed är mer benägna att stötas bort av andra orbitaler) att företrädesvis befinna sig i det ekvatoriala planet. Detta kommer att placera dem i 90° vinklar i förhållande till högst två axialt orienterade bindningsorbitaler. Vi kan därför förutsäga att en ![]() molekyl (en molekyl där den centrala atomen A är koordinerad till fyra andra atomer X och till ett icke-bindande elektronpar) som
molekyl (en molekyl där den centrala atomen A är koordinerad till fyra andra atomer X och till ett icke-bindande elektronpar) som ![]() kommer att ha en ”see-saw”-form.
kommer att ha en ”see-saw”-form.

Om man byter ut icke-bindande par mot bundna atomer kan man reducera den triangulära bipyramidkoordinationen till ännu enklare molekylära former.
https://lab.concord.org/embeddable.html#interactives/jsmol/unshared-electrons.json
Interaktiv: Odelade elektroner och den ”böjda” formen: Använd 3D-modellen för att se hur odelade elektroner stöter bort de delade elektronerna i bindningarna mellan väte och syre, vilket gör att molekylen får en ”böjd” form.
LICENSER OCH ATTRIBUTIONER
CC LICENSERAT INNEHÅLL, DELAD FÖRUT
- Kurering och revidering. Tillhandahålls av: Boundless.com. Licens: CC BY-SA: Attribution-ShareAlike
CC LICENSED CONTENT, SPECIFIC ATTRIBUTION
- VSEPR Theory. Tillhandahålls av: Wikipedia. Ligger på: http://en.wikipedia.org/wiki/VSEPR_Theory. Licens: CC BY-SA: Attribution-ShareAlike
- Molekylär geometri. Tillhandahålls av: Wikipedia. Finns på: Wikipedia: http://en.wikipedia.org/wiki/Molecular_geometry. Licens: CC BY-SA: Attribution-ShareAlike
- VSEPR Theory. Tillhandahålls av: Wikipedia. Finns på: Wikipedia: http://en.wikipedia.org/wiki/VSEPR%20Theory. Licens: CC BY-SA: Attribution-ShareAlike
- Molekylär geometri. Tillhandahålls av: Wikipedia. Finns på: Wikipedia: http://en.wikipedia.org/wiki/Molecular_geometry. Licens: Lagen: Lagen: Lagen: Lagen: Public Domain: Public Domain: Public Domain: Public Domain: Public Domain: Public Domain: Ingen känd upphovsrätt
- VSEPR-geometrier. Tillhandahålls av: Wikimedia. Ligger på: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Licens: CC BY-SA: Attribution-ShareAlike
- Hur man bestämmer molekylär geometri – YouTube. Ligger på:: http://www.youtube.com/watch?v=pA9ML0HVOYE. Licens: Public Domain: Ingen känd upphovsrätt. Licensvillkor: Standard YouTube-licens
- Linjära-3D-bollar. Tillhandahålls av: Wikipedia. Ligger på: http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Licens: CC BY: Attribution
- Molekylär geometri. Tillhandahålls av: Wikipedia. Ligger på: http://en.wikipedia.org/wiki/Molecular_geometry. Licens: CC BY-SA: Attribution-ShareAlike
- VSEPR Theory. Tillhandahålls av: Wikipedia. Finns på: Wikipedia: http://en.wikipedia.org/wiki/VSEPR_Theory. Licens: CC BY-SA: Attribution-ShareAlike
- VSEPR Theory. Tillhandahålls av: Wikipedia. Finns på: Wikipedia: http://en.wikipedia.org/wiki/VSEPR%20Theory. Licens: CC BY-SA: Attribution-ShareAlike
- Molekylär geometri. Tillhandahålls av: Wikipedia. Finns på: Wikipedia: http://en.wikipedia.org/wiki/Molecular_geometry. Licens: Public Domain: Ingen känd upphovsrätt
- VSEPR-geometrier. Tillhandahålls av: Wikimedia. Ligger på: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Licens: CC BY-SA: Attribution-ShareAlike
- Hur man bestämmer molekylär geometri – YouTube. Ligger på:: http://www.youtube.com/watch?v=pA9ML0HVOYE. Licens: Public Domain: Ingen känd upphovsrätt. Licensvillkor: Standard YouTube-licens
- Linjära-3D-bollar. Tillhandahålls av: Wikipedia. Ligger på: http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Licens: CC BY: Attribution
- VSEPR Theory. Tillhandahålls av: Wikipedia. Ligger på: Wikipedia: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_metod. Licens: Public Domain: Ingen känd upphovsrätt
- VSEPR-teori. Tillhandahålls av: Wikipedia. Ligger på: Wikipedia: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_metod. Licens: Public Domain: Ingen känd upphovsrätt
- samordningsnummer. Tillhandahålls av: Wiktionary. Ligger på: http://en.wiktionary.org/wiki/coordination_number. Licens: CC BY-SA: Attribution-ShareAlike
- John Hutchinson, Concept Development Studies in Chemistry. Den 18 september 2013. Tillhandahålls av: OpenStax CNX. Finns på: http://cnx.org/content/m12594/latest/?collection=col10264/latest. Licens: CC BY: Attribution
- Boundless. Tillhandahålls av: Boundless Learning. Beläget på: http://www.boundless.com//chemistry/definition/lone-pair. Licens: CC BY-SA: Attribution-ShareAlike
- Molekylär geometri. Tillhandahålls av: Wikipedia. Finns på: Wikipedia: http://en.wikipedia.org/wiki/Molecular_geometry. Licens: Public Domain: Ingen känd upphovsrätt
- VSEPR-geometrier. Tillhandahålls av: Wikimedia. Ligger på: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Licens: CC BY-SA: Attribution-ShareAlike
- Hur man bestämmer molekylär geometri – YouTube. Ligger på:: http://www.youtube.com/watch?v=pA9ML0HVOYE. Licens: Public Domain: Ingen känd upphovsrätt. Licensvillkor: Standard YouTube-licens
- Linjära-3D-bollar. Tillhandahålls av: Wikipedia. Ligger på: http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Licens: CC BY: Attribution
- VSEPR Theory. Tillhandahålls av: Wikipedia. Ligger på: Wikipedia: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_metod. Licens: Public Domain: Ingen känd upphovsrätt
- VSEPR-teori. Tillhandahålls av: Wikipedia. Ligger på: Wikipedia: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_metod. Licens: Public Domain: Ingen känd upphovsrätt
- VSEPR-teori. Tillhandahålls av: Wikipedia. Ligger på: Wikipedia: http://en.wikipedia.org/wiki/VSEPR_Theory. Licens: Public Domain: Ingen känd upphovsrätt
- Tetrahedral_Structure_of_Water.png. Tillhandahålls av: Wikimedia. Ligger på: https://commons.wikimedia.org/wiki/File:Tetrahedral_Structure_of_Water.png. Licens: Public Domain: Ingen känd upphovsrätt
En kemimodell som används för att förutsäga formen på enskilda molekyler baserat på elektron-par elektrostatisk repulsion
det totala antalet atomer som är direkta grannar till en central atom i en molekyl eller jon
två (ett par) valenceelektroner som inte används för att bilda en kovalent bindning