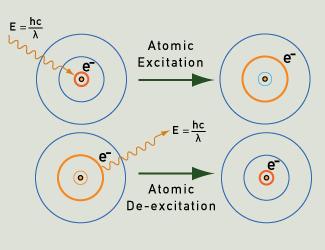
Ljusfotoner avges när en elektron sjunker tillbaka till sitt grundtillstånd efter att ha blivit exciterad.
Flamtester
Flamtester är användbara eftersom gasanordningar ger upphov till ett signaturspektrum av linjeemission för ett grundämne. I jämförelse producerar glödgning ett kontinuerligt ljusband med en topp som är beroende av det varma objektets temperatur.
När atomerna i en gas eller ånga exciteras, t.ex. genom uppvärmning eller genom att applicera ett elektriskt fält, kan deras elektroner förflytta sig från sitt grundtillstånd till högre energinivåer. När de återvänder till sitt grundtillstånd och följer klart definierade banor enligt kvantsannolikheter, avger de fotoner med mycket specifik energi. Denna energi motsvarar särskilda våglängder i ljuset och ger upphov till särskilda ljusfärger. Varje grundämne har ett ”fingeravtryck” i form av sitt linjeemissionsspektrum, vilket illustreras av exemplen nedan.

Linjespektrum för väte.

Linjespektrum för helium.

Linjespektrum för neon.
Då varje grundämne har ett exakt definierat linjeemissionsspektrum kan forskarna identifiera dem genom färgen på den låga de producerar. Koppar ger till exempel en blå flamma, litium och strontium en röd flamma, kalcium en orange flamma, natrium en gul flamma och barium en grön flamma.

Denna bild illustrerar de distinkta färger som produceras vid förbränning av vissa grundämnen.

En låga från en oxyacetylenbrännare brinner vid över 3000?C, tillräckligt varmt för att kunna användas för svetsning under vatten.
Flamman
Färgen säger oss något om temperaturen hos en ljuslåga. Ljusflammans inre kärna är ljusblå, med en temperatur på cirka 1670 K (1400 °C). Det är den hetaste delen av lågan. Färgen inuti lågan blir gul, orange och slutligen röd. Ju längre bort du kommer från flammans centrum, desto lägre blir temperaturen. Den röda delen ligger runt 1070 K (800 °C).
De orange, gula och röda färgerna i en låga har inte bara med färgtemperaturen att göra. Gasens excitationer spelar också en stor roll för flammans färg. En av de viktigaste beståndsdelarna i en brinnande låga är sot, som har en komplex och varierad sammansättning av kolföreningar. Variationen av dessa föreningar skapar ett praktiskt taget kontinuerligt utbud av möjliga kvanttillstånd till vilka elektroner kan exciteras. Färgen på det ljus som avges beror på den energi som avges av varje elektron som återgår till sitt ursprungliga tillstånd.