- Bakgrund
- Normal fysiologi och patofysiologi för kalium
- Aktionspotential hos en kardiomyocyt utan pacemaker
- Aktionspotential hos en pacemakercell i hjärtat
- Strömledningsförmåga
- Refraktärperiod
- Hyperkalemi, klassificering och orsaker
- Klassificering
- Causer
- Effekter av hyperkalemi
- Metaboliska effekter
- Natrium-kalium-pump
- Slutsats
Bakgrund
Kalium är en mjuk, silvervit och mycket reaktiv katjon som tillhör gruppen alkalimetaller i det periodiska systemet. Det är den mest förekommande katjonen i människokroppen som helhet och den mest utbredda jonen i dess intracellulära avdelningar.
En västerländsk kost innehåller i genomsnitt 80-100 mEq kalium per dag, och under normala fysiologiska förhållanden absorberas 90 % av kalium passivt, vilket lämnar endast 9,0 mmol för fekal utsöndring. De 3500-4000 mmol som lagras i kroppen är oproportionerliga i förhållande till de dygnsmässiga kaliumnivåerna i plasma som normalt hålls inom intervallet 3,5-5,3 mmol/L genom en stram homeostasmekanism med de lägsta nivåerna på natten och tidigt på morgonen och de högsta toppnivåerna på eftermiddagen.
När det väl har absorberats i blodomloppet blir det njurens uppgift att matcha kaliumintaget med kaliumuttaget, vilket kräver flera timmar, under vilken tid den ”interna kaliumbalansen” under påverkan av insulin och katekolaminer upprätthåller en tillfällig homeostas genom att flytta kalium mellan de intracellulära och extracellulära utrymmena. Stimulering av alfa-receptorerna försämrar kaliuminträdet i cellerna och stimulering av betareceptorerna främjar det genom att aktivera natrium-kalium-ATPas-pumpen.
Natrium-kalium-ATPas-pumpen är det gate-keeper-enzym som finns i sarkolemma. Det bidrar till att skydda 98 % av det kalium (cirka 144,0 mmol) som hålls kvar i cellen. Detta säkerställer bevarandet av den vitala potentialskillnaden över cellmembranen som behövs för en korrekt cellfunktion, särskilt de excitabla cellerna såsom nervceller och hjärtmuskelceller.
Normal fysiologi och patofysiologi för kalium
Efter sitt snabba upptag hjälper kalium till att orkestrera sina egna kroppsnivåer genom frisättning av insulin och aldosteron. Andra inneboende kroppsstimuli som också visat sig styra kroppens kaliumnivåer är beta-2 adrenergiska receptorer, alkaliskt blod PH och cellulär anabolism.
Framställning av insulin och aldosteron: Kalium som intagits går snabbt in i cirkulationen. När det når portalcirkulationen stimulerar det bukspottkörteln att frisätta insulin. Samtidigt leder det cirkulerande kaliumet som når de juxtaglomerulära cellerna till frisättning av renin. När renin når levern omvandlas det till angiotensin I. Angiotensin I går till lungorna där det omvandlas till angiotensin II. Angiotensin II fullbordar sedan sin resa tillbaka till njurarna genom det cirkulerande blodet för att stimulera zona glomerulosa att utsöndra aldosteron.
Intern kaliumbalans: Det insulin som frisätts postprandiellt verkar främst på skelettmuskulaturen och aktiverar två vägar, den AKT-beroende vägen som ansvarar för insättning av glukostransportören GLUT4 och APK-vägen som aktiverar det cellulära natriumkalium ATPaset för att flytta kalium till det intracellulära utrymmet. Till skillnad från den AKT-beroende vägen är APK-vägen inte försämrad av varken metaboliskt syndrom eller kronisk njursjukdom (figur 1).
Utsöndring: Kalium som filtreras av njurarnas glomeruli reabsorberas passivt i proximala tubuli och Henle-slingan i proportion till den mängd natrium och vatten som tillförs. Normalt når endast cirka 10 % av den filtrerade belastningen det distala nefronet.
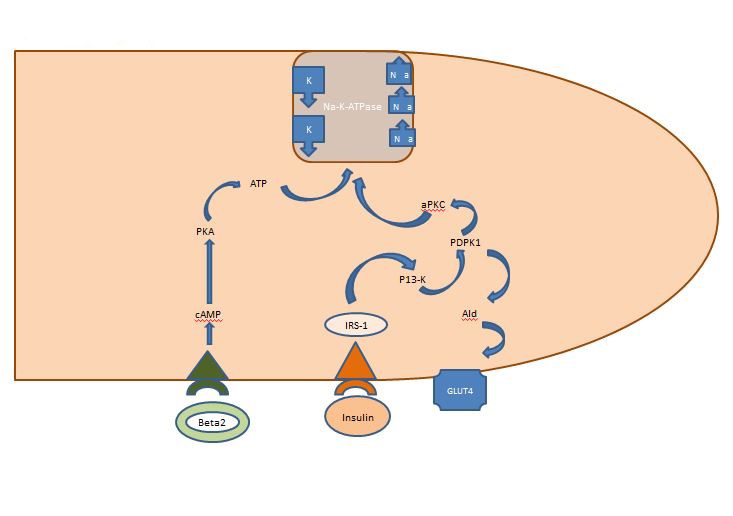
Figur 1. Insulinets verkan på en skelettmuskelcell. Insulin som frisätts postprandiellt aktiverar två vägar i skelettmuskulaturen, den AKT-beroende vägen som ansvarar för insättning av glukostransportören GLUT4 och APK-vägen som aktiverar det cellulära natriumkalium ATPaset för att flytta kalium till det intracellulära utrymmet.
I början av den distala konvoluterade tubulären börjar utsöndringen av överskottskalium och ökar progressivt när det rör sig längre fram mot det distala nefronet och in i collecting duct. Detta medieras av en uppreglering av vätekalium ATPas på de alfa-interkalerade cellerna .
Närvaron av högre kaliumnivåer i de peritubulära cellerna i njurarna aktiverar RAAS-systemet för att frigöra aldosteron, vilket aktiverar natriumkalium ATPaset i det basolaterala membranet, vilket resulterar i en minskning av det intracellulära natriumet, vilket leder till ökad elektrogen transport av kaliumupptag genom att membranspänningen hyperpolariseras och möjliggör dess utsöndring i urinen .
I hyperkalemi kan kvoten av kalium som utsöndras via tjocktarmen öka med upp till 30 %, t.ex, vid njursvikt, där kaliumet sedan aktivt tas upp av den aktiverade natriumkalium ATPas-pumpen i kolonens enterocyters basolaterala membran, för att utsöndras på andra sidan, i kolonens lumen genom cellernas apikala stora kalciumberoende kaliumkanaler.
Det framgår således av ovanstående att mekanismen för homeostas av kaliumplasmanivån huvudsakligen bestäms av samspelet mellan tre samtidiga transaktioner – kaliumintag, kalium intra/extracellulära förskjutningar och kaliumurinutskiljning, som alla i slutändan är beroende av natriumkaliumpumpen.
För att förstå mekanismen för den överhängande faran från hyperkalemi och dess hantering måste man förstå aktionspotentialens fysiologi och natriumkalium ATPase-enzymets inre.
Aktionspotentialens elektrofysiologi, dvs, Jonisk rörelse genom cellmembranen bestäms av skillnaden mellan två potentialer, en ”kemisk potential” där jonerna rör sig nedåt i sin koncentrationsgradient och en ”elektrisk potential” där joner och molekyler stöter bort likadana laddningar, vilket ger transmembranpotentialen (TMP), som sägs vara +ve när nettorörelsen av +ve-joner är till utsidan av cellen och vice versa.
Aktionspotential hos en kardiomyocyt utan pacemaker
Det finns fem faser i en aktionspotential, som börjar och slutar vid fas 4. De pumpar som är involverade i denna process är bland annat sarkolemma natriumkalciumväxlaren, kalcium ATPaset och slutligen natriumkalium ATPaset.
- Fas 4. Vilofasen: Denna har en vilopotential på -90 mV som ett resultat av den konstanta utåtriktade rörelsen av kalium via inåtriktade likriktarkanaler. Under denna fas är både natrium- och kalciumkanalerna stängda.
- Fas 0. Depolarisationsfasen: Avfyrningen av en pacemakercell eller dess ledning genom en granncell utlöser en ökning av TMP till över -90 mV. Vid denna tidpunkt börjar de ”snabba natriumkanalerna” att öppnas en efter en, vilket gör att natrium kan tränga in i cellen, vilket höjer TMP, och när tillräckligt många snabba natriumkanaler har öppnats för att ge -70 mV, sätts en självbärande inåtriktad natriumström i gång, TMP depolariseras snabbt till 0 mV under en tillfällig övergångstid som kallas ”overshoot”, varefter de tidsberoende snabba natriumkanalerna stängs och de ”långöppnande” kalciumkanalerna öppnas för att höja TMP till -40 mV och möjliggöra ett litet stadigt kalciuminflöde längs dess koncentrationsgradient.
- Fas 1. Den tidiga repolariseringsfasen: Den börjar med den svagt +ve TMP och den korta öppningen av vissa kaliumkanaler som resulterar i att det flödar ut till utsidan av cellen, vilket återför TMP till ungefär 0 mV.
- Fas 2. Plateaufasen: Här är de två motströmmarna elektriskt balanserade och resulterar i att TMP hålls balanserad strax under 0 mV. ”De sedan länge öppna kalciumkanalerna” är fortfarande öppna, vilket resulterar i ett konstant kalciumflöde in i cellen. Den fördröjda likriktarkaliumkanalen möjliggör passage av kalium till cellens utsida längs dess koncentrationsgradient.
- Fas 3. Repolariseringsfasen: Under denna fas inaktiveras kalciumkanalerna gradvis och det ihållande flödet av kalium till cellens utsida överstiger således det inkommande kalciumflödet, vilket återför kalium till det intracellulära utrymmet och natrium och kalcium till cellens utsida.
Aktionspotential hos en pacemakercell i hjärtat
Hjärts pacemakercellerna har en medfödd automatik, som gör det möjligt för dem att depolarisera i rytmiska cykler. Den sinoatriella noden (SAN) har den högsta självinitierade depolariserande rytmen med en hastighet på 60-90/min, följt av den atrioventrikulära noden (AVN) med en hastighet på 40-60/min och därefter Purkinjefibrerna och ventrikelmuskeln med en hastighet på 20-40/min.
Pacemakercellernas membranpotentialer är instabila och deras aktionspotentialer har inga klart avgränsade faser. De har färre inåtriktade kaliumkanaler och deras TMP sjunker aldrig till under -60 mV, vilket eliminerar rollen för de snabba natriumkanalerna som kräver en TMP på -90 mV vilket resulterar i avsaknaden av den snabba depolarisationsfasen.
Vid TMP >-60 mV sätts ”funny/pacemaker”-strömmen igång med ett spontant jonflöde genom de långsamma natriumkanalerna, vilket depolariserar TMP till <-50 mV och sedan tillbaka till -60 mV när kalciumkanalerna stänger sig.
Strömledningsförmåga
Alla kardiomyocyter är elektriskt sammankopplade genom gap junctionen, inklusive pacemakercellen. Detta underlättar den utbredda depolariseringen av alla närliggande celler, vilket gör hjärtat till en funktionell enhet där cellen med den högsta inneboende hastigheten blir ”pacemaker”.
Refraktärperiod
Den längre refraktärperioden under den långa platån i fas 2 på grund av de långsamma kalciumkanalerna ger den tid som behövs för att tömma ventriklarna fullständigt innan nästa kontraktion. Refraktärperioderna kan vara absoluta (ARP), effektiva (ERP) eller relativa (RRP). I en ARP är cellen absolut oaktiverbar.
En ERP varar från ARP till det korta segmentet av fas 3. Ett stimulus vid denna punkt kan minimalt depolarisera cellen, men depolarisationsnivån är svagare än att propagera en aktionspotential till granncellerna.
RRP framkallas av ett stimulus över det normala, vilket leder till depolarisering av cellen och produktion av en aktionspotential.
En ”supra-normal period” är ett hyperexcitabelt tillstånd under vilket ett svagare stimulus än normalt kan leda till en arytmi, vilket kräver synkronisering under kardioversion för att undvika kammarflimmer (figur 2).
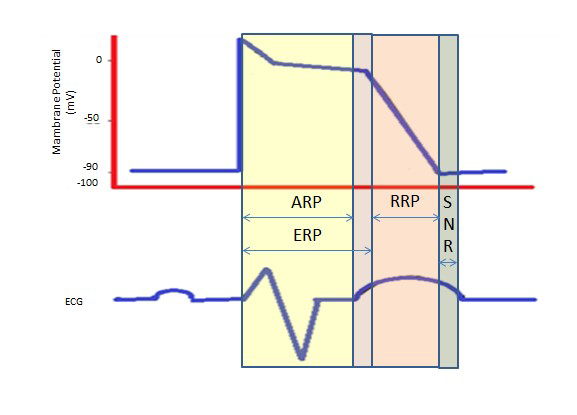
Figur 2. Refraktära perioder. ARP: Absolut refraktärperiod; ERP: Effektiv refraktärperiod; RRP: Relativ refraktärperiod; SNR: Supranormal refraktärperiod
Hyperkalemi, klassificering och orsaker
Klassificering
Hyperkalemi klassificeras som lindrig när nivåerna ligger i intervallet 5,5-6,0 mmol/L, måttlig från 6,1-6,9 mmol/L och svår vid nivåer på 7.0 mmol/L eller högre, och vid alla nivåer där EKG-förändringar uppstår .
Causer
Hyperkalemi uppstår när kompensationsmekanismerna inte längre klarar av att hantera obalansen, vilket är anledningen till att den vanligen är multifaktoriell.
- Ökning av intaget av kalium via någon väg, t.ex, kostintag via munnen, eller intravenös administrering av kaliumhaltiga vätskor som penicillin G.
- Retention genom njurarna: Eftersom kaliumutsöndringen är beroende av aldosteron och tillförsel av en tillräcklig distal mängd natrium och vatten i nefronerna, kan tillstånd som njursvikt, binjureinsufficiens (Addisons sjukdom) , hyporeninemisk hypoaldosteronism typ IV, renal tubulär acidos, särskilt hos patienter med diabetisk nefropati, samt alla tillstånd som främjar hypoperfusion, t.ex. volymdepletion och hjärtsvikt, kommer att påverka den intrikata balansen av kalium i kroppen och leda till hyperkalemi.
- Adrenalinsufficiens: Detta måste uteslutas hos hyperkalemiska patienter, särskilt i närvaro av hyponatremi och muskelsvaghet. För att screena för primär binjurebarksinsufficiens utförs ett standard cosyntropinstimuleringstest där 0,25 mg syntetiskt cosyntropin ges som en intravenös bolus följt av plasmakortisolmätning 45 minuter till 1 timme senare. Värden under 20 mcg/dL tyder på binjurebarksinsufficiens.
- Läkemedel som behåller kalium: Receptbelagda läkemedel som minskar natriumkalium ATPase-aktiviteten såsom beta-adrenerga receptorblockerare och läkemedel som minskar aldosteronutsöndringen såsom ACE- och ARB-hämmare, icke-steroida antiinflammatoriska läkemedel och kaliumsparande diuretika, kräver noggrann uppföljning för att undvika iatrogen hyperkalemi, särskilt i den geriatriska åldersgruppen med deras progressiva försämring av njurfunktionen som en del av åldrandeprocessen.
- Störningar i det transcellulära skiftet av kalium: Detta kan inträffa vid förhållanden med acidos, hyperglykemi, hyperosmolalitet, hård träning, vävnadsnedbrytning, hyperkalemisk periodisk paralys och med beta-adrenerga blockerare. För varje 0,1 enhets minskning av PH i blodet ökar serumkalium med ca 0,6 mmol/L (mindre om acidosen orsakas av organiska syror) .
- Pseudo-hypoaldosteronism är en medfödd autosomalt recessiv sjukdom där njurarna är motståndskraftiga mot aldosteronets verkan.
- Pseudo-hyperkalemi får inte heller förbises: som namnet antyder uppstår detta när det finns förhöjt serumkalium i närvaro av normalt plasmakalium. Det kan ses vid hemolyserat blod, långvarigt stramt tourniquet under en blodprovstagningsprocedur, vilket orsakar extracellulär frisättning av kalium, vid upprepad knytning av knytnäven under flebotomi, traumatisk venpunktion, vid leukocytos och trombocytos samt vid vissa ovanliga genetiska syndrom som familjär pseudo-hyperkalemi och hereditär sfärocytos. Det kan dock helt enkelt bara vara ett resultat av ett enkelt laboratoriefel.
Effekter av hyperkalemi
Mild hyperkalemi är ofta asymtomatisk och upptäcks oavsiktligt med hjälp av laboratorietester på grund av dess vaga symtom som illamående, muskelsvaghet och parestesi. Svår hyperkalemi påverkar den neuromuskulära funktionen i form av skelettmuskelsvaghet och förlamning; detta är dock inte en frekvent presentation eftersom den kardiella toxiciteten dominerar bilden och är den preliminära presentationen. Kardialtoxicitet kommer vanligtvis att presentera sig på EKG på följande stegvis eskalerande sätt, även om det inte nödvändigtvis är så, beroende på etiologin:
- Vid nivåer över 5,5 mEq/L ökar ökningen av kaliumkanalernas konduktans lkr-strömmen, vilket leder till snabb repolarisering i form av en toppad T-våg på yt-EKG:
- . Dessa T-vågor kan särskiljas från dem vid hjärtinfarkt och CVA genom sin korta varaktighet på 150-250 msek.
- Vid kaliumnivåer över 6,5 mEq/L uppstår ett tillstånd av ihållande subtröskeldepolarisering, vilket orsakar en fördröjning av förmaks- och ventrikeldepolariseringen. Minskningen av aktionspotentialens fas 0 leder till en längre aktionspotential, vilket ger en fördröjning av den intraventrikulära och atrioventrikulära ledningen. På yt-EKG:n kommer detta att visa sig genom en utplaning och förlust av P-vågor och en breddning av QRS-komplexen. Med ökande fördröjning av den intraventrikulära ledningen börjar yt-EKG:t visa tecken på vänster och höger grenblock. Detta kan särskiljas från buntledarsjukdom genom att fördröjningen vid hyperkalemi kvarstår i hela QRS-komplexet, inte bara under de inledande respektive avslutande delarna.
- Vid 10 mEq/L sker inte längre sinoatriell konduktion och den accelererande junktionella rytmen tar över. Ventrikulära arytmier utvecklas med sammansmältning av de vidgade QRS-komplexen med T-vågorna för att så småningom bilda det klassiska sinusvågsmönstret. När detta inträffar är VF och asystoli överhängande och hjärtstillestånd följer.
- Undertiden kan förändringarna vara oberäkneliga och oförutsägbara och EKG hoppar från normalt till asystoli på grund av variabiliteten i de etiologiska faktorerna och deras inflytelserika effekter, t.ex. kaliumförändringshastigheten, kalciumkoncentrationen, pH och natriumkoncentrationen. Hyperkalemi bör därför behandlas akut när kaliumnivåerna blir högre än 6,5 mmol/L, eller i närvaro av EKG-manifestationer av hyperkalemi oberoende av kaliumnivån. Andra rapporterade samband med akut hyperkalemi är bland annat: bild av pseudo MI på EKG-inspelningen, med massiva ST-T-segment som ett resultat av störningar i myocyternas repolarisering, korta PR- och QT-intervall, sinustakykardi, sinusbradykardi, idioventrikulär rytm, 1:a och 2:a gradens hjärtstillestånd .
Metaboliska effekter
Hyperkalemi leder till hyperkloremisk metabolisk acidos eftersom hyperkalemi främjar det intracellulära upptaget av kalium i utbyte mot vätejoner. Detta skapar en intracellulär alkalos som undertrycker njurarnas ammoniakproduktion i de proximala tubuli, vilket leder till en minskning av ammonium- och syrautsöndringen i urinen och en renal tubulär acidos av typ IV .
Natrium-kalium-pump
Natrium-kalium-ATPaset upptäcktes 1957 av Skou, som senare tilldelades en del av 1997 års Nobelpris i kemi för sin upptäckt.
Skou var den förste som upptäckte natrium-kalium-ATPaset i sarkolemma i hjärtmusklernas cellyta. Dess närvaro upptäcktes senare i alla eukaryota en- och flercelliga organismer.
Natrium-kalium-pumpen fungerar genom att koppla hydrolysen av ATP till den cellulära exporten av tre natriumjoner i utbyte mot två kaliumjoner mot deras elektrokemiska gradienter. Den är det molekylära målet för digitalis och digoxin, som har använts sedan 1700-talet som fingerborgsextrakt.
Natriumkaliumpumpens verkan regleras av ett fosfoprotein, fosfoflemman, vars ofosforylering leder till att pumpen hämmas och vars fosforylering leder till en ökning av pumpens aktivitet. Den har tre fosforyleringsställen, två palmitoyleringsställen och ett glutathionyleringsställe, vilket förklarar den mängd signaler som kan stimulera och hämma pumpen.
Natriumkaliumpumpen i sig är ett enzym som består av flera underenheter med flera isoformer. Närvaron av alfa- och beta-underenheterna (främst B1 i hjärtat) är nödvändig för dess funktion. Nyligen har en tredje protein gamma-underenhet identifierats i njurarna, men dess funktion är hittills okänd.
Alfa-underenheten är den katalytiska kärnan i natriumkaliumpumpenzymet. Den är cirka 100 kDa och innehåller bindningsställen för natrium, kalium, ATP och kardiotoniska steroider som ouabain. Endast alfa 1 och alfa 2 uppvisar en betydande närvaro i en normal hjärtmuskelcell och är funktionellt kopplade till natriumkalciumbytaren (NCX). Alfa 3 har rapporterats ersätta alfa 2 i experimentella modeller för hjärtsvikt.
Data från nyligen genomförda experiment talar för att både alfa 1 och alfa 2 underenheter av pumpen är inblandade i regleringen av excitation-kontraktionskopplingen (E-C). Alfa 1, som visade sig vara mer jämnt fördelad över sarkolemman, tros spela mer av en ”hushållsroll” och kontrollera både kontraktilitet och den intracellulära massan natrium, medan alfa 2 vars uttryck är koncentrerat i T-tubuli tillsammans med andra nyckelkomponenter i E-C-kopplingen tros främst fokusera på kontraktilitet .
Kända faktorer som kan styra natrium-kalium-pumpen är bland annat: ATP, intracellulärt natrium, sub-sarcolemmala barriärer och fuzzy spaces, membranpotential, intracellulära signalvägar (adrenerga signalvägar, proteinkinas A & C, kväveoxid, fosfolemman), direkt reglering av små molekyler (lipider, endogena kardiotoniska steroider), andra associerade proteiner (caveolae och caveoliner, och ankyrin).
Slutsats
Hyperkalemi är en klinisk utmaning och kan förekomma hos upp till 10 % av sjukhusvårdade patienter . Dess slutresultat är livshotande. Eftersom alla celler i kroppen i slutändan påverkas av natriumkaliumpumpen och ischemiska hjärtmuskler är kända för att extrudera sitt kalium extracellulärt vilket leder till en sänkning av arytmietröskeln med möjlighet till ventrikulära arytmier som förvärrar hypopolariseringen och sänker tröskeln ännu mer, måste fler studier inriktas på manipulering av natriumkaliumenzymet, eftersom dess kontroll gynnsamt skulle kunna förändra utfallet av hjärtstillestånd och omskriva de nuvarande riktlinjerna för HLR.