Interaktioner mellan hjärnan och koagulationsprocessen har en lång historia, inklusive observationen att koagulationsmekanismen i det centrala nervsystemet har ett antal skillnader från den som finns i andra organ – hjärnans endotel uttrycker till exempel lite trombomodulin.
Oavsett mekanismen är det svårt att undvika observationen att behandling med antikoagulation (t.ex, med heparin med låg molekylvikt) ofta dramatiskt reverserar symptomen, inklusive migrän, minnessvårigheter och chorea. Sådana observationer tyder på att hjärnans patologi i många fall kanske inte är så mycket infarkt, utan mer kan relatera till ”slamning” av blodtillförseln och försämrad syresättning.
Migrän &Slagan
”Led du av huvudvärk som tonåring?”
”Ja, doktorn. De var nästan veckovis under en tid. De försvann under några år, men de kom tillbaka med en våldsam kraft nu. De finns i min familj.”
Så talar den 30-åriga kvinnliga patienten med APS (de manliga familjemedlemmarna förekommer mer sällan på APS-kliniker).
Detta är en så viktig diagnostisk ledtråd vid bedömningen av en patient med eventuell APS. Men trots många års erfarenhet av APS finns det förvånansvärt få uppgifter som bedömer APS verkliga roll i den bredare världen av migrän. Det finns så många anledningar att studera sambandet – svaret på antikoagulation – vanligtvis bra, ofta slående – studiet av syskon och andra familjemedlemmar till migrän/APS-patienter. Och framför allt de kopplingar som nu rapporteras mellan migrän och stroke.
APS/Hughes syndrom är i hög grad ett neurologiskt tillstånd. Hjärnfunktionen verkar vara särskilt drabbad – ju fler APS-patienter man träffar, desto bredare & bredare sprider sig de neuropsykiatriska vågorna.
Likt migrän är stroke en av de erkända komplikationerna av APS/Hughes syndrom. Siffror så höga som 1 av 5 unga strokepatienter (under 45 år) som har positiva aPL-test har rapporterats.14-19
Men liksom för migrän är erkännandet av aPL i etiologin för stroke i allmänhet fortfarande dåligt. Till exempel är stroke hos barn – som är välkänd kliniskt – ett utmärkt mål för aPL-studier.
För några år sedan lanserade Storbritanniens regering ett stort stroke-initiativ, där man utbildade allmänheten om symtom, tecken och behandling av stroke. Antifosfolipidsyndromet fanns inte med på listan.
Kramper
1985 observerade vi att hos lupuspatienter var kramper vanligare hos de patienter som hade positiva aPL-tester.20 Sedan dess har det blivit tydligt att epilepsi, i alla dess former, är en viktig följeslagare till APS. Så pass mycket att i en studie av idiopatisk epilepsi hos tonåringar visade sig 1 av 5 vara aPL-positiv.21

Den första screeningen hos barnmorskan eller förlossningsläkaren bör inkludera ett enkelt frågeformulär för att utesluta APS.
Bildkredit: SPL/Science Source
Förgreningarna av dessa observationer är många. Låt mig ge två kliniska exempel:
För det första kan temporallobsepilepsi vid APS vara underkänd. En av mina patienter, en kvinna med klassisk APS, blev EEG-tekniker. Under sin utbildning använde hon fyra av sina syskon som försökskaniner. Tre av dem hade onormal aktivitet i temporalloben. Det är intressant att se hur ofta en familjehistoria av epilepsi dyker upp i anamnesen hos patienter med APS.
Den andra kliniska anekdoten har publicerats på annat håll.22 En 42-årig patient hade en tidigare historia av mild lupus. Hennes största problem – som hade en betydande inverkan på hennes hektiska liv – var dock återkommande anfall, både petit mal och grand mal, där det senare krävde specialistvård och en kombination av ett antal antiepileptiska läkemedel. Under sin vistelse i London utvecklade hon en DVT (hon visade sig vara aPL-positiv), och rutinmässig antikoagulation med warfarin påbörjades. En omedelbar och oväntad bonus var en markant minskning av anfallens frekvens och svårighetsgrad, vilket krävde mycket mindre aggressiv antiepileptisk behandling.
”THE STILLBIRTH SCANDAL: Varje dag dödföds så många som tre barn i Storbritannien som kunde ha levt. En av 200 förlossningar av brittiska kvinnor kommer att vara dödfödd. Det är dags för NHS att anpassa sig till en ny politik och en ny attityd. -The Times (London), 28 november 2012
Minnesförlust
Den kanske vanligaste manifestationen av APS är minnesförlust. Ofta ser problemet bara dagens ljus när patienten tillfrågas om symptomet. Så många patienter erkänner att de oroar sig för Alzheimers sjukdom. Hittills finns det få detaljerade kliniska studier. Då och då, och det måste sägas att det är ganska oansenligt, har vi utfört psykometriska tester på utvalda APS-patienter – och resultaten har ofta varit överraskande. Ännu mer med tanke på den slående förbättring som ses i minnestester när antikoagulation påbörjas.23
Multipel skleros
Med tanke på den framträdande roll som neurologiska särdrag, inklusive synstörningar och fluktuerande myelopati, spelar vid APS, är det inte förvånande att ett antal fall diagnostiseras som MS.24,25
Ärenden är långt ifrån okomplicerade. Vissa inom neurologin förklarar att positiva aPL-test faktiskt ibland ses vid klassisk MS. Jag skulle föredra att vända på bilden. Sådana patienter, åtminstone vissa, kan vara APS i första hand och MS i andra hand. Även om ett antal sådana fall anekdotiskt sett svarar på antikoagulation, är svaret i andra fall i bästa fall gränslöst. Uthman har nyligen gått igenom den ganska omfattande litteraturen om APS kontra MS.26
Andra neurologiska egenskaper
Dessa inkluderar balansproblem (ett antal fall som presenteras som Meniere’s), chorea (ibland allvarlig),27,28 anosmi, sömnstörningar (inklusive kataplexi och narkolepsi) och, på senare tid, autonoma störningar med en rad fall av POTS (posturalt ortostatiskt takykardisyndrom).29
En av de frågor som det råder debatt om är förekomsten av psykiatriska manifestationer.
Det har varit min uppfattning att akut psykos har varit mer ett kännetecken för lupus än för APS, men i detta kan jag ha fel. En av mina patienter, en kvinna med APS och OCD (tvångssyndrom), förbättrades med antikoagulationsbehandling. Intressant nog fann hennes tonårige son, också en patient med OCD (och aPL-positiv), att de neuropsykiatriska manifestationerna var mycket mindre framträdande när aspirinbehandlingen påbörjades.
Not the Brain
Bone & joints-Har du drabbats av några frakturer? En fråga som kanske inte ingår i den rutinmässiga anamnesen hos APS-patienter. Och ändå börjar spontana benfrakturer bli välkända efter rapporten om 27 spontana metatarsalfrakturer av dr Shirish Sangle hos APS-patienter.30
Anekdotiska rapporter tyder på att (ischemiska) benfrakturer kan vara en viktig manifestation av sjukdomen: Min kollega, professor Munther Khamashta, har en patient med Hughes syndrom med normala DEXA- och bisköldkörtelundersökningar som har haft 57 spontana frakturer. Detta är helt klart ett viktigt område för klinisk forskning.
Liksom avaskulär nekros (AVN) är höftsmärta inte ovanlig hos våra APS-patienter. MRT har visat tidig AVN i vissa fall utan andra riskfaktorer, t.ex. steroider. Mitt kliniska intryck är att höftsmärtan ofta förbättras när heparin eller warfarin sätts in.
Hjärt – Ett stort bekymmer är förekomsten av angina pectoris och andra hjärtsymtom vid APS. Trots ett fåtal tidiga rapporter om myokardiell ischemi och kranskärlstrombos är det först på senare år som publikationer som avslöjar en hög frekvens av dessa komplikationer har ökat i frekvens.
Två exempel är Greco et al:s forskning som visar på en relativt hög prevalens av positiva aPL-test hos patienter med kardiell ischemi och den slående observationen att rökande kvinnor som tog p-piller och som var aPL-positiva hade en relativ risk 22 gånger högre för att drabbas av en myokardieinfarkt.31,32
De kardiella kopplingarna ökar genom rapporteringen av ett samband med hjärtsyndrom X, angina pectoris med normala kranskärlsangiografier.33 Det är en rimlig gissning att aPL-testning kommer att bli en standard på kardiologkliniken, särskilt hos symtomatiska kvinnor under 40 år.
Likt migrän är stroke en av de erkända komplikationerna till APS/Hughes syndrom. Siffror så höga som 1 av 5 unga strokes (under 45) som har positiva aPL-test har rapporterats.
GI tract & liver-Sedan vi gjorde våra observationer om fokala stenotiska lesioner i olika artärer, inklusive celiac- och mesenterialartärer, har vi fokuserat mer på symtom på abdominal angina hos patienter med aPL/APS.34 Detta är ett svårt tillstånd att kvantifiera, men vi har sett ett antal fall där klopidogrel eller heparin har resulterat i en förbättring (ibland markant) av den postprandiala smärtan.
Och även om leverpåverkan vid lupus är sällsynt, ses ofta onormala leverfunktionstester vid APS. Även om dessa kan förebåda allvarliga levertromboser, såsom Budd-Chiari syndrom eller HELLP-syndromet vid graviditet som varnar för hotande katastrofal APS, har de oftare en mer godartad prognos.35,36
En mycket positiv fallbeskrivning: I början av 1980-talet träffade jag en tonårsflicka med DVT, positiv aPL och Budd-Chiari syndrom.
Dålig prognos?
Drygt trettio år senare mår hon fortfarande bra, med försiktigt livslångt warfarin som sköts av hennes läkare i Portugal.
Goldblatts sjukdom, njuren & APS-Renal artärstenos, som ses på en tydlig bakgrund av annars normala artärer, kan efterlikna Goldblatts tidiga observationer av utvecklingen av hypertoni hos djur med experimentellt ockluderade njurartärer. Sangles upptäckt av njurartärens stenos lokaliserade lesioner ledde till liknande fynd i andra kärl, vilket ledde till teorier om lokaliserad trombotisk/endotelisk patologi.37
Hud: livedo reticularis, en gåta – Även om hudsår, dilaterade vener och subunguala splitterblödningar är välkända följder av hudtrombos vid APS, har livedo reticularis en aura av gåta.38,39
Diagnostiskt sett är dess närvaro en viktig ledtråd hos patienter som misstänks ha Hughes-syndromet – inklusive seronegativ APS.
Om man ser tillbaka på några av de tillstånd som nämns i denna artikel – MS, migrän, multipla frakturer, minnesproblem – kan man till exempel fråga sig om en noggrann notering av närvaron eller frånvaron av livedo skulle kunna visa sig vara betydelsefull i differentialdiagnosen av dessa tillstånd.
En sak är säker: Närvaron av livedo ger en extra dimension till den kliniska bildens svårighetsgrad.
Graviditet
Som rubrik för syndromet är förstås graviditeten, där andelen friska förlossningar vid aPL-positiva graviditeter har stigit från under 15 % till över 90 %. Utan tvekan har diagnos och behandling av dessa fall inneburit ett betydande framsteg inom förlossningsmedicinen.40
Syndigt nog har alla vi som arbetar med APS tagit hand om aPL-positiva patienter (varav en del hade drabbats av tidiga missfall) som förlorat ett barn sent under graviditeten. Dödsfall.
För två år sedan publicerade The Times of London en ledarartikel med titeln ”The Stillbirth Scandal”, där man lyfte fram de dåliga siffrorna för dödfödda barn i Storbritannien.41 Ändå kunde vissa fall av dödfödda barn hos de aPL-positiva kvinnorna ha förhindrats. En nyligen genomförd studie från Utah visade till exempel att aPL-graviditeter hade en tre- till femfaldigt ökad risk för dödfödsel.42
Kulle mer rutinmässig aPL-testning under graviditeten kunna hjälpa? Kostnadsöverväganden gäller. Missfall är vanligt och det finns många orsaker. Därför är den nuvarande rekommendationen att reservera testning för de kvinnor som har tre eller fler missfall. Detta verkar vara hårt. Kanske kan en enkel screeningprocess hjälpa till.
Jag har föreslagit att en del av barnmorskans eller förlossningsläkarens inledande screening bör omfatta ett enkelt frågeformulär i tre delar:
- Har du haft en trombos?
- Har du migrän?
- Har du en familjehistoria av autoimmuna sjukdomar (dvs, lupus, RA, multipel skleros, sköldkörtelsjukdom)?
Jag är säker på att ett så enkelt frågeformulär skulle kunna hjälpa till att identifiera en liten riskgrupp.
I de flesta centra görs ingen långtidsuppföljning när modern och barnet väl har skickats hem. Ändå är det ofta så att APS-patienter som presenterar sig vid t.ex. 40 års ålder med ett trombotiskt problem, uppger en tidigare historia av missfall 20 år tidigare. I en idealisk värld förtjänar kvinnor med återkommande missfall regelbunden långtidsuppföljning. Men världen är långt ifrån idealisk.
Lupus & APS
De tidiga kliniska studierna av APS utfördes på lupuskliniker och kunde mycket väl ha inkluderat ”lupusdrag”. Kanske förvånande nog har tiden visat liten skillnad mellan primär APS och den APS som är associerad med lupus. Det finns utan tvekan vissa klassiska drag av lupus (t.ex. Libman Sachs endokardit, stroke, kramper) som med större sannolikhet är APS-relaterade. Det verkar också troligt att aPL-positivitet vid lupus ger ett högre kronicitetsindex.
Tidens gång har också avslöjat ett positivt resultat: Det är mycket ovanligt att patienter med primär APS utvecklar lupus under senare år.
The Big 3
Sambandet mellan Hughes syndrom, Sjögrens syndrom och hypotyreos är så vanligt att jag har börjat kalla dem för de tre stora tre. Kliniskt sett är det ett viktigt samband eftersom de kliniska symptomen för de tre tillstånden – trötthet, kall cirkulation, värk och smärta samt balans- och minnesproblem – är gemensamma för alla tre. På samma sätt belastas många av dessa patienter med etiketten fibromyalgi.
Var och en av de tre sammankopplade syndromen kan reagera väl på behandling – till exempel den kliniska Sjögrens på hydroxiklorokin och så vidare. Många av dessa patienter står på min behandling med två träd – pil (aspirin) och cinchona (kinin).
Seronegativ APS
Jag tror att en av fördelarna med att en praktikantkliniker tillbringar tid på labbet är insikten om att många laboratorietester är öppna för variation. Många, många studier har försökt bedöma betydelsen av titer, immunglobulinklass, trippel- eller dubbelpositivitet, relevans av ”andra” aPL som t.ex. anti-fosfatidylserin etc.43,44
I stort sett har alla dessa betydelse, men i kliniken passar en del inte in, t.ex. de patienter med alla kliniska kännetecken för APS vars aPL-test förblir envetet negativa.
För några år sedan skrev vi en artikel där vi introducerade termen seronegativ APS och uppmärksammade patienter med starka kliniska drag av APS men med negativa tester.45 Begreppet går tillbaka till de tidiga dagarna av seronegativ RA och seronegativ lupus – båda dessa benämningar, som även om de enbart byggde på kliniska observationer, hade viktiga terapeutiska och prognostiska konsekvenser.
Det finns tre möjliga förklaringar till seronegativ APS: 1) Diagnosen är felaktig (osannolikt i alla fall), 2) de tidigare positiva testerna har blivit negativa med tiden (ovanligt enligt min erfarenhet), eller 3) nya tester behövs.46
Det kanske mest potenta skälet till att vara öppen för seronegativ APS kommer från familjestudier. För några veckor sedan träffade jag ett par enäggstvillingar – den första med klassisk seropositiv APS, som senare tog med sig sin (absolut) enäggstvillingsyster. Den andra tvillingen hade identiska uppsättningar av symtom, men till skillnad från den första tvillingen hade hon negativa aPL-test. Båda patienterna svarade på behandlingen.
En gång om året håller vi ett patientmöte på vårt sjukhus. Vid det senaste mötet ordnade vi ett enkelt anonymt frågeformulär med två frågor: Är du en patient med APS eller en vän/maka/make? Har du någon nära kvinnlig släkting (syster, mor, moster) med en autoimmun sjukdom (t.ex. lupus, RA, sköldkörtel, multipel skleros, APS)? Resultatet: Resultatet: Sextio procent av patienterna hade en positiv historia av autoimmuna sjukdomar hos nära släktingar. Mindre än 20 procent av vännerna/makarna svarade positivt.
Det kan vara så att min egen erfarenhet är snedvriden av hänvisningsbias från familjer till APS-patienter – men seropositiva eller inte, de flesta patienter med seronegativ APS svarar lika bra på behandling.
Om några av dessa personer i familjestudien faktiskt hade seronegativ APS men ändå potentiellt reagerade på behandling, är möjligheterna fascinerande. Kanske en högre procentandel av våra migrän-, unga stroke- och unga anginapatienter skulle kunna dra nytta av att man tittar närmare på fler av ledtrådarna till APS – den torra Schirmers, livedo, anamnesen på autoimmuna sjukdomar i familjen – till exempel.
Behandlingsaspekter
På många sätt är det en besvikelse att erkänna att det 30 år senare finns få nya behandlingar. Införandet av de nya orala antikoagulantia vid behandling av APS har varit förutsägbart försiktigt, och det är för tidigt att generalisera.47
Statiner, IVIG och hydroxiklorquin har kastats in i mixen och naturligtvis har anti-B-cellterapi fått gynnsamma anekdoter. En nyligen genomförd studie från Paris tyder på att sirolimus, som används vid njurtransplantation, kan ha en skyddande effekt på aPL-inducerad vaskulopati.48
Så 2016 är den nuvarande behandlingen av APS fortfarande i stort sett begränsad till aspirin, klopidogrel, heparin och warfarin.
Lågdosaspirin är, trots sina belackare, förstås förstahandsvalet för många APS-patienter. Klopidogrel förblir dock ett användbart alternativ hos patienter med gastrit eller hos astmatiker. Men det finns en tredje roll för klopidogrel – viktig i den praktiska medicinens verkliga värld – det vill säga hos de patienter som av någon anledning har provat aspirin utan tydlig nytta.
Heparin-Lågmolekylärt heparin har i de flesta länder till stor del ersatt gammalt heparin, och i och med det har farhågorna för trombocytopeni och osteoporos i stort sett försvunnit. Detta är en viktig punkt att framhålla, eftersom många läkare är ovilliga att förlänga användningen av heparin.
Två observationer: För det första: Ett antal patienter förbättras dramatiskt på heparin, för att sedan må sämre på warfarin.
Vart ska vi ta vägen härnäst? När doseringsproblem, warfarinresistens och följsamhet (förhoppningsvis) har uteslutits är ett omedelbart alternativ en tillfällig återgång till heparin. I vissa fall har tillfälligt förvandlats till halvlångsiktigt. På vår APS-klinik har vi ett par dussin sådana patienter som av egen vilja har fortsatt med subkutant heparin i två år eller mer. Ja, de har upplevt blåmärken, men hittills har vi inte sett några försämrade DEXA-bilder.
Den andra (och mycket kliniska) observationen gäller en heparinprövning. Det är en vanlig observation att aPL/APS-patienter som får heparin under graviditeten ofta är huvudvärkfria under hela åtta eller nio månader. Detta ledde till att vi utvecklade ett kliniskt verktyg – en terapeutisk prövning som har stått oss väl till pass. Försöket är en tre- eller fyraveckorskur med LMW-heparin.49
Låt mig ge ett exempel på dess användning: Hos en aPL/APS-patient med allt svårare huvudvärk trots aspirin/klopidogrel (och med en normal MRT av hjärnan) kan en prövning med 10 000 enheter dalteparin (eller enoxaparin) i tre eller fyra veckor ge betydande resultat. För det första kan det ge en överraskande tydlig indikation på om antikoagulation är rätt väg att gå. För det andra kan det för den traumatiserade patienten som har gått den välkända vägen med flera specialistkonsultationer, med klinisk framgång på gränsen, vara en viktig vändpunkt – det första påtagliga tecknet på förbättring.
Warfarin-Det finns inte mycket nytt att säga om warfarin. Det har blivit förtalat av media, men det förblir ett av de mest användbara läkemedlen i vårt arsenal. Warfarin, för att uttrycka det enkelt, skyddar mot stroke och hjärtinfarkt vid APS.
Det har nämnts att många APS-patienter ofta behöver ett högre INR-värde – särskilt de med neurologiska drag. Jag är en stark anhängare av att använda självtestande INR-maskiner när det är möjligt för våra patienter.
Syndigt nog motsätter sig vissa antikoagulantiakliniker användningen av självtestande maskiner. För mig är detta fel. Se på den frihet som självtestning för insulinberoende diabetiker har uppnått.
Som läkare anser jag att vi har en skyldighet (tills bättre, nyare antikoagulantia har etablerats) att stödja warfarin som ett i stort sett säkert och effektivt läkemedel som har räddat många tusen liv.
Under 2015 är den nuvarande behandlingen av Hugues syndrom fortfarande i stort sett begränsad till aspirin, klopidogrel, heparin & warfarin.
Miskellighet
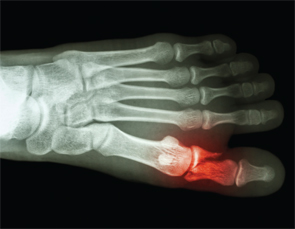
Spontana benfrakturer börjar bli välkända efter rapporten om 27 spontana metatarsalfrakturer av dr. Shirish Sangle hos APS-patienter.
Image Credit: Puwadol Jaturawutthichai/.com
Familjen-Det kommer inte som någon överraskning att en familjehistoria är en viktig ledtråd vid Hughes syndrom. Autoimmuna sjukdomar (särskilt i sköldkörteln) dyker regelbundet upp som diagnos hos släktingar till våra patienter. Men hur ofta diagnostiseras dessa familjefall? Som exempel kan nämnas den 17-åriga dottern till en APS-patient som lider av huvudvärk och körtelfeber, syskonet med multipel skleros eller mamman och tanten till en nydiagnostiserad APS-patient som drabbades av en stroke i början av 40-talet.
Det är inte otänkbart att APS har förändrat historiens gång, som i det fall som rapporterats av min vän dr. Gerald Weissmann, om drottning Anne av England som hade 17 misslyckade graviditeter och dog barnlös, vilket innebar slutet på Stuarts regeringstid och början på hannoveranerna – med George III, skatterna i de amerikanska kolonierna, revolutionen och USA:s födelse.50
Avkomman – Hittills har de flesta undersökningar visat att avkomman till aPL-positiva mödrar inte har några större negativa effekter (förutom kanske de senare utvecklade ärftliga APS-egenskaperna hos vissa). Några oroväckande fallrapporter om foster- och neonatala problem visar dock på ett behov av ytterligare studier. De pågående studierna av dr Anne Parke, Angela Tincani, Maria Claire Boffa och andra kommer med tiden att ge en del av dessa saknade uppgifter.51,52
Klassificering vs. diagnos-
Kära doktor, jag skulle vara tacksam om du kunde ge mig råd om denna patient. Hon utvecklade trombos på det orala p-pillret. Hon har haft ett positivt test för aPL, men har inte haft ett nytt test 12 veckor senare.
Som i fallet med lupus blandas ibland klassificeringskriterierna ihop med diagnosen. Många patienter kommer inte beväpnade med tester ”med 12 veckors mellanrum” (detta kriterium infördes för att täcka risken för att en mellanliggande infektion kan ha lett till ett övergående positivt aPL-test – inte en viktig faktor i vår bedömning av den här patienten).
Det finns också ekonomiska överväganden, som i följande studie från Beirut, Libanon.
”Endast 50,5 % fick både aCL och LA testade. … Kostnaden för varje test var cirka 50 US-dollar för patienten. … Det återstår att se om testkostnaderna delvis kan förklara den mycket lilla andel av patienterna som genomgick ett bekräftande uppföljningstest.”
Tidens gång har också avslöjat ett positivt resultat: Det är mycket ovanligt att patienter med primär APS utvecklar lupus under senare år.
Inkännandet av de många icke-trombotiska manifestationerna av APS har ökat betydelsen av att skilja diagnos från klassificering. Kanske kommer laboratorieframsteg i mätningen av potentiella riskmarkörer med tiden att komma till vår hjälp.44
Flygrädsla för att flyga-Denna kliniska anekdot förekommer regelbundet på min klinik. Så mycket att jag anser att den behöver studeras ytterligare. Ett antal av mina APS-patienter, särskilt innan behandlingen påbörjats, lider svårt av långvarig jetlag efter en långdistansflygning, med trötthet, huvudvärk och förvirring, som ibland varar i flera dagar.
Interessant nog försvinner detta fenomen när heparin- eller warfarinbehandlingen väl påbörjats. Man vet inte om dessa symtom är relaterade till en mild cerebral hypoxi som beror på ett något reducerat kabintryck i kabinen. Trots detta kompletterar en del av mina patienter med APS sin aspirinbehandling före en långdistansflygning med en injektion av LMW-heparin. Även om placeboeffekten kan vara betydande är jag tillräckligt imponerad av dessa (observanta) patienters kliniska erfarenhet för att tro att fenomenet med långvarig jetlag hos många av våra patienter är mycket verkligt.
Framtiden – Vid den 14:e internationella kongressen om antifosfolipidantikroppar som hölls i Rio de Janeiro 2013 ombads jag att ge mina förutsägelser om framtiden för APS.23 Sammanfattningsvis tror jag följande:
- APL-testning kommer att bli världsomspännande och rutinmässig;
- Det kommer att bli möjligt att få tillgång till aPL-testningssatser utan recept;
- En betydande undergrupp av migränelidande kommer att få nytt hopp;
- APS kommer att erkännas som den viktigaste länken mellan migrän och stroke;
- Hjärtattacker hos unga kvinnor (särskilt de under 45 år) kommer att minska;
- Strokes hos de under 45 år kommer att minska;
- Vissa fall av accelererad artärsjukdom kommer att erkännas som förknippade med (obehandlad) aPL;
- Vissa fall av minnesförlust går att behandla;
- APS kommer att fortsätta att ha en djupgående effekt på vår kliniska bedömning och behandling av lupus; och
- För att återgå till det inledande temat kommer förekomsten av dödfödda barn att minskas, delvis tack vare ett mer proaktivt tillvägagångssätt för aPL-testning under graviditeten.
För att upprepa en mening från 1983 års artikel:1
För dem av oss som har härdats till nihilism av åratal av studier av olika autoantikroppar vid SLE, finns det en sällsynt känsla av upphetsning inför konsekvenserna av de samband som nu rapporteras.
Trettio år senare är den kliniska spänningen oförminskad.
 Graham R.V. Hughes, MD, FRCP, är en konsulterande reumatolog och chef för London Lupus Centre. Han utbildade sig vid The London Hospital och tillbringade två år i New York där han arbetade med införandet av det DNA-bindande testet under ledning av dr Charles Christian. År 1971 öppnade han en specialistklinik i London som enbart sysslar med lupus och besläktade sjukdomar. Han är grundare och redaktör för den internationella tidskriften Lupus. 1983 beskrev han antifosfolipidsyndromet och 1991 tilldelades han ILAR-priset (World Research) för detta arbete. Andra utmärkelser är Doctor Honoris Causa vid universiteten i Marseille och Barcelona och Master of the ACR.
Graham R.V. Hughes, MD, FRCP, är en konsulterande reumatolog och chef för London Lupus Centre. Han utbildade sig vid The London Hospital och tillbringade två år i New York där han arbetade med införandet av det DNA-bindande testet under ledning av dr Charles Christian. År 1971 öppnade han en specialistklinik i London som enbart sysslar med lupus och besläktade sjukdomar. Han är grundare och redaktör för den internationella tidskriften Lupus. 1983 beskrev han antifosfolipidsyndromet och 1991 tilldelades han ILAR-priset (World Research) för detta arbete. Andra utmärkelser är Doctor Honoris Causa vid universiteten i Marseille och Barcelona och Master of the ACR.
- Hughes GR. Trombos, abort, cerebral sjukdom och lupus antikoagulantia. Br Med J (Clin Res Ed). 1983 Oct 15;287(6399):1088-1089.
- Harris EN, Gharavi AE, Boey ML, et al. Anticardiolipin i antikroppar: Detektion med radioimmunoassay och samband med trombos vid SLE. Lancet. 1983 Nov 26;2(8361):1211-1214.
- Boey ML, Colaco CB, Gharavi AE, et al. Trombos i SLE: Slående samband med förekomsten av cirkulerande lupus antikoagulant. Br Med J (Clin Res Ed). 1983 Oct 8;287:1021-1023.
- Hughes GR. Prosser White-orationen 1983: Bindevävnadssjukdomar och huden. Clin Exp Dermatol. 1984 Nov;9(6):535-544.
- Asherson RA, Mackworth-Young CG, Boey ML, Hughes GRV. Pulmonell hypertension vid systemisk lupus erythematosus. Br Med J (Clin Res Ed). 1983 Oct 8;287(6398):1024-1025.
- Derue GJ, Englert HJ, Harris EN, et al. Fetal loss in systemic lupus: Samband med antikardiolipin-antikroppar. J Obstet Gynaecol. 1985;5(4):207-209.
- Hughes GR, Harris NN, Gharavi AE. Antikardiolipinsyndromet. J Rheumatol. 1986 Jun;13(3):486-489.
- Hughes GR. Hughes syndrom: Det antikardiolipinsyndromet. En historisk syn. Lupus. 1998;7 Suppl 2:S1-S4.
- Carecchio M, Cantello R, Comi C. Revisiting the molecular mechanism in antiphospholipid syndrome: Beyond vascular damage. J Immunol Res. 2014;2014:239398.
- Bluestein HG, Zvaifler NJ. Hjärnreaktiva lymfocytotoxiska antikroppar i serumet hos patienter med SLE. J Clin Invest. 1976 Feb;57(2):509-516.
- Bresnihan B, Oliver N, Grigor R, Hughes GR. Hjärnreaktivitet hos lymfocytotoxiska anitikroppar vid systemisk lupus erythematosus med och utan cerebralt engagemang. Clin Exp Immunol. 1977 Dec;30(3):333-337.
- Bresnihan B, Hohmeister R, Cutting J, et al. The neuropsychiatric disorder in SLE: Evidence for both vascular and immune mechanisms. Ann Rheum Dis. 1979 Aug;38(4):301-306.
- Denburg SD, Behmann SA, Carbotte RM, et al. Lymphocyt antigener i neuropsykiatrisk systemisk lupus erythematosus. Förhållandet mellan lymfocytantikroppsspecificiteter och klinisk sjukdom. Arthritis Rheum. 1994 Mar;37(3):369-375.
- Harris EN, Gharavi AE, Asherson RA, et al. Cerebral infarkt vid SLE. Samband med antikardiolipinantikroppar. Clin Exp Rheumatol. 1984 Jan-Mar;2(1):47-51.
- Navarrete MG, Brey RL, Levine SR. ”Cerebral disease in the antiphospholipid syndrome” in Hughes Syndrome-Antiphospholipid Syndrome. Khamashta MA, red. Springer, London: 2000.
- Sanna G, Bertolaccini ML, Cuadrado MJ, et al. Central nervous system involvement in the antiphospholipid (Hughes) syndrome. Rheumatology (Oxford). 2003 Feb;42(2):200-213.
- Etminan M, Takkouche B, Isorna FC, Samii A. Risk för ischemisk stroke hos personer med migrän: Systemisk genomgång och metaanalys av observationsstudier. BMJ. 2005 Jan 8;330(7482):63.
- Nencini P, Baruffi MC, Abbate R, et al. Lupus antikoagulerande och antikardiolipin-antikroppar hos unga vuxna med cerebral ischemi. Stroke. 1992 Feb;23(2):189-193.
- Hughes GR. Antifosfolipidsyndrom, migrän och stroke. Lupus. 2010 Apr;19(5):555-556.
- Mackworth-Young CG, Hughes GR. Epilepsi: Ett tidigt symptom på systemisk lupus erythematosus. J Neurol Neurosurg Psychiatry. 1985 Feb;48(2):185.
- Cimaz R, Meroni PL, Shoenfeld Y. Epilepsy as part of systemic lupus erythematosus and systemic antiphospholipid syndrome (Hughes syndrome). Lupus. 2006;15(4):191-194.
- Hughes GR. ”Diplomatisk epilepsi” i Förståelse av Hughes syndrom. Springer-Verlag, London: 2009.
- Hughes GR. Hughes syndrom/APS. 30 år senare, vad har vi lärt oss? Inledningstal vid den 14:e internationella kongressen om antifosfolipidantikroppar. Rio de Janeiro, oktober 2013. Lupus. 2014;23:400-406.
- Cuadrado MJ, Khamashta MA, Ballesteros A, et al. Kan neurologiska manifestationer av Hughes (antifosfolipid) syndrom särskiljas från multipel skleros? Analys av 27 patienter och genomgång av litteraturen. Medicin (Baltimore). 2000 Jan;79(1):57-68.
- Hughes GR. Migrän, minnesförlust och ”multipel skleros”. Neurologiska kännetecken för antifosfolipidsyndromet (Hughes syndrom). Postgrad Med J. 2003 Feb;79(928):81-83.
- Uthman I, Noureldine MH, Berjawi A, et al. Hughes syndrom och multipel skleros. Lupus. 2015 Feb;24(2):115-121.
- Cervera R, Asherson RA, Font J, et al. Chorea vid antifosfolipidsyndrom. Kliniska, radiologiska och immunologiska egenskaper hos 50 patienter från våra kliniker och den senaste litteraturen. Medicine (Baltimore). 1997 May;76(3):203-212.
- Baizabal-Carvallo JF, Bonnet C, Jankovic J. Movement disorders in systemic lupus erythematosus and the antiphospholipid syndrome. J Neural Transm (Wien). 2013 Nov;120(11):1579-1589.
- Schofield JR, Blitshteyn S, Shoenfeld Y, et al. Postural tachycardia syndrome (POTS) and other autonomic disorders in antiphospholipid (Hughes) syndrome (APS). Lupus. 2014 Jun;23(7):697-702.
- Sangle S, D’Cruz DP, Khamashta MA, et al. Antifosfolipidantikroppar, systemisk lupus erythematosus och icke-traumatiska metatarsalfrakturer. Ann Rheum Dis. 2004 Oct;63(10):1241-1243.
- Greco TP1, Conti-Kelly AM, Greco T Jr, et al. Newer antiphospholipid antibodies predict adverse outcomes in patients with acute coronary syndrome. Am J Clin Pathol. 2009 Oct;132(4):613-620.
- Urbanus RT, Siegerink B, Roest M, et al. Antiphospholipid antibodies and risk of myocardial infarction and ischaemic stroke in young women in the RATIO study: En fall-kontrollstudie. Lancet Neurol. 2009 Nov;8(11):998-1005.
- Nair S, Khamashta MA, Hughes GR. Syndrom X och Hughes syndrom. Lupus. 2002;11(5):332.
- Sangle SR, Jan W, Lau IS, et al. Stenos i celiakusartären och antifosfolipidsyndrom (Hughes)/antifosfolipidantikroppar. Clin Exp Rheumatol. 2006 May-Jun;24(3):349.
- Mackworth-Young CG, Melia WM, Harris EN, et al. Budd-Chiari-syndromet. Möjlig patogenetisk roll för antifosfolipidantikroppar. J Hepatol. 1986;3(1):83-86.
- Hanouna G, Morel N, Le Thi Huong D, et al. Catastrophic antiphospholipid syndrome and pregnancy: En erfarenhet av 13 fall. Rheumatology (Oxford). 2013 Sep;52(9):1635-1641.
- Sangle SR, D’Cruz DP, Jan W, et al. Renal artery stenosis in antiphospholipid syndrome (Hughes) and hypertension. Ann Rheum Dis. 2003 Oct;62(10):999-1002.
- Englert HJ, Loizou S, Derue GG, et al. Clinical and Immunological features of livedo reticularis in lupus. Am J Med. 1989 Oct;87(4):408-410.
- Sangle SR, D’Cruz DP. Livedo reticularis: En gåta. Isr Med Assoc J. 2015 Feb;17(2):104-107.
- Ateka-Barrutia O, Khamashta MA. Utmaningen med graviditet för patienter med SLE. Lupus. 2013 Oct;22(12):1295-1308.
- Hughes GR. Skandalen med dödfödda barn. Lupus. 2013 Jul;22(8):759-760.
- Silver RM, Parker CB, Reddy UM, et al. Antiphospholipid antibodies in stillbirth. Obstet Gynecol. 2013 Sep;122(3):641-657.
- Rodriguez-Garcia JL, Bertolaccini ML, Cuadrado MJ, et al. Kliniska manifestationer av antifosfolipidsyndrom (APS) med och utan antifosfolipidantikroppar (det så kallade ”seronegativa APS”). Ann Rheum Dis. 2012 Feb;71(2):242-244.
- Meroni PL, Chighizab CB, Rovelli F, et al. Antiphospholipid syndrome in 2014: Fler kliniska manifestationer, nya patogena aktörer och nya biomarkörer. Arthritis Res Ther. 2014;16(2):209.
- Hughes GR, Khamashta MA. Seronegativt antifosfolipidsyndrom. Ann Rheum Dis. 2003 Dec;62(12):1127.
- Rodguez-Garcia JL, Bertolaccini ML, Cuadrado MJ, et al. Kliniska manifestationer av antifosfolipidsyndrom (APS) med och utan antifosfolipidantikroppar. Ann Rheum Dis. 2012 Feb;71(2):242-244.
- Giles I, Khamashta M, D’Cruz D, et al. A new dawn of anticoagulation for patients with antiphospholipid syndrome. Lupus. 2012 Oct;21(12):1263-1265.
- Canuad G, Bienaimé C, Taborin F, et al. Hämning av mTORC-systemet vid antifosfolipidsyndrom. New Eng J Med. 2014 Jul 24;371(4):303-312.
- Hughes GR. Heparin, antifosfolipida antikroppar och hjärnan. Lupus. 2012 Sep;21(10):1039-1040.
- Weissmann G. Queen Anne’s lupus: Fosfolipider och imperiets förlopp. FASEB J. 2014 Apr;28(4):1527-1530.
- Mekinian A, Lachassinne E, Nicaise-Roland P, et al. European registry of babies born to mhers with antiphospholipid syndrome. Ann Rheum Dis. 2013 Feb;72(2):217-222.
- Nalli C, Iodice A, Andreoti L, et al. Children born to SLE and APS moders. Lupus. 2014 Oct;23(12):1246-1248.
- Major S, Pashayan N, Atweh S, et al. Practice patterns of antiphospholipid syndrome at a tertiary teaching hospital in Lebanon. Lupus. 2002;11(11):759–764.