Kärn- och valenselektroner
När vi fortsätter genom det periodiska systemet på detta sätt och skriver elektronkonfigurationer för allt större atomer, blir det tråkigt att fortsätta att kopiera konfigurationer för de fyllda inre underskal. I praktiken förenklar kemisterna notationen genom att använda en ädelgassymbol inom parentes för att representera konfigurationen för ädelgasen från föregående rad eftersom alla orbitaler i en ädelgas är fyllda. Till exempel representerar elektronkonfigurationen 1s2 2s2 2p6 för neon (Z = 10), så representerar elektronkonfigurationen för natrium, med Z = 11, som är 1s2 2s2 2p6 3s1, skrivs som 3s1
| Full elektronkonfiguration | Nobel Gas Shorthand | ||
| Neon | Z = 10 | Ne: 1s2 2s2 2p6 | Ne: 2s2 2p6 |
| Natrium | Z = 11 |
Na: 1s2 2s2 2p6 3s1 |
Na: 3s1 |
Elektroner i fyllda inre banor är närmare kärnan och hårdare bundna till den, och därför är de sällan inblandade i kemiska reaktioner. Vi kommer att kalla dessa kärnelektroner. För de representativa grundämnena (kolumnerna 1, 2 och 13-18 i det periodiska systemet) är kärnelektronerna alla elektroner med ett n-värde som är lägre än det maximala n-värdet i elektronkonfigurationen. I natriumatomen till exempel är det högsta n-värdet 3. Kärnelektronerna är således de som befinner sig i atomorbitalerna med n < 3, dvs. de som befinner sig i 1s-, 2s- och 2p-orbitalerna. Natrium har alltså 10 kärnelektroner. Vi kommer att återkomma till denna definition av kärnelektroner senare för övergångsmetaller.
Detta innebär att en atoms kemi främst beror på elektronerna i dess yttersta skal, de med det högsta n-värdet, som kallas valenselektroner. Den förenklade notationen gör att vi lättare kan se valenceelektronernas konfiguration. Om vi använder denna notation för att jämföra elektronkonfigurationerna för natrium och litium får vi följande:
| Natrium | 1s2 2s2 2p6 3s1 | 3s1 |
| Litium | 1s2 2s1 | 2s1 |
Det är uppenbart att både natrium och litium har en s-elektron i sitt valensskal. Vi skulle därför förutsäga att natrium och litium har mycket likartad kemi, vilket också är fallet.
När vi fortsätter att bygga upp de åtta grundämnena i period 3 fylls 3s och 3p-orbitalerna, en elektron i taget. Denna rad avslutas med ädelgasen argon, som har elektronkonfigurationen 3s2 3p6, vilket motsvarar ett fyllt valensskal.
Exempel 2.2.2.2
Rita upp ett orbitaldiagram och använd det för att härleda elektronkonfigurationen för fosfor, Z = 15. Vilken är dess valenselektronkonfiguration?
Givet: atomnummer
Sökt: orbitaldiagram och valenselektronkonfiguration för fosfor
Strategi:
- Lokalisera den ädelgas som ligger närmast före fosfor i det periodiska systemet. Subtrahera sedan dess antal elektroner från antalet elektroner i fosfor för att få fram antalet valenceelektroner i fosfor.
- Rita med hänvisning till figur 2.1.1 ett orbitaldiagram för att representera dessa valenceorbitaler. Placera valenceelektronerna enligt Hunds regel i de tillgängliga orbitalerna och börja med den orbital som har lägst energi. Skriv elektronkonfigurationen från ditt orbitaldiagram.
- Ignorera de inre orbitalerna (de som motsvarar elektronkonfigurationen för den närmaste ädelgasen) och skriv valenceelektronkonfigurationen för fosfor.
Lösning:
A Eftersom fosfor står i den tredje raden i det periodiska systemet vet vi att den har ett slutet skal med 10 elektroner. Vi börjar med att subtrahera 10 elektroner från de 15 som finns i fosfor.
B De ytterligare fem elektronerna placeras i nästa tillgängliga orbitaler, som Figur 2.1.1 berättar att det är 3s och 3p-orbitalerna:
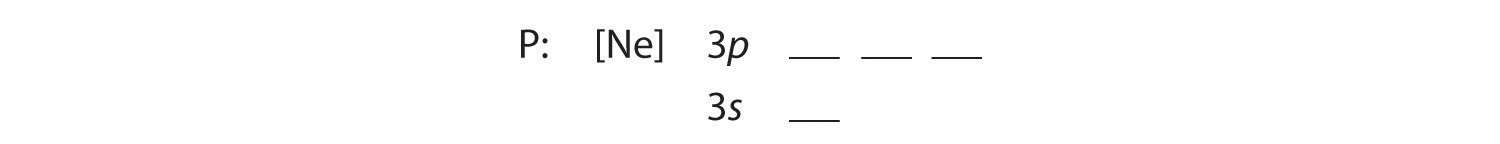
Då 3s-bobitalen har lägre energi än 3p-orbitalerna, fyller vi den först:
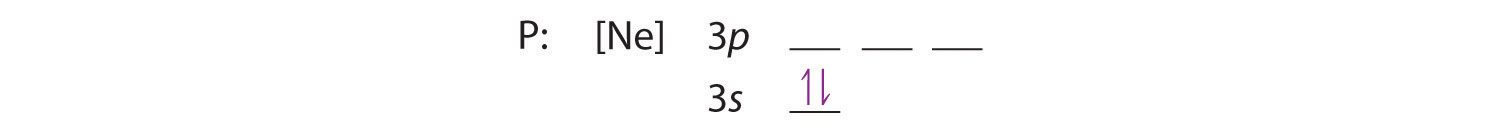
Hunds regel säger oss att de återstående tre elektronerna kommer att ockupera de degenererade 3p-orbitalerna var för sig men med sina spinn i linje:
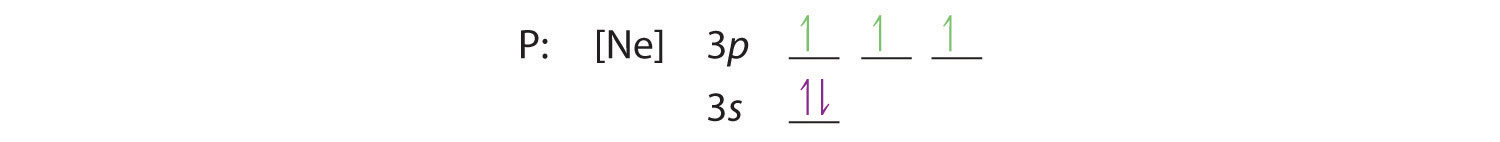
Elektronkonfigurationen är 3s2 3p3.
C Vi får fram valenselektronkonfigurationen genom att bortse från de inre orbitalerna, vilket för fosfor innebär att vi bortser från det slutna skalet. Detta ger valenselektronkonfigurationen 3s2 3p3.
Övningsuppgift 2.2.2
Rita upp ett orbitaldiagram och använd det för att härleda elektronkonfigurationen för klor, Z = 17. Vilken är dess valenselektronkonfiguration?
Svar: Svar: 3s2 3p5
Valenceelektronkonfiguration: Den allmänna ordningen i vilken orbitaler fylls visas i figur 2.2.1. Delskal som motsvarar varje värde av n är skrivna från vänster till höger på på varandra följande horisontella rader, där varje rad representerar en rad i det periodiska systemet. Ordningen i vilken orbitalerna fylls anges av de diagonala linjerna som löper från övre höger till nedre vänster. Följaktligen fylls 4s-bokalen före 3d-bokalen på grund av avskärmnings- och penetrationseffekter. Följaktligen är elektronkonfigurationen för kalium, som inleder den fjärde perioden, 4s1 och för kalcium 4s2. Fem 3d-orbitaler fylls av nästa tio grundämnen, övergångsmetallerna, följt av tre 4p-orbitaler. Observera att den sista medlemmen i denna rad är ädelgasen krypton (Z = 36), Kr: 4s2 3d10 4p6, som har fyllda 4s, 3d och 4p-orbitaler. Den femte raden i det periodiska systemet är i stort sett densamma som den fjärde, förutom att 5s, 4d och 5p-orbitalerna fylls i tur och ordning.
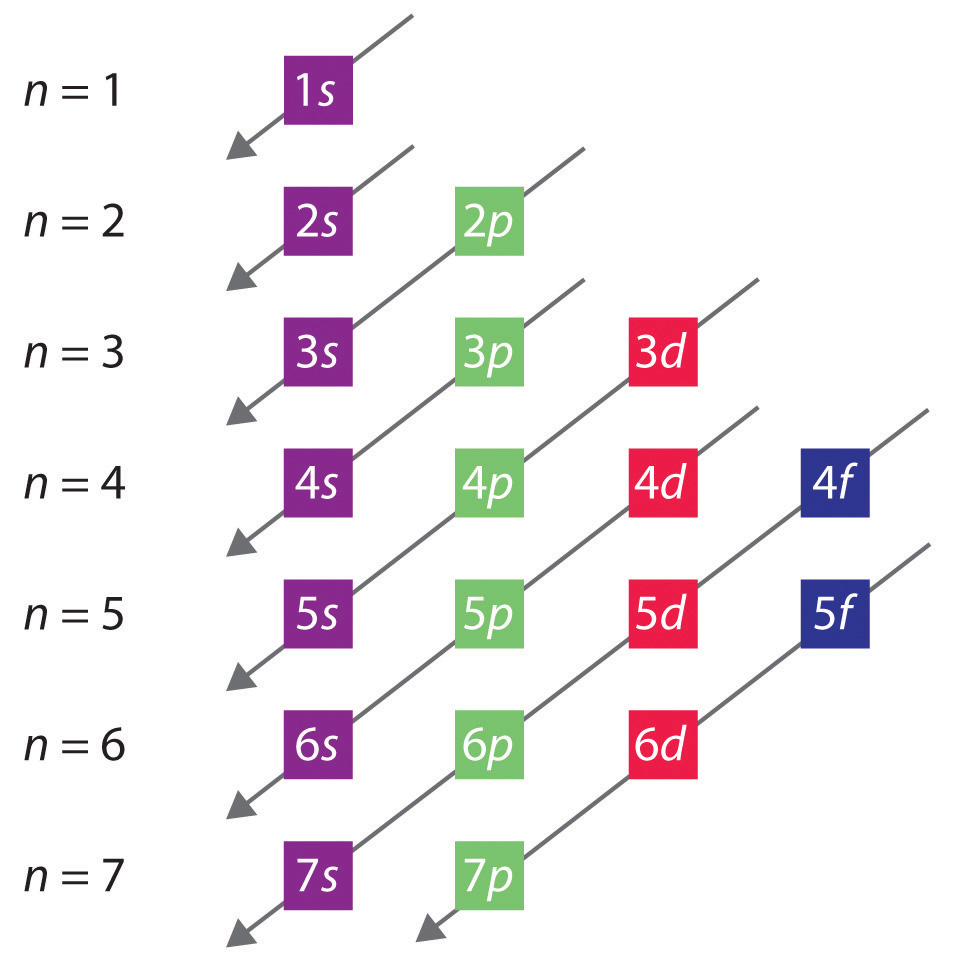
Figur 2.2.1 Förutsägelse av i vilken ordning orbitaler fylls i atomer med flera elektroner. Om du skriver underskalorna för varje värde av det huvudsakliga kvantantalet på på varandra följande rader, indikeras den observerade ordningen i vilken de fylls av en serie diagonala rader som löper från övre högra till nedre vänstra sidan.
Den sjätte raden i det periodiska systemet kommer att skilja sig från de två föregående eftersom 4f-orbitalerna, som kan rymma 14 elektroner, fylls mellan 6s och 5d-orbitalerna. De grundämnen som innehåller 4f-orbitaler i sitt valensskal är lantaniderna. När 6p-orbitalerna slutligen är fyllda har vi nått nästa (och sista kända) ädelgas, radon (Z = 86), Rn: 6s2 4f14 5d10 6p6. I den sista raden fylls 5f-orbitalerna mellan 7s- och 6d-orbitalerna, vilket ger de 14 aktinidelementen. Eftersom det stora antalet protoner gör deras kärnor instabila är alla aktiniderna radioaktiva.
Exempel 2.2.3
Skriv elektronkonfigurationen för kvicksilver (Z = 80) och visa alla inre orbitaler.
Givet: atomnummer
Sökt: fullständig elektronkonfiguration
Strategi:
Med hjälp av orbitaldiagrammet i figur 2.2.1 och det periodiska systemet som vägledning fyller du orbitalerna tills alla 80 elektroner har placerats.
Lösning:
Du placerar elektronerna i orbitaler i den ordning som visas i figur 2.2.1 och med hjälp av det periodiska systemet som vägledning, får vi
| 1s2 | rad 1 | 2 elektroner |
| 2s22p6 | rad 2 | 8 elektroner |
| 3s23p6 | rad 3 | 8 elektroner |
| 4s23d104p6 | rad 4 | 18 elektroner |
| 5s24d105p6 | rad 5 | 18 elektroner |
| Rad 1-5 | 54 elektroner |
Efter att ha fyllt de fem första raderna, har vi fortfarande 80 – 54 = 26 fler elektroner att ta emot. Enligt figur 2.2.2 behöver vi fylla 6s (2 elektroner), 4f (14 elektroner) och 5d (10 elektroner) orbitalen. Resultatet är kvicksilvers elektronkonfiguration:
Hg: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10
Hg: 6s2 4f14 5d10
med ett fyllt 5d-underskal, en 6s2 4f14 5d10 valensskalkonfiguration och totalt 80 elektroner. (Du bör alltid kontrollera att det totala antalet elektroner är lika med atomnumret.)
Övningsuppgift 2.2.3
Och även om grundämne 114 inte är tillräckligt stabilt för att förekomma i naturen, skapades två isotoper av grundämne 114 för första gången i en kärnreaktor 1999 av ett team av ryska och amerikanska forskare. Skriv den fullständiga elektronkonfigurationen för grundämne 114.
Svar: Svar: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p2
Elektronkonfigurationerna för grundämnena presenteras i figur 2.2.3, som listar orbitalerna i den ordning de är fyllda. I flera fall skiljer sig grundtillståndets elektronkonfigurationer från dem som förutses i figur 2.2.1. Några av dessa avvikelser uppstår när 3d-orbitalerna fylls. Den observerade elektronkonfigurationen i grundtillståndet för krom är till exempel 4s1 3d5 i stället för den förutspådda 4s2 3d4. På samma sätt är den observerade elektronkonfigurationen för koppar 4s1 3d10 i stället för s2 3d9. Den faktiska elektronkonfigurationen kan rationaliseras i termer av ökad stabilitet i samband med ett halvfyllt (ns1, np3, nd5, nf7) eller fyllt (ns2, np6, nd10, nf14) underskal. Med tanke på de små skillnaderna mellan högre energinivåer är denna extra stabilitet tillräcklig för att flytta en elektron från en orbital till en annan. I tyngre grundämnen kan andra mer komplexa effekter också vara viktiga, vilket leder till några av de ytterligare anomalier som anges i figur 2.2.3. Cerium har till exempel en elektronkonfiguration på 6s2 4f1 5d1, vilket är omöjligt att rationalisera i enkla termer. I de flesta fall har dock dessa uppenbara anomalier inga viktiga kemiska konsekvenser.
Note
Tillkommande stabilitet är förknippad med halvfyllda eller fyllda underskal.