Un programma di ricerca è stato condotto per migliorare la tecnologia di lavorazione per estrarre l’allumina da nonbauxitica. Il successo di questo programma aveva fornito la tecnologia necessaria per produrre una fornitura adeguata di allumina di alto grado da fonti nazionali, soddisfacendo così le esigenze economiche e strategiche nazionali relative alla produzione di alluminio. Il processo con acido cloridrico per il recupero dell’allumina da minerali di basso grado è uno dei processi studiati nel programma di ricerca.
Una fase di questo processo utilizza l’effetto della concentrazione di ioni cloruro sulla solubilità dello ione alluminio in soluzione. A 25° C, la solubilità di AlCl3 in acqua pura è circa 31 pct in peso, e diminuisce con l’aumentare della concentrazione di acido cloridrico (HCl), diventando 0,1 pct quando la concentrazione di HCl è aumentata a 37 pct. Questo comportamento è stato oggetto di numerose indagini, processi e brevetti. Così è possibile lisciviare un minerale non bauxitico con HCl, decantare e filtrare il liquido, e aggiungere HCl gassoso per precipitare AlCl3-6H2O. La soluzione acida rimanente può quindi essere usata per la lisciviazione di altro minerale e l’AlCl3-6H2O precipitato può essere calcinato per ottenere Al2O3 . Un’ampia discussione e valutazione di questo processo è presentata da Peters, Johnson e Kirby. I dati termodinamici, come le attività ioniche e le solubilità, necessari per l’analisi completa, l’interpretazione e il miglioramento di questo processo sono scarsi, e i dati di solubilità esistenti sono limitati a una gamma ristretta di temperature. Pertanto, gli obiettivi di questa indagine erano (1) determinare la solubilità di AlCl3, in un intervallo di temperatura da 25° a 85° C con concentrazione di HCl da 0,0 a 37.2 pct; (2) calcolare le attività di AlCl3 e di H2O in soluzioni contenenti vari elettroliti, e la costante di equilibrio per la dissoluzione di AlCl3-6H2O; e (3) suggerire aree di ricerca per generare dati utili.
- Apparato
- Procedimento sperimentale
- Analisi
- Risultati
- Confronto con altri dati
- Trattamento termodinamico
- Prodotto di solubilità e attività nel sistema AlCl3-6H2O-H2O
- Stima delle attività nel sistema AlCl3-6H2O-H2O
- Prodotto di solubilità e attività nel sistema AlCl3-6H2O-HCl-H2O
- Stima delle attività nel sistema AlCl3-6H2O-HCl-H2O
- Sistema AlCl3-FeCl3-KCl-NaCl-HCl-H2O
- Aree consigliate per la ricerca
- Cloruro di alluminio in soluzioni acquose di acido cloridrico
Apparato
L’apparato usato per le misure di solubilità è mostrato in figura 1. Un pallone da 100 ml, A, contiene una soluzione di elettroliti e un po’ di sale in eccesso. Un filtro di vetro fritto, B, fuso su un tubo Pyrex 6-mm-OD è unito ad un tubo esterno collegato a due rubinetti di arresto in Teflon, D ed E. Il gruppo superiore è collegato ad A a C da un raccordo a compressione in nylon filettato con un anello 0 in neoprene. Un tubo di polietilene da 6 mm-OD, F-L, fornisce un campione di soluzione filtrato a B nella seconda beuta, K, quando A è pressurizzato attraverso il rubinetto D, ed E è aperto. Il raccordo a J è simile a quello di C. Le beute sono bloccate su una barra, G, che è attaccata ad un meccanismo oscillante, con H come asse di oscillazione per scuotere le beute, A e K, alternativamente su e giù. Un termostato coperto, 0, è controllato entro ±0,2° C. Un controllo della temperatura più stretto non è necessario poiché la solubilità è una funzione molto debole della temperatura.
Procedimento sperimentale
Le misure delle solubilità a 25°, 45°, 65° e 85° C sono state fatte in condizioni di equilibrio di fase con materiali analitici di grado reagente. Quantità appropriate di AlCl3-6H2O, una soluzione di HCl al 37% e acqua distillata sono state messe nel pallone A per formare circa 90 ml di soluzione con una piccola quantità di cristalli di sale in eccesso (di seguito “sale” si riferisce al cloruro di alluminio esaidrato). Le quantità di materiali sono state stimate dai dati di solubilità esistenti sul sistema ternario AlCl3-6H2O-HCl-H2O. Dopo che la soluzione si è formata nel pallone A e l’apparato è stato assemblato, è stato immerso nell’acqua fino al livello N, e il termostato è stato impostato sulla temperatura desiderata. Un’agitazione meccanica continua dei palloni è stata utilizzata durante ogni ciclo della durata di 2 o 3 giorni. Periodicamente, è stata usata anche una vigorosa agitazione manuale per assicurare
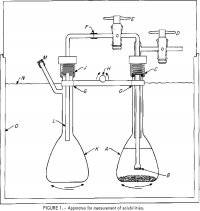
l’equilibrio, in particolare se il sale potrebbe formare un sale solido complesso con HCl. Alla fine del periodo di equilibrio, le beute sono state lasciate immobili in posizione verticale per 1 ora per assicurare l’assestamento delle particelle solide. I rubinetti D ed E sono stati aperti per trasferire circa la metà della soluzione nel pallone di campionamento, K. Il livello di B sotto il liquido in A di solito ha determinato la quantità di soluzione trasferita in K. Il peso della soluzione in K è stato determinato pesando il pallone prima del montaggio e dopo aver ammesso la soluzione e smontato. Una quantità nota di acqua distillata è stata iniettata nel pallone attraverso L per diluire il campione e dissolvere qualsiasi vapore nella fase gassosa. La pressione parziale dell’HCl in acqua pura supera 1 torr a 25° C a molalità superiori a 8 m (m dopo un numero in una frase denota molale); quindi, a concentrazioni inferiori a 8 m è dubbio che qualsiasi perdita di HCl possa avvenire durante il campionamento. Per questo motivo, alcune delle corse a 25° C, contenenti meno di 4 m di HCl, sono state fatte con un singolo pallone tappato, e, dopo l’equilibrio, una parte della soluzione è stata accuratamente decantata e filtrata per il campionamento.
Analisi
Le soluzioni sono state analizzate dopo appropriate diluizioni per le concentrazioni totali di ioni cloruro e ioni alluminio. La concentrazione di ioni cloruro totale è stata determinata mediante titolazione potenziometrica con Ag+. La concentrazione di Al+++ è stata determinata prima complessando con un eccesso di acido etilendiamminotetraacetico (EDTA) e poi titolando nuovamente l’eccesso di EDTA con Cu++ ad un pH di 3,8.
Il contenuto di AlCl3 è stato calcolato dall’analisi Al+++. La sottrazione dello ione cloruro nella quantità calcolata di AlCl3 dalla concentrazione totale di ioni cloruro ha permesso di calcolare la concentrazione di HCl nelle soluzioni sature.
Questo metodo di calcolo è stato utilizzato per tutte le analisi tranne quelle in cui la concentrazione di HCl era nota per essere zero, cioè quando AlCl3 era l’unico elettrolita in acqua pura. Per queste analisi, la concentrazione di AlCl3 è stata semplicemente calcolata dall’analisi degli ioni cloruro, che era la più accurata delle due analisi, anche se entrambe le analisi Al+++ e Cl- sono state ancora completate per questi campioni.
La differenza nell’analisi Cl- calcolata dall’analisi Cl- totale e Cl- dall’analisi Al+++ per gli esperimenti senza aggiunta di HCl era ±0,2 wt-pct Cl-. Ciò indica che, in media, l’analisi di Al++ era soggetta a +0,05 wt-pct di errore, poiché l’analisi Cl era nota per essere notevolmente più accurata dell’analisi Al+++. Nelle soluzioni contenenti HCl, un errore di ±0,05 per cento nel contenuto di Al+++ si rifletteva come ±0,20 pct nel contenuto di HCl; questo perché, mentre il contenuto totale di Cl era molto accurato, il Cl contribuito dall’HCl aggiunto e, quindi la molalità di HCl, era calcolata per differenza come detto prima.
Risultati
I risultati sono riassunti nella tabella 1 e mostrati nella figura 2. La concentrazione massima di HCl per i dati riportati nella tabella 1 per 85° C è di circa 30 wt-pct. Le misurazioni sono state interrotte a questa concentrazione a causa delle eccessive pressioni di equilibrio nel sistema a concentrazioni più elevate. Va anche notato che sono state effettuate meno determinazioni a 65° e 85° C che a 25° e 45° C. Sono state eseguite repliche alle due temperature inferiori per dare un’indicazione della ripetibilità soddisfacente dei risultati. La figura 2 mostra che la solubilità del sale di alluminio diminuisce drasticamente con l’aumento della concentrazione di HCl. Pertanto, la lisciviazione di minerali non bauxitici con una soluzione di HCl e la precipitazione del sale puro per l’estrazione dell’alluminio aggiungendo HCl è un processo fattibile; tale processo è stato oggetto di diversi brevetti. I risultati mostrano che la solubilità non cambia molto con la temperatura, e per un aumento di temperatura di 60° C (da 25° a 85° C), la solubilità del sale puro da solo in acqua aumenta solo di 2,2 punti percentuali rispetto alla solubilità a 25° C.
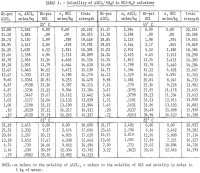
Confronto con altri dati
La solubilità del sale puro in acqua a 25° C è stata trovata esattamente in accordo con i dati di Palitzch e con Ehret e Frere. I risultati dati da Malquori sono circa 10 punti percentuali più alti. La solubilità ottenuta da Tanaka è circa 3,3 punti percentuali più alta della presente indagine a 45° e a 65° C.
L’effetto di HCl in acqua sulla solubilità del sale è stato studiato da Seidel e Fisher a 0° C e da Malquori a 25° C. I risultati dei primi ricercatori a 0° C concordano molto strettamente con i dati della tabella 1, estrapolati a 0° C, mentre quelli del secondo ricercatore a 25° C sono un po’ dispersivi e non concordano approssimativamente di 3 pet a basse concentrazioni di HCl; tuttavia, l’accordo nella gamma da 5 a 30 wt-pct HCl è entro 1 pct.
Trattamento termodinamico
Prodotto di solubilità e attività nel sistema AlCl3-6H2O-H2O
Il coefficiente di attività ionica Y12 di AlCl3 in acqua è stato misurato fino a 1,8 m da Mason, e valori ricalcolati sono dati da Robinson e Stokes. Poiché il coefficiente di attività da 1,8 m al valore di saturazione di 3,3835 m dovrebbe aumentare più di cinque volte, il valore di saturazione è usato per il calcolo con il metodo descritto in dettaglio in un rapporto precedente (1 m = 1 mole in 1 kg di solvente). Il metodo, con la sua appropriata applicazione innovativa, è brevemente riassunto in questo rapporto. L’attività ionica media di AlCl3, designata come a12, è espressa dalla seguente serie di potenze in termini di molalità m:

La corrispondente equazione per l’attività dell’acqua aw, si ottiene applicando la relazione Gibbs-Duhem; il risultato è
![]()
Nota che gli esponenti di m con gli stessi coefficienti di C, D, ecc, sono 1 più alti nell’equazione 2 che nell’equazione 1, e il coefficiente di m nell’equazione 2 proviene dalla teoria di Debye-Huckel come discussa da Gokcen.
La reazione per la dissoluzione del sale è
AlCl3-6H2O (S) = Al+++ + 3Cl- + 6H2O (l),………………………….(3)
dove (s) significa solido e (l) liquido.
La costante di equilibrio corrispondente è
![]()
dove il denominatore, l’attività del solido, è preso come unità poiché la sua composizione rimane invariata quando altri elettroliti sono aggiunti in soluzione. Sostituiamo per a12 in 1n Kp direttamente dall’equazione 1 e per aw dall’equazione 2 dopo aver moltiplicato l’equazione 2 per 0,108093 per rendere il coefficiente di 1n aw uguale a 6. Poiché Kp è indipendente dalla composizione, è evidente che
![]()
Dopo le necessarie sostituzioni dalle equazioni 1 e 2 e poi la sostituzione del valore medio m = 3.3835 dalle prime due corse nella tabella 1, si ottiene un’equazione per risolvere i sei coefficienti sconosciuti nell’equazione 1, e le cinque equazioni rimanenti si ottengono sostituendo ognuno dei cinque valori sperimentali del coefficiente medio di attività ionica di AlCl3 , y12 nella tabella 2, in
![]()
e poi sostituendo ogni risultato nell’equazione 1. Sei equazioni simultanee ottenute in questo modo sono poi risolte al computer. I risultati sono i seguenti:
C = -57,5723,
D = +142,0288,
E = -202,5581,
F = +161,1919,
G = -67,7831,
e H = +11,6880.
La sostituzione di questi valori nelle equazioni 1, 2 e 4 dà i valori di Y12, aw e Kp. I risultati sono elencati nella tabella 3 sotto il titolo “Risultati dell’ufficio:” Va notato che l’attività dell’acqua può ora essere calcolata dall’equazione 2, e la pressione di vapore dell’acqua sulla soluzione, P, da
aw = P/P°,……………………………….(7)
dove P° è la pressione di vapore dell’acqua pura alla stessa temperatura. Si noti che la pressione di vapore dell’acqua sulla soluzione satura è un po’ più della metà di quella sull’acqua pura poiché aw = 0,509. I risultati precedenti costituiscono la prima serie di dati sulle attività basate sulla solubilità del sale.
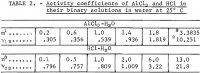
Nota.-In questa tabella, m si riferisce alla molalità di AlCl3, n si riferisce alla molalità di HCl, e la molalità è moli in 1 kg di acqua.
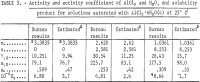
Nota.-In questa tabella, m si riferisce alla molalità di AlCl3, n si riferisce alla molalità di HCl, e la molalità è moli in 1 kg di acqua.
Stima delle attività nel sistema AlCl3-6H2O-H2O
Sono usati due metodi affidabili di stima per ottenere le attività nel sistema AlCl3-6H2O-H2O oltre i dati sperimentali diretti esistenti a m = 1,8. Il primo metodo, come descritto da Kusik e Meissner, dà un valore stimato di γ12 = 9,94 a 3,3835 m. Questo valore stimato è in stretto accordo con 10,251, il valore ottenuto nella presente indagine. Il corrispondente valore stimato dell’attività dell’acqua, aw, è 0,47, di nuovo in stretto accordo con il valore di 0,509 trovato nella presente indagine. La costante di equilibrio Kp calcolata da questi valori non è lontana da 6,8 x 10 5, considerando il fatto che la quarta potenza di a12 e la sesta potenza di aw sono moltiplicate per ottenere Kp.
Il secondo metodo di stima dovuto a Bromley dà 10,42 per γ12, un valore più vicino a quello ottenuto dal metodo precedente. Il coefficiente di attività dell’acqua è stato ottenuto dai presenti autori, integrando l’equazione di Gibbs-Duhem in cui sono stati utilizzati i valori di a12 stimati dal metodo Bromley. Il risultato è aw = 0,540. La media di entrambi i metodi è 0,505, che è in ottimo accordo con il valore del Bureau di 0,509. Il metodo Bromley, tuttavia, non contiene un metodo conveniente per la determinazione di aw incluso nel metodo Kusik-Meissner.
L’accordo dei valori stimati con i valori dai dati di solubilità non è sempre così buono come mostrato qui per ogni elettrolita ad ogni composizione. Per esempio, anche per AlCl3 a 1 m, le due stime di γ12 differiscono solo del 13% l’una dall’altra.
Prodotto di solubilità e attività nel sistema AlCl3-6H2O-HCl-H2O
L’effetto della crescente concentrazione di HCl sulla solubilità del sale è in gran parte dovuto alla crescente concentrazione degli ioni cloruro. La costante di equilibrio in questo caso con le attività a1 e a2 dei singoli ioni è
![]()
dove γ12 = γ1γ2 per definizione di γ12 dalle singole attività ioniche γ1 (per Al+++) e γ2 (per Cl-), e n è la molalità di HCl. Il valore di Kp è lo stesso dell’equazione 4, ma il lato destro dell’equazione 8 è diverso da quello dell’equazione 4. Si può notare che all’aumentare di n, m, la concentrazione di Al+++, deve diminuire, a condizione che γ12 e aw non diminuiscano molto; quindi, il sale precipita fuori, il che è noto come effetto salting out.
Il calcolo delle attività nella soluzione ternaria richiede un’equazione simile all’equazione 1 per HCl. Poiché i dati per l’HCl sono noti con precisione su un ampio intervallo di concentrazione, è possibile prendere un’equazione con tutte le variabili desiderate. La seguente equazione dà una rappresentazione accurata dei dati per il coefficiente di attività di HCl, γ32 dove il pedice 3 è per H+ e 2 per Cl-:
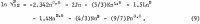
I dati selezionati per questo scopo da Haase, Naas e Thutnm sono elencati nella terza e quarta riga della tabella 2. I valori dei coefficienti calcolati da questi dati sono i seguenti:
J = -1,88416,
K = +2,24342,
L = -1,98545,
M = +1,00091,
N = -0,25934,
e P = +0,02634.
Le equazioni per le attività di AlCl3 e di H2O contengono questi coefficienti così come i coefficienti dei prodotti incrociati (m h/2)(n k/2), dove h e k sono interi, e queste equazioni sono le seguenti:
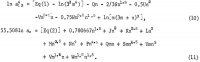
I cinque coefficienti aggiuntivi in queste equazioni sono determinati aggiungendo l’equazione 10 e 6 1n aw dall’equazione 11 per ottenere 1n Kp e utilizzando i seguenti dati di solubilità selezionati dalla tabella 1:
m: 2.620, 2.016, 1.333, 0.953, e 0.535.
n: 2.581, 4.460, 6.780, 8.397, e 10.063.
I calcoli risultanti danno i seguenti valori dei coefficienti nelle equazioni 10 e 11:
Q = +23,27027,
S = -22.47064,
U = +4.29102,
V = -9.76081,
e W = +4.60246.
I risultati per γ12, a12, aw, e Kp calcolati dalle equazioni precedenti sono elencati nella tabella 3. I valori di γ12 dall’equazione 9 sono in accordo con quelli di Harned e Gary a concentrazioni molto basse di HCl e AlCl3.
La pressione parziale di HCl(g), P32, su una soluzione può essere calcolata dalla seguente equazione (4):
Kp (HCl) = 4.94 x 10 -7 = P32/a²32………………………….(12)
dove Kp(HCl) è la costante di equilibrio a 25° C per H+ + Cl- = HCl(g), e a32 è l’attività ionica media di HCl in soluzione. A questo scopo, è necessario scrivere un’equazione per a32, simile all’equazione 10, utilizzando i parametri dell’equazione 11, come mostrato altrove in dettaglio.
L’effetto della temperatura sulla solubilità del sale è piccolo, come mostrato nella tabella 1. L’effetto sulle attività ioniche è quindi previsto essere piccolo poiché tutti i parametri nell’equazione 11 potrebbero essere ottenuti dai dati di solubilità se l’errore sperimentale fosse più piccolo di ±0.01 wt-pct per l’analisi dell’alluminio. In generale, per un intervallo di temperatura fino a circa 80° C, ogni parametro è una funzione lineare della temperatura, e questa dipendenza può essere determinata se l’equazione 11 fosse nota ad un’altra temperatura di almeno 50° C superiore a 25° C.
Stima delle attività nel sistema AlCl3-6H2O-HCl-H2O
I valori delle attività, il coefficiente di attività, e il prodotto di solubilità stimato nel presente rapporto secondo il metodo ideato da Kusik e Meissner, sono elencati nella tabella 3. Il coefficiente di attività γ12 per AlCl3 è circa il doppio del valore stimato per le soluzioni selezionate contenenti HCl. L’attività dell’acqua, aw, tuttavia, concorda bene con i valori stimati tranne che per m = 2,620. È evidente che i calcoli sarebbero stati notevolmente più affidabili se la pressione di vapore dell’acqua, aw, fosse stata misurata perché aw entra in Kp come aw, così che piccoli errori in aw causano grandi errori in γ12 e Kp . A questo scopo, si raccomanda un numero limitato di misurazioni della pressione di vapore per testare l’accuratezza dei presenti calcoli e dei metodi di stima.
La dipendenza dalla temperatura delle proprietà termodinamiche elencate nella tabella 3 può essere stimata come descritto da Kusik e Meissner. Tuttavia, è probabile che la stima produca un grado di dipendenza dalla temperatura superiore a quello indicato dalla debole dipendenza dalla temperatura della solubilità. Non si è potuto tentare di calcolare l’effetto della temperatura con il metodo del Bureau perché (1) a12 a basse concentrazioni di AlCl3 non è noto a varie temperature, (2) la solubilità di AlCl3 non potrebbe essere determinata con una precisione vicina a 0,01 pct in Al+++, e (3) la gamma di concentrazione di HCl a 65° e 85° C è troppo piccola per selezionare un numero sufficiente di dati di solubilità molto diversi per AlCl3 per determinare accuratamente i parametri nelle equazioni 10 e 11.
Sistema AlCl3-FeCl3-KCl-NaCl-HCl-H2O
I dati preliminari sulle solubilità di AlCl3, FeCl3, KCl, e NaCl in soluzioni acquose contenenti da 24 a 31 wt-pct HCl a 25° C sono stati ottenuti per valutare la contaminazione di AlCl3-6H2O estraibile da minerali non bauxitici. A questo scopo, sono stati preparati 2 litri di una soluzione contenente quantità note di sali, 90 ml di questa soluzione sono stati messi in un pallone per ogni corsa e poi è stata ammessa una quantità nota di HCl gassoso per raggiungere da 24 a 31 wt-pct di HCl dissolto. In questo intervallo di HCl in soluzione, cristalli anisotropi incolori di AlCl3-6H2O, cristalli anisotropi brillanti di FeCl3-2KCl-H2O, e cristalli cubici isotropi trasparenti di KCl e NaCl sono stati precipitati e identificati mediante esame microscopico. La procedura e le analisi per le concentrazioni di ioni alluminio e ioni cloruro sono state le stesse utilizzate per il sistema AlCl3-6H2O-HCl-H2O presentato in precedenza in questo rapporto. Inoltre, la concentrazione dello ione ferrico è stata determinata dalla titolazione standard K2Cr2O7, la concentrazione dello ione sodio è stata determinata dalle tecniche di assorbimento atomico, e la concentrazione dello ione potassio è stata determinata dalla sottrazione della concentrazione dello ione sodio da una determinazione delle concentrazioni combinate dello ione potassio più lo ione sodio dopo la separazione per scambio ionico. I risultati sono elencati nella tabella 4 e tracciati nella figura 3. Risultati simili di Miles sono anche tracciati in figura 3 per mostrare che l’accordo è eccellente. I dati pubblicati per sistemi correlati più semplici che contengono meno componenti sono stati compilati da Linke.
Nei processi di cristallizzazione evaporativa o con sparging di gas HCl per produrre cloruro di alluminio puro esaidrato, la contaminazione da altri cloruri metallici diventa un problema quando i livelli di impurità si accumulano nelle soluzioni di lisciviazione. La figura 3 mostra i livelli di concentrazione che impurità come NaCl, KCl, e FeCl2-2KCl-H2O cristallizzeranno anche dalla soluzione come fasi separate distinte, causando così la contaminazione dei cristalli di AlCl3-6H2O. Per esempio, a meno di 2,4 wt-pct FeCl3 in presenza di 1,6 wt-pct KCl a 25° C, la concentrazione di HCl deve essere inferiore a 28 wt-pct per evitare la contaminazione di AlCl3-6H2O dal sale doppio, FeCl3-2KCl-H2O. La figura 3 è anche utile nella ricristallizzazione frazionata del precipitato per purificare il sale di alluminio. Inoltre, alcuni dei sali degli elementi di transizione, come FeCl3, possono essere ridotti al minimo mediante elettrolisi parziale per placcare una quantità sufficiente di ferro prima dell’acidificazione con HCl.
Un trattamento termodinamico del sistema con il solito errore di ±0,05 wt-pct nella concentrazione di ioni cloruro non è fattibile, soprattutto in assenza di dati di pressione di vapore per H2O(g) e HCl(g). Tuttavia, stime approssimative delle attività possono essere fatte con il metodo Kusik-Meissner. Si prevede che tali stime potrebbero dare solo valori approssimativi delle attività per i sali idrati e complessi e per l’acqua.

Aree consigliate per la ricerca
Le misure delle attività sono utili per interpretare la termodinamica e la cinetica della lisciviazione, precipitazione e purificazione dei componenti desiderati di vari minerali. Ci sono due ragioni per cui le attività possono essere determinate accuratamente dalle misure della pressione di vapore dell’acqua: (1) La pressione di vapore può essere misurata con un alto grado di precisione da trasduttori di pressione differenziale per ottenere aw dall’equazione 7 e poi per calcolare i valori dei parametri nell’equazione 11 in modo che tutte le proprietà correlate possano essere calcolate come discusso in dettaglio in precedenza (2) Il prodotto di solubilità e le attività possono essere entrambi determinati accuratamente per i sali multivalenti che contengono un gran numero di molecole d’acqua nei loro cristalli idrati. La seconda ragione deriva dal fatto che l’esponente dell’attività dell’acqua nell’equazione 4 è uguale alle moli di acqua nel cristallo idratato.
Cloruro di alluminio in soluzioni acquose di acido cloridrico
Un altro tipo interessante di esperimento per il sistema ternario discusso qui è la misurazione della pressione parziale di HCl(g) su varie soluzioni contenenti quantità sufficientemente grandi di HCl dissolto. La procedura sperimentale per questo scopo è descritta altrove. Gruppo IIA, IIIA, e sali di metalli di transizione sono candidati eccellenti per questi tipi di indagini poiché elettroliti con valenze superiori a 1:1 di solito formano sali idrati.
La solubilità e l’attività del cloruro di alluminio esaidrato, AlCl3-6H2O, in soluzioni acquose sono stati determinati come parte del Bureau of Mines, U.S. Department of the Interior, ricerca per migliorare la tecnologia di lavorazione dei minerali per il recupero di allumina da risorse nazionali di basso grado. La solubilità di AlCl3 in acqua pura è stata trovata essere 31,09 e 31,77 wt-pct a 25° e 85° C, rispettivamente, ed è diminuita drasticamente a 10 e 0,1 wt-pct quando le rispettive quantità di 20,3 e 37 wt-pct di acido cloridrico (HCl) sono state aggiunte in soluzione. La costante di equilibrio per la solubilità dell’esaidrato, le attività e i coefficienti di attività di AlCl3 e H2O sono stati calcolati e confrontati con i risultati dei metodi di stima disponibili. I risultati hanno dimostrato di essere utili nella lisciviazione di minerali non bauxitici per l’estrazione di allumina cambiando le solubilità dei sali componenti all’aggiunta di HCl.
Sono state anche determinate le solubilità simultanee di AlCl3 , FeCl3, KCl, e NaCl in soluzioni di HCl-H2O e i loro effetti sulla purezza di AlCl3-6H2O cristallizzato da soluzioni di sale misto sono brevemente discussi.