Una pagina Microbial Biorealm sul genere Rhodospirillum rubrum
Classificazione
Tassi di ordine superiore
Kingdom: Batteri
Phylum: Proteobatteri
Classe: Alfaproteobatteri
Ordine: Rhodospirillales
Famiglia: Rhodospirillaceae
Genere: Rhodospirillum
Specie
Rhodospirillum rubrum
Descrizione e significato
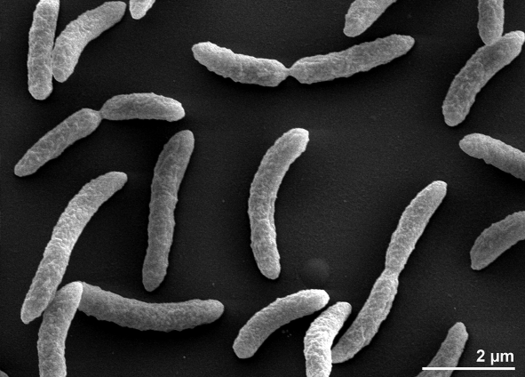
Rhodospirillum rubrum è un proteobatterio Gram-negativo, mesofilo. La sua temperatura ottimale di crescita è di 25-30 gradi Celsius. Ha involucri esterni multistrato, che contengono principalmente grassi insaturi, ma alcuni grassi saturi nella sua parete cellulare. R. rubrum è una spirilla, cioè ha una forma a spirale. È polarmente flagellato e quindi motile. La sua lunghezza è di 3-10 um, con una larghezza di 0,8-1,0 um.
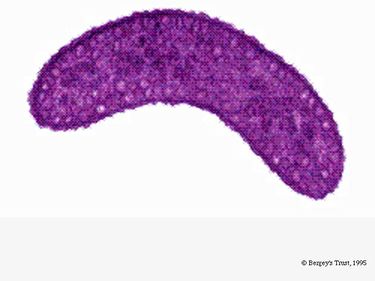
R. rubrum è un anaerobo facoltativo. A seconda della presenza di ossigeno, può subire la fermentazione alcolica o la respirazione aerobica. È anche capace di fotosintesi e contiene carotenoidi e baterioclorofilla nelle sue particelle cromatofore. Queste molecole aiutano ad assorbire la luce e a convertirla in energia e gli danno anche il suo distinto colore rosso porpora in condizioni anaerobiche. R. rubrum è incolore in condizioni aerobiche.
Anche se la fotosintesi è attiva in condizioni aerobiche, è generalmente soppressa in presenza di O2. Lo zolfo è il principale sottoprodotto della fotosintesi, non l’O2. R. rubrum può crescere eterotrofo o autotrofo quando è fotosintetico. A differenza di molte piante, R. rubrum non contiene clorofilla a (spettri di assorbimento 430-662 nm). Tuttavia, contiene clorofilla b (spettri di assorbimento 660-680 nm) e batterioclorofille (800-925 nm). Questo gli permette di utilizzare più energia dagli spettri elettromagnetici. R. rubrum ossida anche il monossido di carbonio (CO) con idrogeno gassoso come prodotto finale del percorso, e può utilizzare il solfuro a basse concentrazioni come donatore di elettroni nella riduzione del biossido di carbonio. Inoltre, è un batterio che fissa l’azoto; usa la nitrogenasi per convertire l’azoto atmosferico in ammoniaca (Munk et al, 2011).
Ci sono diverse applicazioni di R. rubrum nel campo della biotecnologia. È un sistema modello di conversione della luce in energia chimica e per le sue vie di fissazione dell’azoto. È anche oggetto di studi sulla resistenza alle radiazioni. Può essere utilizzato in diversi modi anche per il consumo. I proteobatteri possono essere una fonte di cibo per animali e fertilizzanti agricoli. Un altro ruolo importante nella ricerca include la produzione di vitamine. È anche oggetto di ricerca per la sua produzione di plastica biologica da precursori di poli-idrossi-butric-acido. R. rubrum può anche essere un contributore nei carburanti biologici a idrogeno, principalmente attraverso la sua evoluzione dell’enzima nitrogenasi.
Struttura del genoma
Il sequenziamento del genoma è finito. Consiste in un cromosoma circolare con 4.352.825 coppie di basi, il 65% delle quali sono coppie guanina-cistoina. C’è anche un plasmide con 53.732 coppie di basi con il 60% di guanina-citosina. In totale, ci sono 3.850 geni codificanti proteine e 83 geni RNA. Di questi geni, il 6,9% è legato alla trascrizione; il 4,6% alla traduzione, alla struttura dei ribosomi e alla biosintesi; il 4,0% alla replicazione, ricombinazione e riparazione; il 7,9% ai meccanismi di trasduzione del segnale; il 5,9% alla parete cellulare e alla biogenesi della membrana; il 6,6% alla produzione e conversione di energia; il 5,0% al trasporto e metabolismo dei carboidrati; il 9,9% al trasporto e metabolismo degli aminoacidi.9% trasporto e metabolismo degli aminoacidi; 4,7% trasporto e metabolismo dei coenzimi; 3,7% trasporto e metabolismo dei lipidi; e 6,5% trasporto e metabolismo degli ioni inorganici (Munk et al, 2011).
Ecologia
Dato che il Rhodospirillum rubrum può crescere sia aerobicamente che anaerobicamente, è capace di abitare un’ampia varietà di condizioni. R. rubrum si trova in molti ambienti acquatici naturali come stagni, laghi, ruscelli e acque stagnanti (Reslewic et. al, 2005). R. rubrum si trova spesso anche nel fango e nelle acque di scarico (Brock et al, 2000). Gli studi hanno dimostrato che R. rubrum può fare grandi cambiamenti nella sua composizione chimica per adattarsi ad ambienti diversi (Cohen-Bazire e Kunisawa, 1963). R. rubrum preferisce crescere in habitat con un pH di 6,8-7,2 (Bergey e Holt, 1994). Gli studi hanno anche dimostrato che R. rubrum ha una temperatura di crescita ottimale di 22-35 gradi Celsius (Weaver, 1971).
Struttura cellulare e metabolismo
R. rubrum è un organismo versatile che può ottenere energia attraverso una varietà di meccanismi. I meccanismi di respirazione e fotosintesi esistono insieme e la loro attività dipende dalla presenza di luce ed energia. R. rubrum può crescere in ambienti chemo-tropicali bui con la presenza di ossigeno o può crescere in un ambiente foto tropicale senza ossigeno.
La fotosintesi in R. rubrum inizia con la donazione di un idrogeno da un substrato organico a un substrato ossidante. La batterioclorofilla e i cartenoidi, i pigmenti fotoreattivi che si trovano nella membrana cellulare, sono legati ai cromatofori (Schachman, Pardee e Stanier, 1952). I cromatofori sono dischi appiattiti che contengono fosfolipidi di colina, cardio lipina e digliceridi galattosilici (Benson, Wintermans e Wiser, 1959; Benson 1961). Inoltre, i cromatofori contengono una catena di trasporto degli elettroni completa che include vari citocromi, flavin e nucleotidi di piridina (Newton e Newton, 1957; Hulcher e Conti, 1960; Kamen, 1961). La membrana cellulare contiene anche un macchinario per la sintesi dell’ATP, compresa un’ATP sintetasi.
In presenza di ossigeno, R. rubrum è in grado di respirare aerobicamente utilizzando una tradizionale catena di trasporto degli elettroni con NAD+/NADH come trasportatore primario di elettroni (Keister e Minton, 1969). Tra le proteine di trasporto degli elettroni c’è il citocromo C428 (Chance e Smith, 1955). La respirazione aerobica, tuttavia, è inibita dalla fotosintesi (Oelze e Weaver, 1971).
R. rubrum è anche capace di respirazione anaerobica. I suoi accettori di elettroni terminali non ossigenici possono includere il dimetilsolfossido e l’ossido di trimetilammina. La presenza di questi accettori di elettroni rende possibile per substrati come il succinato, il malato e l’acetato sostenere la crescita di R. rubrum. Questi accettori, tuttavia, sono solo circa il 33-41% più efficienti dell’ossigeno in termini di conservazione dell’energia (Schultz e Weaver, 1982).
Inoltre, R. rubrum ha la capacità unica di ossidare il monossido di carbonio usando il monossido di carbonio deidrogenasi. Questa via di ossidazione termina con la riduzione e l’idrogeno e la produzione di gas idrogeno.
Senza un accettore di elettroni terminale, R. rubrum completa la fermentazione acida mista. I principali prodotti della fermentazione del piruvato sono acetato, formiato, anidride carbonica e idrogeno. In presenza di ione bicarbonato, il fruttosio può essere fermentato. I prodotti finali di questa via sono gli stessi del piruvato ma con l’aggiunta di succinato e propionato (Schultz e Weaver 1982).
Oltre ad avere la capacità di fissare l’anidride carbonica (Schon e Biedermann, 1972), una proprietà anabolica identificativa di R. rubrum è la sua capacità di fissare l’azoto. In condizioni di oscurità con la presenza di fruttosio, R. rubrum usa la nitrogenasi per fissare l’azoto gassoso in ammonio. Contiene sia nitrogenasi Fe-Mo che solo Fe.
Patologia
R. rubrum non è stato trovato per infettare uomini o animali.
Ricerca attuale
Resistenza alle radiazioni
Rhodospirillum rubrum ha recentemente fornito informazioni sulla resistenza alle radiazioni. Felice Mastroleo et al, in Insight into the radiotolerance of the life support bacterium Rhodospirillum rubrum S1H by means of phenotypic and transcriptomic methods (2010), hanno caratterizzato la tolleranza alle radiazioni di R. rubrum.
Sottoponendo i batteri a dosi sub-letali di raggi gamma Cobalt-60, un tipo di radiazione ionizzante, i geni marcatori di R. rubrum specifici alle radiazioni ionizzanti sono stati caratterizzati nell’organismo. Questi geni sono aumentati in espressione con il “tempo di recupero” trascorso dopo un dato trattamento di radiazioni gamma. L’analisi dell’espressione genica di R. rubrum dopo la radiazione gamma crea il potenziale per ulteriori ricerche microbiologiche che possono portare a progressi nella resistenza alle radiazioni applicate in futuro.
Plastiche biodegradabili
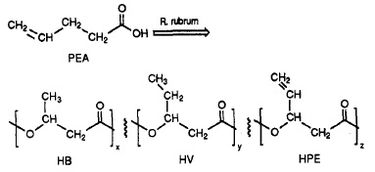
R. rubrum risulta produrre una classe di plastiche biodegradabili, i poli beta-idrossialcanoati (PHA). Le applicazioni di questa ricerca possono risolvere molti problemi causati dalle plastiche sintetiche e non degradabili che hanno avuto un impatto negativo sull’ambiente. Un esperimento di ricerca eseguito da Herbert. W. Ulmer et al. ha descritto la produzione di PHAs contenenti unità 3HV da Rhodospriillum rubrum (1993). Ulmer ha usato l’acido 4-pentenoico (PEA) come mezzo di crescita per R. rubrum. Quando il batterio è stato messo in “condizioni di produzione di PHA”, sono stati sintetizzati PHA contenenti 3 subunità ripetute (nota: R = gruppo sostituente): HB (R = metile), HV (R = etile), HPE (R = vinile) (Vedi Figura 1).
La sintesi di plastiche funzionali e biodegradabili da parte dei batteri ha il potenziale di ridurre l’inquinamento globale e la spesa di carburante delle fabbriche di plastica. R. rubrum può essere usato come strumento microbiologico per produrre biopolimeri ecologici.
Energia rinnovabile
La crescente preoccupazione per l’inquinamento ambientale dovuto alla combustione di combustibili fossili ha portato ad un aumento della ricerca su Rhodospirillum rubrum. L’uso di R. rubrum come fonte di idrogeno da utilizzare nei combustibili rinnovabili a idrogeno affronta diversi problemi creati dal consumo di combustibili fossili. L’idrogeno si ossida in acqua come prodotto della combustione, a differenza dei combustibili fossili che creano inquinanti come CO, CO2, SOx e NOx. R. rubrum può produrre idrogeno utilizzando la seguente “reazione di spostamento acqua-gas” (Najafpour et al, 2004):
CO + H2O → H2 + CO2
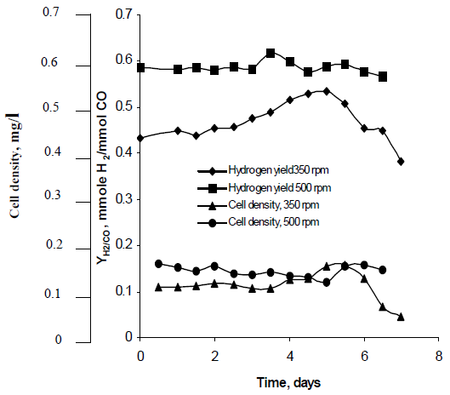
Il metodo di ricerca di Najafpour ha osservato come l’agitazione, creata da serie di giranti a turbina impostate a tassi di 350 rpm e 500 rpm, ha influenzato i tassi di produzione di idrogeno di R. rubrum. La sua ricerca ha scoperto che l’idrogeno combustibile ha il potenziale per frenare il riscaldamento globale e fornire una soluzione tecnologica ecologica per la produzione e il consumo di carburante. Il suo studio ha rivelato che “un tasso di agitazione più elevato ha prodotto un idrogeno più elevato così come la densità delle cellule” di R. rubrum (Vedi Figura 2).
In un altro studio microbiologico, eseguito da Matthew Ross Melnicki, si è scoperto che R. rubrum fornisce il potenziale per l’energia rinnovabile, come il carburante a idrogeno, attraverso la sintesi dell’idrogeno. I suoi percorsi biologici possono produrre idrogeno a tassi elevati quando vengono coltivati insieme a Chlamydomonas reinhardtii, una specie algale con cui R. rubrum può crescere armoniosamente. Melnicki ha proposto un approccio di co-coltivazione non convenzionale per sintetizzare l’idrogeno che ha prodotto livelli potenziati di sintesi di idrogeno che non possono essere raggiunti se la co-coltivazione è disaccoppiata. C. reinhardtii era favorita a intensità di luce più elevate, mentre R. ruburm era più produttiva sotto intensità di luce più basse, evidenziando i vantaggi della loro co-coltivazione.
Utilizzando una tecnica fed-batch per la coltivazione di R. rubrum, si è scoperto che le culture inoculate producevano idrogeno durante la fase di crescita esponenziale, e la sintesi di idrogeno continuava a fiorire continuamente per 70 ore. Quando la crescita è cessata, Melnicki ha aggiunto succinato, che agisce come un donatore di elettroni nella via metabolica, e l’evoluzione dell’idrogeno è ripresa anche se i batteri non crescevano più. Tuttavia, è importante notare che con l’aggiunta continua di succinato, sono stati trovati tassi ridotti di evoluzione dell’idrogeno. Una volta aggiunti ulteriori mezzi di crescita, i tassi di produzione di idrogeno sono aumentati ancora una volta.
Melnicki ha anche dichiarato, “mentre la crescita non è richiesta per la produzione di idrogeno, questo lavoro stabilisce la necessità della crescita cellulare per mantenere i tassi massimi, suggerendo l’idoneità industriale di una strategia di cultura semi-continua” (Melnicki, 2009).
Cool Factor
La sequenza del genoma di Rhodospirillum rubrum è solo la seconda del genere Rhodospirillum che è stata pubblicata, dopo R. centenum (Munk et al, 2011).

Un aspetto interessante di Rhodospirillum rubrum è la sua capacità di cambiare colore in diverse condizioni. È un fototrofo anossigenico, ma non produce ossigeno extracellulare. Invece, produce zolfo elementare durante la raccolta della luce. Ciò è dovuto al fatto che R. rubrum manca del complesso 2 di raccolta della luce (Munk et al, 2011). Il batterio utilizza la batterioclorofilla, che gli permette di assorbire lunghezze d’onda della luce che le piante non utilizzano. La batterioclorofilla assorbe lunghezze d’onda 800-925 nm.
In condizioni aerobiche, l’attività fotosintetica di R. rubrum è geneticamente soppressa, e il batterio diventa incolore. In condizioni anaerobiche, tuttavia, la fotosintesi è attivata e il batterio assume un distinto colore rosso porpora (vedi immagine 5). Ciò è dovuto all’attività dei cromatofori, che si trovano nella membrana (Munk et al, 2011). I cromatofori contengono i pigmenti batterioclorofilli del batterio, e subiscono cambiamenti di assorbimento durante l’attivazione della fotosintesi.
Benson, A. “Metabolismo dei lipidi del cloroplasto”. In Symposium no. VI. 5° Congresso Internazionale di Biochimica. 1961. Oxford: Pergamon Press. (In the Press.)
Benson, A., Wintermans, J. e Wiser, R. “Lipidi del cloroplasto come serbatoi di carboidrati”. Fisiologia vegetale. 1959. Volume 34. p. 815.
Bergey, D. e Holt, J. Bergey’s manual of determinative bacteriology. Nona edizione. Baltimora. Lippincott Williams e Wilkins. 1994. p. 359.
Brock, T.D., M.T. Madigan, J.M. Martinko, and J Parker. Biologia dei microrganismi. 9° Edizione. Upper Saddle River: Prentice Hall, 2000. p. 459.
Chance, B. and Smith, L. “Pigmenti respiratori di Rhodospirillum rubrum”. Natura. Volume 174. p. 803-806.
Cohen-Bazire, G. e Kunisawa, R. “La struttura fine di Rhodospirillum Rubrum .” Giornale di biologia cellulare. 1963. Volume 16. p. 401-419.
Hulcher, M. e Conti, S. “Citocronie in particelle contenenti clorofilla di Chromatium e Chlorobium thiosuphatophilum.” Comunicazioni di ricerca di biochimica e biofisica. 1960. Volume 3. p. 497.
Kamen, M. “Le proteine Haem dei tessuti fotosintetici”. In Symposium no. VI. 5° Congresso Internazionale di Biochimica. 1961. Oxford: Pergamon Press. (In the Press.)
Keister, D. e Minton, N. “reazioni legate all’energia nei batteri fotosintetici. 3. Ulteriori studi sulla riduzione di nicotinamide-adenina dinucleotide legata all’energia da parte dei cromatofori di Rhodospirillum rubrum”. Biochimica. 1969. Volume 8. p. 167-173.
Mastroleo, F., Monsieurs, P., and Leys, N. “Insight into the radiotolerance of the life support bacterium Rhodospirillum rubrum S1H by means of phenotypic and transcriptomic methods”. Assemblea scientifica COSPAR. 2010. p. 4.
Melnicki, M. R. “Modalità di produzione di idrogeno nel batterio fotosintetico Rhodosphirillum rubrum”. Università della California, Berkeley. 2009.
Munk, C., Copeland, A., Lucas, C., Lapidus, A., et al. “Complete genome sequence of Rhodospirillum rubrum type strain (S1T)”. Norme in scienze genomiche. 2011. Volume 4. pp. 293-302.
Najafpour, G., Ismail, K., Younesi, H., Mohamed, A. R., and Kamaruddin, A. H. “Hydrogen as clean fuel via continuous fermentation by anaerobic photosynthetic bacteria, Rhodospirillum rubrum”. Giornale africano di biotecnologia. 2004. Volume 3. pp. 503-507.
Newton, J. e Newton, G. “Composizione delle particelle subcellulari fotoattive di Chromatium”. Gli archivi di biochimica e biofisica. 1957. Volume 71. p. 250.
Oelze, J. e Weaver, P. “L’adattamento di cellule cresciute fotosinteticamente di Rhodospirillum rubrum a condizioni di luce aerobica”. Gli archivi di microbiologia. 1982. Volume 79. p. 108-121.
Reslewic, S., Shigou, Z., Place, M., Zhang, Y., Briska A., Goldstein, S., Churas, C., Runnheim, R., Forrest, D., Lim, A., Lapidus, A., Han, C., Roberts, G., e Schwartz, D. “Whole-Genome Shotgun Optical Mapping of Rhodospirillum rubrum .” Microbiologia applicata e ambientale. 2005. Volume 71. p. 5511-5522.
Schachman, H., Pardee, A., e Stanier, R. “Studi sull’organizzazione macromolecolare delle cellule microbiche”. Gli archivi di biochimica e biofisica. 1952. Volume 38. p. 245-260.
Schön, G. e Biedermann, M. “Sintesi di acidi volatili dalla fermentazione di piruvato e fruttosio in colture scure anaerobiche di Rhodospirillum rubrum.” Archiv fur Mikrobiologie.1972. Volume 85. p. 77-90.
Schultz, J. e Weaver, P. “Fermentazione e respirazione anaerobica di Rhodospirillum rubrum e Rhodopseudomonas capsulate.” Il Journal of Bacteriology. 1982. Volume 149. p. 181-190.
Ulmer, H., Gross, R., Posada, M., Weisbach, P., Fuller, R. C., e Lenz, R. “Produzione batterica di poli(.beta.-idrossialcanoati) contenenti unità ripetute insature da Rhodospirillum rubrum”. Macromolecole. 1994. Volume 27. p. 1675-1679.
Weaver, P. “Temperature-Sensitive Mutations of the Photosynthetic Apparatus of Rhodospirillum rubrum.” Atti dell’Accademia Nazionale delle Scienze degli Stati Uniti d’America. 1971. Volume 68. p. 136-138.
Redatto dagli studenti della dottoressa Iris Keren: Allison Almeida, Matthew Cozzolino, Trung Nguyen, e Jessica Wong.
NEUF2011