Proprietà dell’acqua
Una delle cose che rende speciale il nostro pianeta è la presenza di acqua liquida. L’acqua è fondamentale per tutta la vita; senza di essa ogni essere vivente morirebbe.
L’acqua copre circa il 70% della superficie terrestre e costituisce il 65-75% del nostro corpo (l’82% del nostro sangue è acqua). Anche se l’acqua può sembrare noiosa – nessun colore, sapore o odore – ha proprietà sorprendenti che la rendono necessaria per sostenere la vita.
(Il nostro bisogno di acqua e gli animali dell’oceano che vivono in acqua, è ciò che rende le fuoriuscite di petrolio così dannose.)
La composizione chimica dell’acqua è H2O – due atomi di idrogeno e uno di ossigeno. Le proprietà dell’acqua sono speciali a causa del modo in cui i suoi atomi si legano insieme per formare una molecola d’acqua, e il modo in cui le molecole interagiscono tra loro.
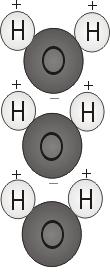
Polarità dell’acqua
Quando i due atomi di idrogeno si legano con l’ossigeno, si attaccano alla cima della molecola come le orecchie di Topolino. Questa struttura molecolare dà alla molecola d’acqua la polarità, o una carica elettrica sbilenca che attrae altri atomi.
L’estremità della molecola con i due atomi di idrogeno è carica positivamente. L’altra estremità, con l’ossigeno, è caricata negativamente. Proprio come in una calamita, dove i poli nord sono attratti dai poli sud (“gli opposti si attraggono”), l’estremità positiva della molecola dell’acqua si collegherà con l’estremità negativa di altre molecole.
Cosa significa questo per noi? La polarità dell’acqua le permette di sciogliere molto facilmente altre sostanze polari. Quando una sostanza polare viene messa in acqua, le estremità positive delle sue molecole sono attratte dalle estremità negative delle molecole dell’acqua e viceversa. Le attrazioni fanno sì che le molecole della nuova sostanza si mescolino uniformemente con le molecole d’acqua.
L’acqua scioglie più sostanze di qualsiasi altro liquido – anche l’acido più forte! Per questo motivo, è spesso chiamata il “solvente universale”. Il potere dissolvente dell’acqua è molto importante per la vita sulla Terra. Ovunque vada, l’acqua trasporta sostanze chimiche disciolte, minerali e nutrienti che sono usati per sostenere gli esseri viventi.
A causa della loro polarità, le molecole d’acqua sono fortemente attratte l’una dall’altra, il che dà all’acqua un’alta tensione superficiale. Le molecole sulla superficie dell’acqua si “attaccano insieme” per formare una specie di “pelle” sull’acqua, abbastanza forte da sostenere oggetti molto leggeri. Gli insetti che camminano sull’acqua approfittano di questa tensione superficiale.
La tensione superficiale fa sì che l’acqua si raggruppi in gocce piuttosto che diffondersi in uno strato sottile.
Permette anche all’acqua di muoversi attraverso le radici e gli steli delle piante, i termometri e i più piccoli vasi sanguigni del tuo corpo. Quando una molecola si muove verso l’alto, “trascina” le altre con sé.
Tre stati della materia
L’acqua è uno dei quattro elementi e l’unica sostanza naturale che può esistere in tutti e tre gli stati della materia – solido, liquido e gas – alle temperature che si trovano normalmente sulla Terra.
Molte altre sostanze devono essere surriscaldate o raffreddate per cambiare stato.
Lo stato gassoso dell’acqua è presente continuamente nella nostra atmosfera come vapore acqueo. Lo stato liquido si trova ovunque nei fiumi, nei laghi e negli oceani.
Lo stato solido dell’acqua, il ghiaccio, è unico. La maggior parte dei liquidi si contrae quando vengono raffreddati, perché le molecole si muovono più lentamente e hanno meno energia per resistere all’attrazione reciproca. Quando si congelano in solidi, formano cristalli strettamente impacchettati che sono molto più densi del liquido originale.
L’acqua non si comporta così. Quando si congela, si espande: le molecole si allineano per formare una struttura cristallina molto “aperta” che è meno densa dell’acqua liquida.
Ecco perché il ghiaccio galleggia. Ed è un bene che lo faccia! Se l’acqua si comportasse come la maggior parte degli altri liquidi, i laghi e i fiumi si congelerebbero e tutta la vita morirebbe.
Tre altre proprietà dell’acqua
L’acqua ha un alto calore specifico. Cioè, a differenza dell’aria, l’acqua può assorbire molto calore senza cambiare temperatura. Ecco perché nuotare è così rinfrescante in una giornata calda.
L’acqua perde anche il calore più lentamente dell’aria. Il risultato è che in estate, l’acqua dei laghi e degli oceani è di solito più fredda all’inizio della stagione e più calda alla fine della stagione (dopo molti giorni di assorbimento dell’energia solare).
Il punto di ebollizione dell’acqua (212° F o 100°C a livello del mare) è influenzato dall’altitudine. In generale, più alta è l’altitudine, più basso è il punto di ebollizione dell’acqua. Per esempio, a Denver, CO (5.280 piedi), l’acqua bolle a 202,4° F. Sul Monte Everest in Nepal (29.012 piedi), l’acqua bolle a 156° F.
Progetti di scienze dell’acqua:
- Il ciclo dell’acqua
- Ruota dell’acqua
- Acqua super raffreddata
- Serbatoio dell’acqua