- Background
- Fisiologia normale e fisiopatologia del potassio
- Potenziale d’azione di un cardiomiocita non pacemaker
- Potenziale d’azione di una cellula pacemaker cardiaca
- Conduzione della corrente
- Periodo refrattario
- Iperkalemia, classificazione e cause
- Classificazione
- Cause
- Effetti dell’iperkaliemia
- Effetti metabolici
- Pompa sodio-potassio
- Conclusione
Background
Il potassio è un catione morbido, bianco-argenteo altamente reattivo appartenente alla famiglia dei metalli alcalini della tavola periodica. È il catione più abbondante nel corpo umano nel suo complesso, e lo ione più diffuso nei suoi compartimenti intracellulari.
In media, una dieta occidentale contiene da 80-100 mEq di potassio al giorno, e in condizioni fisiologiche normali, il 90% di esso viene assorbito passivamente, lasciando solo 9,0 mmol per l’escrezione fecale. I 3500-4000 mmol conservati nel corpo sono sproporzionati ai livelli plasmatici diurni di potassio che sono normalmente mantenuti nell’intervallo di 3,5-5,3 mmol/L attraverso uno stretto meccanismo di omeostasi con i livelli più bassi di notte e nelle prime ore del mattino e il più alto livello di picco nelle ore del pomeriggio.
Una volta assorbito nel flusso sanguigno, diventa il ruolo del rene per abbinare l’assunzione di potassio alla produzione di potassio, che richiede diverse ore, durante le quali il “bilancio interno del potassio” sotto l’influenza di insulina e catecolamine mantiene l’omeostasi temporanea spostando il potassio tra gli spazi intracellulari ed extracellulari. La stimolazione dei recettori alfa impedisce l’entrata del potassio nelle cellule, mentre la stimolazione dei recettori beta la promuove attivando la pompa sodio-potassio ATPasi.
La pompa sodio-potassio ATPasi è l’enzima gate-keeper situato nel sarcolemma. Aiuta a salvaguardare il 98% del potassio (circa 144,0 mmol) trattenuto all’interno della cellula. Questo assicura la conservazione della differenza di potenziale vitale attraverso le membrane cellulari necessaria per il corretto funzionamento delle cellule, in particolare le cellule eccitabili come le cellule nervose e le cellule muscolari cardiache.
Fisiologia normale e fisiopatologia del potassio
Dopo il suo rapido assorbimento, il potassio aiuta a orchestrare i propri livelli corporei attraverso il rilascio di insulina e aldosterone. Altri stimoli corporei intrinseci che si trovano anche a controllare i livelli corporei di potassio includono i recettori beta-2 adrenergici, il PH alcalino del sangue e l’anabolismo cellulare.
Rilascio di insulina e aldosterone: Il potassio ingerito entra rapidamente in circolazione. Quando raggiunge la circolazione portale, stimola il pancreas a rilasciare insulina. Contemporaneamente, il potassio circolante che raggiunge le cellule juxtaglomerulari provoca il rilascio di renina. La renina, raggiungendo il fegato, viene convertita in angiotensina I. L’angiotensina I viaggia verso i polmoni dove viene convertita in angiotensina II. L’angiotensina II completa quindi il suo viaggio di ritorno ai reni attraverso il sangue circolante per stimolare la zona glomerulosa a secernere aldosterone.
Equilibrio interno del potassio: L’insulina rilasciata post-prandialmente agisce principalmente sui muscoli scheletrici, attivando due vie, la via AKT-dipendente responsabile dell’inserimento del trasportatore di glucosio GLUT4 e la via APK che attiva la sodio potassio ATPasi cellulare per spostare il potassio nello spazio intracellulare. A differenza della via AKT-dipendente, la via APK non è compromessa né dalla sindrome metabolica né dalla malattia renale cronica (Figura 1).
Escrezione: Il potassio filtrato dai glomeruli renali viene passivamente riassorbito nel tubulo prossimale e nell’ansa di Henle in proporzione alla quantità di sodio e di acqua fornita. Normalmente solo il 10% circa del carico filtrato raggiunge il nefrone distale.
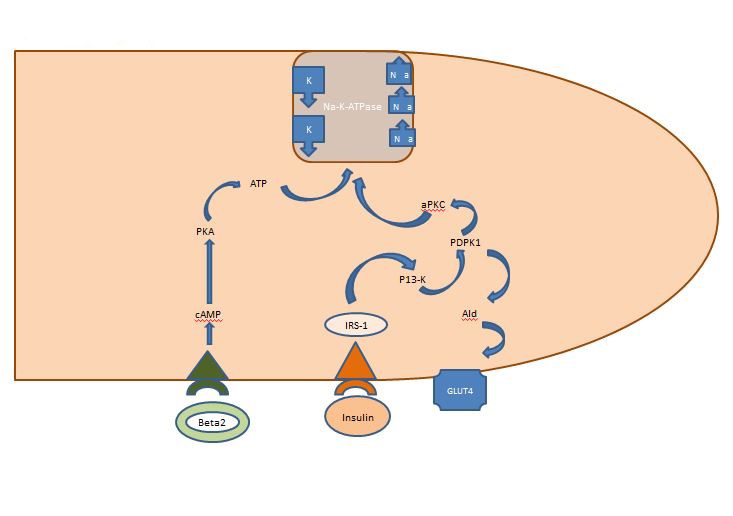
Figura 1. Azione dell’insulina su una cellula muscolare scheletrica. L’insulina rilasciata post-prandialmente attiva due vie nei muscoli scheletrici, la via AKT-dipendente responsabile dell’inserimento del trasportatore di glucosio GLUT4 e la via APK che attiva la sodio potassio ATPasi cellulare per spostare il potassio nello spazio intracellulare.
All’inizio del tubulo convoluto distale, inizia la secrezione di potassio in eccesso che aumenta progressivamente man mano che si avanza verso il nefrone distale e nel dotto collettore. Ciò è mediato dall’upregulation dell’idrogeno potassio ATPasi sulle cellule alfa-intercalate.
La presenza di livelli più elevati di potassio nelle cellule peritubulari dei reni attiva il sistema RAAS per rilasciare aldosterone, che attiva la sodio potassio ATPasi nella membrana basolaterale, con conseguente diminuzione del sodio intracellulare che porta all’aumento del trasporto elettrogenico di assorbimento del potassio iperpolarizzando la tensione di membrana e permettendo la sua escrezione nelle urine .
Nella iperkaliemia, la quota di potassio escreta attraverso il colon può aumentare fino al 30%, ad es, nei casi di insufficienza renale, dove il potassio viene poi attivamente assorbito dalla pompa sodio potassio ATPasi attivata nella membrana basolaterale degli enterociti del colon, per essere escreto dall’altra parte, nel lume del colon attraverso i grandi canali di potassio calcio-dipendenti apicali delle cellule.
Da quanto sopra si evince che il meccanismo dell’omeostasi dei livelli plasmatici di potassio è ordinato principalmente dall’interazione di tre transazioni simultanee – assunzione di potassio, spostamenti intra/extracellulari di potassio ed escrezione urinaria di potassio, che dipendono tutte dalla pompa sodio-potassio.
Per comprendere il meccanismo del pericolo imminente dell’iperkaliemia e la sua gestione, bisogna capire la fisiologia del potenziale d’azione e le viscere dell’enzima sodio potassio ATPasi.
Elettrofisiologia del potenziale d’azione, cioè, il movimento ionico attraverso le membrane cellulari, è determinato dalla differenza di due potenziali, un “potenziale chimico” in cui gli ioni si muovono lungo il loro gradiente di concentrazione e un “potenziale elettrico” in cui gli ioni e le molecole respingono cariche simili, producendo il potenziale transmembrana (TMP), che si dice +ve quando il movimento netto di ioni +ve è verso l’esterno della cellula e viceversa.
Potenziale d’azione di un cardiomiocita non pacemaker
Ci sono cinque fasi in un potenziale d’azione, che iniziano e finiscono alla fase 4. Le pompe coinvolte in questo processo includono lo scambiatore sodio-calcio del sarcolemma, l’ATPasi del calcio e, infine, l’ATPasi sodio-potassio.
- Fase 4. La fase di riposo: ha un potenziale di riposo di -90 mV come risultato del costante movimento verso l’esterno del potassio attraverso i canali rettificatori interni. Durante questa fase, entrambi i canali del sodio e del calcio sono chiusi.
- Fase 0. La fase di depolarizzazione: lo sparo di una cellula pacemaker o la sua conduzione attraverso una cellula vicina innesca l’aumento del TMP sopra i -90 mV. A questo punto, i “canali veloci del sodio” iniziano ad aprirsi uno dopo l’altro, permettendo al sodio di entrare nella cellula, aumentando il TMP e, una volta che un numero sufficiente di canali veloci del sodio si sono aperti per produrre -70 mV, si mette in moto una corrente di sodio in entrata autosostenuta, depolarizzando rapidamente il TMP a 0 mV per un intervallo transitorio noto come “overshoot”, a quel punto i canali veloci del sodio dipendenti dal tempo si chiudono e i canali del calcio “a lunga apertura” si aprono per aumentare il TMP a -40 mV e consentire un piccolo afflusso costante di calcio lungo il suo gradiente di concentrazione.
- Fase 1. La fase di ripolarizzazione precoce: inizia con il TMP leggermente +ve e la breve apertura di alcuni canali del potassio con conseguente flusso verso l’esterno della cellula, riportando il TMP a circa 0 mV.
- Fase 2. La fase di plateau: qui le due controcorrenti sono elettricamente bilanciate e portano al mantenimento del TMP bilanciato a poco meno di 0 mV. “I canali del calcio a lunga apertura” sono ancora aperti, con conseguente flusso costante di calcio nella cellula. Il canale del potassio a rettifica ritardata permette il passaggio del potassio all’esterno della cellula lungo il suo gradiente di concentrazione.
- Fase 3. La fase di ripolarizzazione: durante questa fase, i canali del calcio sono gradualmente inattivati e il flusso persistente di potassio verso l’esterno della cellula supera così il flusso di calcio in entrata, restituendo il potassio allo spazio intracellulare e il sodio e il calcio all’esterno della cellula.
Potenziale d’azione di una cellula pacemaker cardiaca
Le cellule pacemaker cardiache hanno un’automaticità innata, permettendo la loro depolarizzazione in cicli ritmici. Il nodo senoatriale (SAN) ha il più alto ritmo di depolarizzazione autoiniziato ad un tasso di 60-90/min, seguito dal nodo atrioventricolare (AVN) ad un tasso di 40-60/min e poi le fibre di Purkinje e il muscolo ventricolare a 20-40/min.
I potenziali di membrana delle cellule pacemaker sono instabili e i loro potenziali di azione non hanno fasi ben definite. Hanno un minor numero di canali del potassio rettificatore interno e il loro TMP non scende mai al di sotto di -60 mV, eliminando il ruolo dei canali veloci del sodio che richiedono un TMP di -90 mV con conseguente assenza della fase di depolarizzazione rapida.
Al TMP >-60 mV, la corrente “funny/pacemaker” entra in azione con un flusso spontaneo di ioni attraverso i canali lenti del sodio, depolarizzando il TMP a <-50 mV e poi di nuovo a -60 mV quando i canali del calcio si chiudono.
Conduzione della corrente
Tutti i cardiomiociti sono accoppiati elettricamente attraverso la giunzione gap, compresa la cellula pacemaker. Questo facilita la depolarizzazione diffusa di tutte le cellule vicine, trasformando il cuore in un’unità funzionale in cui la cellula con il più alto tasso intrinseco diventa il “pacemaker”.
Periodo refrattario
Il periodo refrattario più lungo durante il lungo plateau nella fase 2 dovuto ai canali lenti del calcio fornisce il tempo necessario per lo svuotamento completo dei ventricoli prima della contrazione successiva. I periodi refrattari possono essere assoluti (ARP), effettivi (ERP) o relativi (RRP). In un ARP, la cellula non è assolutamente eccitabile.
Un ERP dura dall’ARP fino al breve segmento della fase 3. Uno stimolo a questo punto potrebbe depolarizzare minimamente la cellula, ma il livello di depolarizzazione è più debole della propagazione di un potenziale d’azione alle cellule vicine.
L’ERP è provocato da uno stimolo superiore alla norma, che porta alla depolarizzazione della cellula e alla produzione di un potenziale d’azione.
Un “periodo sovra-normale” è uno stato ipereccitabile durante il quale uno stimolo più debole del normale potrebbe portare a un’aritmia, rendendo necessaria la sincronizzazione durante la cardioversione per evitare la fibrillazione ventricolare (Figura 2).
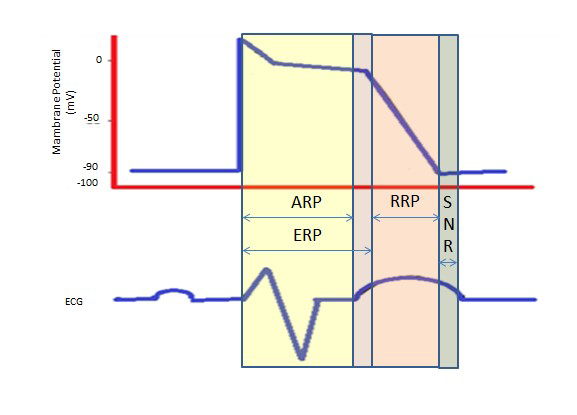
Figura 2. Periodi refrattari. ARP: Periodo refrattario assoluto; ERP: Periodo Refrattario Effettivo; RRP: Periodo Refrattario Relativo; SNR: Periodo Refrattario Supranormale
Iperkalemia, classificazione e cause
Classificazione
L’iperkalemia è classificata come lieve quando i livelli sono nel range di 5,5-6,0 mmol/L, moderata da 6,1-6,9 mmol/L e grave a livelli di 7.0 mmol/L o superiore, e a qualsiasi livello in cui si verificano cambiamenti ECG.
Cause
L’iperkaliemia si verifica quando i meccanismi di compensazione non sono più in grado di far fronte allo squilibrio, motivo per cui di solito è multifattoriale.
- Incremento dell’assunzione di potassio attraverso qualsiasi via, ad es, assunzione orale con la dieta, o somministrazione endovenosa di liquidi contenenti potassio come la penicillina G.
- Ritenzione da parte dei reni: poiché l’escrezione di potassio dipende dall’aldosterone e dalla consegna di una quantità distale sufficiente di sodio e acqua all’interno dei nefroni, condizioni come l’insufficienza renale, l’insufficienza surrenale (morbo di Addison), l’ipoaldosteronismo iporeninemico di tipo IV, l’acidosi tubulare renale, soprattutto nei pazienti con nefropatia diabetica, così come qualsiasi condizione che promuove l’ipoperfusione come nella deplezione di volume e nell’insufficienza cardiaca congestizia, influenzerà l’intricato equilibrio di potassio nel corpo e predisporrà all’iperkaliemia.
- Insufficienza surrenale: questa deve essere esclusa nei pazienti iperkaliemici, in particolare in presenza di iponatriemia e debolezza muscolare. Per lo screening dell’insufficienza surrenalica primaria, viene eseguito un test standard di stimolazione della cosintropina in cui 0,25 mg di cosintropina sintetica vengono somministrati in bolo endovenoso seguito dalla misurazione del cortisolo plasmatico da 45 minuti a 1 ora dopo. Valori inferiori a 20 mcg/dL sono suggestivi di insufficienza surrenalica.
- Farmaci che trattengono il potassio: i farmaci da prescrizione che riducono l’attività dell’ATPasi sodio-potassio come i bloccanti dei recettori beta-adrenergici e i farmaci che riducono la secrezione di aldosterone come gli inibitori ACE e ARB, i farmaci antinfiammatori non steroidei e i diuretici risparmiatori di potassio, necessitano di uno stretto controllo per evitare l’iperkaliemia iatrogena, specialmente nel gruppo di età geriatrica con il loro progressivo declino della funzione renale come parte del processo d’invecchiamento.
- Perturbazioni nello spostamento transcellulare del potassio: questo può verificarsi con condizioni di acidosi, iperglicemia, iperosmolalità, esercizio grave, rottura del tessuto, paralisi periodica iperkalemica, e con bloccanti beta-adrenergici. Per ogni diminuzione di 0,1 unità di PH nel sangue, il potassio sierico aumenta di circa 0,6 mmol/L (meno se l’acidosi è causata da acidi organici).
- Lo pseudo-ipoaldosteronismo è una malattia congenita autosomica recessiva in cui i reni sono resistenti alle azioni dell’aldosterone.
- Anche la pseudo-iperkalemia non deve essere trascurata: come dice il nome, si verifica quando il potassio sierico è elevato in presenza di potassio plasmatico normale. Si può osservare in caso di sangue emolizzato, di laccio emostatico stretto e prolungato durante una procedura di prelievo di sangue, che provoca il rilascio extracellulare di potassio, con la chiusura ripetuta del pugno durante la flebotomia, la venipuntura traumatica, con leucocitosi e trombocitosi, e in alcune sindromi genetiche non comuni come la pseudo-iperkalemia familiare e la sferocitosi ereditaria. Tuttavia, potrebbe essere semplicemente il risultato di un semplice errore di laboratorio.
Effetti dell’iperkaliemia
L’iperkaliemia lieve è spesso asintomatica, rilevata accidentalmente dai test di laboratorio, a causa dei suoi sintomi vaghi come malessere, debolezza muscolare e parestesia. L’iperkaliemia grave colpirà la funzione neuromuscolare sotto forma di debolezza muscolare scheletrica e paralisi; tuttavia, questa non è una presentazione frequente poiché la tossicità cardiaca domina il quadro ed è la presentazione preliminare. La tossicità cardiaca di solito si presenta sull’ECG nel seguente modo scalare, anche se non necessariamente, a seconda dell’eziologia:
- A livelli superiori a 5,5 mEq/L, l’aumento della conduttanza dei canali del potassio aumenta la corrente lkr, portando a una rapida ripolarizzazione sotto forma di un’onda T a picco sull’ECG superficiale. Queste onde T possono essere differenziate da quelle di infarto miocardico e CVA per la loro breve durata che va da 150-250 msec.
- A livelli di potassio superiori a 6,5 mEq/L, si verifica uno stato di depolarizzazione sottosoglia sostenuta, causando un ritardo nella depolarizzazione atriale e ventricolare. La diminuzione della fase 0 del potenziale d’azione porta a un potenziale d’azione più lungo, producendo un ritardo nella conduzione intraventricolare e atrioventricolare. Sull’ECG di superficie, questo si presenterà con un appiattimento e una perdita di onde P e un allargamento dei complessi QRS. Con un ritardo crescente nella conduzione intraventricolare, l’ECG di superficie inizia a mostrare segni di blocco di branca destro e sinistro. Questo può essere differenziato dalla malattia di branca per il fatto che nell’iperkaliemia il ritardo persiste in tutto il complesso QRS, non solo durante le porzioni iniziali o terminali, rispettivamente.
- A 10 mEq/L, la conduzione sinoatriale non si verifica più e subentra il ritmo giunzionale accelerato. Le aritmie ventricolari si sviluppano con la fusione dei complessi QRS allargati con le onde T fino a formare il classico modello a onde sinusoidali. Una volta che questo si verifica, la VF e l’asistolia sono imminenti e l’arresto cardiaco seguirà.
- A volte i cambiamenti possono essere erratici e imprevedibili e l’ECG passerà dal normale all’asistolia a causa della variabilità dei fattori eziologici e dei loro effetti influenti, per esempio, il tasso di variazione del potassio, la concentrazione di calcio, il pH e la concentrazione di sodio. Quindi, l’iperkaliemia dovrebbe essere trattata con urgenza ogni volta che i livelli di potassio diventano maggiori di 6,5 mmol/L, o in presenza di manifestazioni ECG di iperkaliemia indipendentemente dal livello di potassio. Altre associazioni segnalate con l’iperkaliemia acuta includono: immagine di pseudo MI sulla registrazione ECG, con segmento ST-T massiccio come risultato di derangements nella ripolarizzazione dei miociti, intervalli PR e QT brevi, tachicardia sinusale, bradicardia sinusale, ritmo idioventricolare, blocco cardiaco di 1° e 2° grado.
Effetti metabolici
L’iperkaliemia porta all’acidosi metabolica ipercloremica perché l’iperkaliemia promuove l’assorbimento intracellulare di potassio in cambio di ioni idrogeno. Questo crea alcalosi intracellulare, sopprimendo la produzione renale di ammoniaca nei tubuli prossimali, portando ad una diminuzione dell’ammonio urinario e dell’escrezione acida e ad una acidosi tubulare renale di tipo IV.
Pompa sodio-potassio
L’ATPasi sodio-potassio è stata scoperta nel 1957 da Skou, che in seguito ha ricevuto una parte del premio Nobel 1997 per la chimica per la sua scoperta.
Skou fu il primo a scoprire l’ATPasi sodio-potassio nel sarcolemma della superficie cellulare dei muscoli cardiaci. La sua presenza fu poi rilevata in ogni organismo eucariotico mono e pluricellulare.
La pompa sodio potassio funziona collegando l’idrolisi dell’ATP all’esportazione cellulare di tre ioni sodio in cambio di due ioni potassio contro i loro gradienti elettrochimici. È il bersaglio molecolare della digitale e della digossina, che sono in uso dal XVIII secolo come estratti di foxglove.
L’azione della pompa sodio-potassio è regolata da una fosfoproteina fosfolemma, la cui non fosforilazione porta all’inibizione della pompa e la cui fosforilazione porta ad un aumento dell’attività della pompa. Possiede tre siti di fosforilazione, due siti di palmitoilazione e un sito di glutatione, il che spiega la moltitudine di segnali capaci di stimolare e inibire la pompa.
La stessa pompa sodio-potassio è un enzima composto da più subunità con più isoforme. La presenza delle subunità alfa e beta (principalmente B1 nel cuore) è essenziale per la sua funzione. Recentemente, una terza subunità proteica gamma è stata identificata nei reni, ma fino ad oggi la sua funzione rimane sconosciuta.
La subunità alfa è il nucleo catalitico dell’enzima della pompa del potassio di sodio. È di circa 100 kDa e contiene i siti di legame per il sodio, il potassio, l’ATP e gli steroidi cardiotonici come l’ouabain. Solo alfa 1 e alfa 2 mostrano una presenza significativa in un miocita cardiaco normale e sono collegati funzionalmente allo scambiatore sodio-calcio (NCX). Alpha 3 è stato segnalato per sostituire alpha 2 in modelli sperimentali di insufficienza cardiaca.
Dati da esperimenti recenti favoriscono il coinvolgimento di entrambe le subunità alpha 1 alpha 2 della pompa nella regolazione dell’accoppiamento eccitazione-contrazione (E-C). L’alfa 1, che è stato trovato per essere più uniformemente distribuito in tutto il sarcolemma, si pensa di giocare più di un ruolo “housekeeping”, controllando sia la contrattilità e la massa di sodio intracellulare, mentre l’alfa 2 la cui espressione è concentrata nel T-tubuli insieme ad altri componenti chiave dell’accoppiamento E-C si pensa di concentrarsi principalmente sulla contrattilità
I fattori noti che possono controllare la pompa sodio-potassio includono: ATP, sodio intracellulare, barriere sub-sarcolemmali e spazi sfumati, potenziale di membrana, vie di segnalazione intracellulari (vie di segnalazione adrenergiche, protein chinasi A & C, ossido nitrico, fosfolemma), regolazione diretta da piccole molecole (lipidi, steroidi cardiotonici endogeni), altre proteine associate (caveolae e caveoline, e anchirina).
Conclusione
L’iperkaliemia è una sfida clinica e può presentarsi fino al 10% dei pazienti ospedalizzati. Il suo risultato finale è pericoloso per la vita. Dato che tutte le cellule del corpo sono in ultima analisi influenzate dalla pompa sodio-potassio, e i muscoli cardiaci ischemici sono noti per estrudere il loro potassio extracellulare portando ad una riduzione della soglia di aritmia con la possibilità di aritmie ventricolari che aggravano l’ipopolarizzazione e abbassano la soglia ancora di più, più studi devono essere focalizzati sulla manipolazione dell’enzima sodio-potassio, come il suo controllo potrebbe modificare favorevolmente gli esiti degli arresti cardiaci e riscrivere le attuali linee guida CPR.