J Cancer 2020; 11(6):1341-1350. doi:10.7150/jca.40817
Research Paper
Amy C. Moreno1, Yan Heather Lin2, Isabelle Bedrosian3, Yu Shen2, Gildy V. Babiera3, Simona F. Shaitelman1 ![]()
1. Department of Radiation Oncology, The University of Texas MD Anderson Cancer Center, Houston, TX.
2. Department of Biostatistics, The University of Texas MD Anderson Cancer Center, Houston, TX.
3. Department of Surgical Oncology, The University of Texas MD Anderson Cancer Center, Houston, TX.
Moreno AC, Lin YH, Bedrosian I, Shen Y, Babiera GV, Shaitelman SF. Esiti dopo il trattamento di Metaplastic Versus altri sottotipi di cancro al seno. J Cancer 2020; 11(6):1341-1350. doi:10.7150/jca.40817. Disponibile da https://www.jcancer.org/v11p1341.htm
Scopo: Il cancro al seno metaplastico (BC) è un sottotipo istologico non comune ma aggressivo di BC. Abbiamo cercato di identificare i fattori associati con la sua diagnosi e confrontare la gestione e gli esiti del BC metaplastico con quelli di altri BC e carcinoma duttale invasivo triplo negativo in particolare dato quanto spesso ha un fenotipo triplo negativo.
Pazienti e metodi: Abbiamo identificato le donne con diagnosi di BC invasivo nel 2010-2014 nel National Cancer Data Base, e utilizzato l’analisi univariata per confrontare le caratteristiche di base del paziente e del tumore per sottotipo BC. Sopravvivenza globale (OS) è stato stimato con il metodo Kaplan-Meier, e modelli multivariati Cox proporzionale hazards sono stati utilizzati per identificare i predittori indipendenti di OS.
Risultati: Di 247.355 casi, 2.084 (0,8%) erano BC metaplastico, 55.998 (23%) BC triplo negativo, e 77% altri BC. Rispetto al BC non metaplastico, le donne con BC metaplastico avevano più probabilità di essere più anziani alla diagnosi (età mediana, 62 vs. 59 anni), hanno ≥ 1 condizioni comorbide (22% vs. 18%), ed essere su Medicare (41% vs. 33%; P<0.001). I BC metaplastici tendevano ad essere basali (77%), e rispetto ai BC triplo-negativi o di altro tipo, il BC metaplastico era associato ad un più alto stato clinico T (cT3-4, 18% vs. 11%, 8%), nessun coinvolgimento linfonodale clinico (cN0, 86%, 77%, 80%), nessuna invasione linfovascolare (72%, 65%, 62%), e tumori di alto grado (71%, 77%, 35%) (P<0.001). La maggior parte dei BC metaplastici sono stati trattati con mastectomia (58%), dissezione del linfonodo sentinella (65%), irradiazione della parete toracica o del seno (74%), e chemioterapia (75%) come terapia adiuvante (60%). Ad un tempo mediano di follow-up di 44,5 mesi, i tassi di OS erano più bassi per il BC metaplastico che per il triplo-negativo o altri BC in tutti gli stadi clinici a 5 anni (stadio I, 85%, 87%, 91%; II, 73%, 77%, 87%; III, 43%, 53%, 75%) e a 3 anni (stadio IV, 15%, 22%, 64%; P<0,001). Nell’analisi multivariata, l’aumento dell’età, lo stadio clinico avanzato, l’invasione linfovascolare, la dissezione dei linfonodi ascellari (vs. sentinella), e nessuna radiazione o chemioterapia sono stati associati a risultati peggiori nel BC metaplastico. L’estensione della chirurgia ha influenzato la sopravvivenza per il triplo-negativo e altri BC ma non per il BC metaplastico.
Conclusione: I risultati per il BC metaplastico continuano ad essere peggiori di quelli per altri sottotipi di BC nonostante i trattamenti moderni. Ottimizzare le opzioni di terapia sistemica, che era un predittore significativo della sopravvivenza, dovrebbe essere una priorità nella gestione del BC metaplastico.
Parole chiave: cancro al seno metaplastico, cancro al seno triplo negativo, esiti del cancro al seno, radioterapia, chemioterapia.
Introduzione
Anche se il cancro al seno è la diagnosi di cancro più comune che colpisce le donne, con più di 268.000 casi documentati ogni anno, il cancro al seno metaplastico (BC) costituisce meno dell’1%-2% di tutti i casi di cancro al seno. Clinicamente, il BC metaplastico si manifesta come una massa mammaria in rapida crescita con ecogenicità complessa (cioè, componenti solidi e cistici) sull’ecografia e una massa ad alta densità sulla mammografia. Istologicamente, il BC metaplastico è composto da una popolazione eterogenea di tumori che possono essere classificati dalla presenza di tipi di cellule non ghiandolari o mesenchimali o da un’ulteriore categorizzazione in sottotipi a seconda della presenza di varie caratteristiche come le cellule giganti osteoclastiche o cellule a fuso.
Alla presentazione, il tasso di coinvolgimento linfonodale clinico nel BC metaplastico è tipicamente basso. Tuttavia, il BC metaplastico è più spesso diagnosticato in fasi cliniche avanzate a causa di tumori primari più grandi rispetto ad altri BC ed è associato a tassi più elevati di chemioresistenza, metastasi a distanza e peggiore sopravvivenza globale (OS). BC metaplastica ha una prevalenza particolarmente elevata di stato recettore triplo-negativo o l’assenza di recettore degli estrogeni, recettore del progesterone e amplificazione del recettore del fattore di crescita epidermico umano 2 (HER2). Senza proteine bersaglio, BC metaplastica rimane difficile da trattare. I dati prospettici sono limitati per scegliere il miglior trattamento per il BC metaplastico data la rarità della diagnosi. Invece, gran parte dell’attuale standard di cura per il BC metaplastico è stato estrapolato dai risultati di piccole serie di singole istituzioni o rapporti di casi. Abbiamo quindi utilizzato il National Cancer Data Base (NCDB), che cattura circa il 70% di tutti i casi di cancro diagnosticati negli Stati Uniti, per valutare le caratteristiche, la gestione e gli esiti basati sul trattamento e le caratteristiche del tumore dei pazienti con metaplastica BC rispetto a quelli con triple-negative BC e tutti gli altri sottotipi BC. Abbiamo anche usato l’analisi multivariata per identificare i predittori indipendenti di sopravvivenza per le donne con metaplastica BC.
Fonte dei dati e selezione della coorte
Un progetto congiunto istituito nel 1989 dalla Commissione sul cancro del Collegio americano dei chirurghi e la società americana del cancro, il NCDB ha raccolto dati oncologici da circa 1.500 strutture accreditate negli Stati Uniti, per un totale di oltre 34 milioni di record. Le informazioni disponibili sui pazienti sono de-identificate e quindi esenti dalla supervisione della protezione umana da parte del comitato di revisione istituzionale.
I criteri di selezione utilizzati per questo studio sono delineati nella Figura 1. Sono state incluse le donne dai 18 anni in su a cui è stato diagnosticato un cancro invasivo al seno dal 2010 al 2014. Sono state escluse le pazienti con stato sconosciuto del recettore ormonale (estrogeno e progesterone). Ulteriori motivi di esclusione sono state le informazioni mancanti riguardanti la chirurgia, la chemioterapia o la stadiazione clinica secondo l’American Joint Committee On Cancer (AJCC) 6° o 7° edizione. I pazienti sono stati poi stratificati in tre gruppi: 1-metaplastico BC (con i codici istologici 8575 o 8573), 2- triplo-negativo BC (TNBC, che includeva solo istologie non metaplastiche), e 3- tutti gli altri tipi di BC. Il termine “non-metaplastico BC” è stato utilizzato per riferirsi a triple-negative BC e altri BC combinato.
Diagramma di CONSORT. BC, cancro al seno.
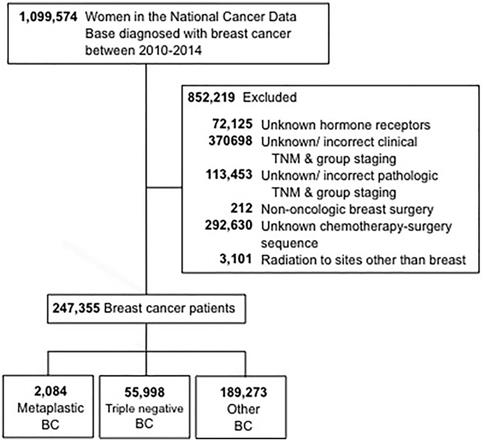 (Clicca sull’immagine per ingrandirla.)
(Clicca sull’immagine per ingrandirla.)
Variabili
Le informazioni ottenute e analizzate dal NCDB includevano l’età del paziente alla diagnosi, l’anno della diagnosi, la razza, l’indice di comorbidità Charlson/Deyo, lo stato di assicurazione medica, il reddito familiare mediano e il tipo di struttura di trattamento (dicotomizzato in accademico/di ricerca contro non accademico). Le caratteristiche clinicopatologiche includevano la designazione clinica AJCC T e N (nodale), il gruppo di stadio clinico AJCC complessivo, lo stato HR, lo stato del recettore HER2, il grado del tumore e l’invasione linfovascolare (LVSI). I sottotipi molecolari sono stati definiti come HR(+)/HER2(-), HER2(+), triplo-negativo (recettore degli estrogeni(-), recettore del progesterone (-), HER2(-)), o sconosciuto. I pazienti con BC metaplastico con stato del recettore triplo-negativo sono stati etichettati come tn-metaplastico BC per distinguerli dal TNBC non metaplastico. La gestione primaria includeva la chirurgia (sia la conservazione del seno, la mastectomia, o nessuna), la radioterapia con o senza l’inclusione di irradiazione linfonodale regionale, l’uso della chemioterapia (neoadiuvante, adiuvante, o nessuna), e la terapia ormonale. La gestione chirurgica dell’ascella è stata definita come una dissezione linfonodale ascellare (ALND), con 10 o più linfonodi rimossi, o una dissezione linfonodale sentinella (SLND), quando <10 linfonodi sono stati rimossi.
Analisi statistica
L’analisi univariata è stata utilizzata per valutare le potenziali associazioni tra caratteristiche demografiche, tumorali e cliniche e una diagnosi di BC metaplastico, utilizzando test chi-quadro per le variabili categoriche e test t/analisi della varianza o le loro controparti degli approcci non parametrici (Wilcoxon rank-sum o Kruskal-Wallis) per variabili continue. L’OS è stata definita come dal momento della diagnosi al momento della morte. Il tempo di OS per i pazienti sopravvissuti è stato censito a destra al momento dell’ultimo contatto. La distribuzione della OS è stata stimata con il metodo Kaplan-Meier. Il test log-rank è stato utilizzato per testare la differenza di sopravvivenza tra i gruppi. Le analisi di regressione dei dati di sopravvivenza basate sul modello di Cox proportional hazards sono state condotte sulla OS. Un modello di Cox proporzionale di rischio multivariato è stato ottenuto includendo prima un set iniziale di variabili predittive candidate con un valore P < 0,05 nell’analisi univariata. L’eliminazione a ritroso graduale è stata poi utilizzata, con 0,05 per il livello di significatività del chi-quadro di Wald per un effetto per rimanere nel modello.
Le analisi di sopravvivenza sono state condotte all’interno di ciascuno dei tipi di cancro separatamente.
L’ubicazione e il tipo di struttura non sono stati inclusi nel processo di selezione del modello BC metaplastico perché nessuno dei due fattori era statisticamente significativo per questo gruppo nell’impostazione univariata e i dati non erano completamente disponibili per i pazienti più giovani di 40 anni. Per esplorare se i dettagli della terapia sistemica e la consegna delle radiazioni hanno influenzato i risultati tra i pazienti con BC metaplastico, abbiamo eseguito analisi di sottoinsieme su questa coorte per valutare la potenziale influenza della sequenza di chemioterapia e l’estensione degli obiettivi di radiazione sulla OS. Tutti i test erano a due code e la significatività statistica è stata definita come un valore P <0,05. Sono state utilizzate la versione 9.4 di SAS (SAS Institute, Cary, NC) e la versione 8.2 di S-Plus (TIBCO Software Inc, Palo Alto, CA) sono stati utilizzati per effettuare i calcoli per tutte le analisi.
Caratteristiche della coorte e del tumore
Abbiamo identificato 247.355 donne con una diagnosi di cancro al seno invasivo nel 2010-2014, di cui 0,8% (n=2.084) aveva BC metaplastico, 23% (n=55.998) TNBC, e 77% (n=189.273) aveva altro BC. Le caratteristiche sociodemografiche, cliniche e patologiche del tumore dei pazienti e le caratteristiche del trattamento per tipo di BC sono mostrate nella tabella 1. L’età mediana era 63 anni (range 22-90) per le donne con BC metaplastica e 59 anni (range 18-90) anni per entrambi TNBC e altri BC. Le donne con metaplastica BC più comunemente avevano un punteggio di comorbidità di ≥ 1 (22% vs 18% TNBC vs 16% altri BC) e aveva assicurazione pubblica (50% vs 42% TNBC vs 41% altri BC) (tutti P<0.001). La diagnosi di BC metaplastico o TNBC era più comunemente associata alla razza nera rispetto ad altri BC (18% vs. 21% vs. 11%, P<0.001).
Significative differenze nello stadio clinico della malattia e nelle caratteristiche del tumore sono state viste dal tipo di cancro. Il BC metaplastico è stato spesso diagnosticato a stadi più avanzati, con solo il 31% dei pazienti con BC metaplastico che hanno la malattia allo stadio clinico I contro il 46% del TNBC e il 54% di altri BC (P<0.001). Questo modello sembrava correlare con tassi più elevati di tumori più grandi nel gruppo BC metaplastica (cT3-4, 18% vs. 11% vs. 8%, rispettivamente), ma la presenza di coinvolgimento linfonodale clinico era il più basso per BC metaplastica (cN1-3, 14% vs. 23% vs. 20%, rispettivamente) (tutti P<0,001). In contrasto con lo stato nodale clinico, i tassi di coinvolgimento nodale patologico era leggermente inferiore per BC metaplastica e TNBC ma raddoppiato per altri BC (pN1-3, 18% vs. 26% vs. 40%, rispettivamente, P<0.001). Per quanto riguarda lo stato del recettore, il 77% del gruppo metaplastico BC aveva tn-metaplastico BC, che è 3,4 volte superiore al gruppo non-metaplastico BC (23%), di cui HR (+) /HER2 (-) era il sottotipo molecolare più comune al 59% (P<0,001). Inoltre, solo il 5% del BC metaplastico era HER2(+) rispetto al 16% del BC non metaplastico. Sia il BC metaplastico che il TNBC avevano quasi il doppio della proporzione di tumori di grado 3 rispetto all’altro BC (71%, 77% e 35%, rispettivamente, P<0.001), e il BC metaplastico aveva tassi più bassi di LVSI rispetto al TNBC e all’altro BC (13%, 20% e 24%, rispettivamente, P<0.001).
caratteristiche del paziente e del trattamento.
| Caratteristiche | BC metaplastico, No. (%) | BC triplo-negativo, No. (%) | Altro BC, No. (%) | P Value |
|---|---|---|---|---|
| Età media, anni (range) | 62 (22-90) | 59 (18-90) | 59 (18-90) | <0.001 |
| Race | ||||
| Bianco | 1623 (77.9) | 41791 (74.6) | 158406 (83.7) | <0.001 |
| Nero | 368 (17.7) | 11771 (21) | 20722 (10.9) | |
| Altro | 80 (3.8) | 2041 (3.6) | 8507 (4.5) | |
| Sconosciuto | 13 (0.6) | 395 (0.7) | 1638 (0.9) | |
| Punteggio di comorbilità | ||||
| 0 | 1635 (78.5) | 45882 (81.9) | 158177 (83.6) | <0.001 |
| 1 | 349 (16.7) | 8107 (14.5) | 25524 (13.5) | |
| >=2 | 100 (4.8) | 2009 (3.6) | 5572 (2.9) | |
| Reddito medio | ||||
| <$30,000 | 251 (12) | 7110 (12.7) | 19154 (10.) | <0.001 |
| $30,000-$34,999 | 332 (15.9) | 9081 (16.2) | 28472 (15) | |
| $35,000-$45,999 | 580 (27.8) | 15084 (26.9) | 48845 (25.8) | |
| $46,000+ | 858 (41.2) | 23050 (41.2) | 86637 (45.8) | |
| Sconosciuto | 63 (3) | 1673 (3) | 6165 (3.3) | |
| Assicurazione medica | ||||
| privato | 975 (46.8) | 30263 (54) | 105839 (55.9) | <0.001 |
| Medicaid | 154 (7.4) | 4716 (8.4) | 13267 (7) | |
| Medicare | 862 (41.4) | 18355 (32.8) | 61535 (32.5) | |
| Altro | 19 (0.9) | 665 (1.2) | 2212 (1.2) | |
| Non assicurato | 43 (2.1) | 1422 (2.5) | 4163 (2.2) | |
| Non conosciuto | 31 (1.5) | 577 (1) | 2257 (1.2) | |
| Tipo di contea | ||||
| Metropolitana | 1720 (82.5) | 46252 (82.6) | 157058 (83) | 0.152 |
| Urbano | 271 (13) | 7456 (13.3) | 24367 (12.9) | |
| Rurale | 43 (2.1) | 951 (1.7) | 3219 (1.7) | |
| Sconosciuto | 50 (2.4) | 1339 (2.4) | 4629 (2.4) | |
| Tipo di struttura | ||||
| accademico | 668 (32.1) | 16117 (28.8) | 52120 (27.5) | <0.001 |
| Non-Accademico | 1318 (63.2) | 35472 (63.3) | 126101 (66.6) | |
| Sconosciuto | 98 (4.7) | 4409 (7.9) | 11052 (5.8) | |
| Sede della struttura | ||||
| Midwest | 614 (29.5) | 14132 (25.2) | 46644 (24.6) | <0.001 |
| Nord-est | 410 (19.7) | 10411 (18.6) | 37787 (20) | |
| Sud | 716 (34.4) | 20595 (36.8) | 66519 (35.1) | |
| Ovest | 246 (11.8) | 6451 (11.5) | 27271 (14.4) | |
| Sconosciuto | 98 (4.7) | 4409 (7.9) | 11052 (5.8) | |
| Fase clinica della malattia | ||||
| I | 639 (30.7) | 25843 (46.1) | 102257 (54) | <0.001 |
| II | 1215 (58.3) | 23912 (42.7) | 70846 (37.4) | |
| III | 201 (9.6) | 5579 (10) | 14283 (7.5) | |
| IV | 29 (1.4) | 664 (1.2) | 1887 (1) | |
| Stato T clinico | ||||
| cT0 | 5 (0.2) | 131 (0.2) | 341 (0.2) | <0.001 |
| cT1 | 674 (32.3) | 28452 (50.8) | 113113 (59.8) | |
| cT2 | 1026 (49.2) | 21530 (38.4) | 61145 (32.3) | |
| cT3 | 252 (12.1) | 3702 (6.6) | 10061 (5.3) | |
| cT4 | 127 (6.1) | 2183 (3.9) | 4613 (2.4) | |
| Stato N clinico | ||||
| cN0 | 1787 (85.7) | 43357 (77.4) | 150890 (79.7) | <0.001 |
| cN1 | 224 (10.7) | 9659 (17.2) | 30427 (16.1) | |
| cN2 | 51 (2.4) | 1804 (3.2) | 5414 (2.9) | |
| cN3 | 22 (1.1) | 1178 (2.1) | 2542 (1.3) | |
| Stadio patologico | ||||
| 0 | 45 (2.2) | 4314 (7.7) | 5361 (2.8) | <0.001 |
| 1 | 582 (27.9) | 24787 (44.3) | 81680 (43.2) | |
| 2 | 1223 (58.7) | 20790 (37.1) | 72445 (38.3) | |
| 3 | 210 (10.1) | 5675( 10.1) | 28323 (15) | |
| 4 | 24 (1.2) | 432 (0.8) | 1464 (0.8) | |
| Stato T patologico | ||||
| pTis | 7 (0.3) | 432 (0.8) | 1862 (1) | <0.001 |
| pT0 | 42 (2) | 4250 (7.6) | 3972 (2.1) | |
| pT1 | 634 (30.4) | 29055 (51.9) | 106130 (56.1) | |
| pT2 | 1017 (48.8) | 18530 (33.1) | 63484 (33.5) | |
| pT3 | 290 (13.9) | 2540 (4.5) | 10588 (5.6) | |
| pT4 | 93 (4.5) | 1097 (2) | 2892 (1.5) | |
| pTX | 1 (0) | 94 (0.2) | 345 (0.2) | |
| Stato N patologico | ||||
| pN0 | 1705 (81.9) | 41587 (74.3) | 113787 (60.2) | <0.001 |
| pN1 | 284 (13.6) | 9725 (17.4) | 51483 (27.2) | |
| pN2 | 66 (3.2) | 3031 (5.4) | 16111 (8.5) | |
| pN3 | 27 (1.3) | 1607 (2.9) | 7685 (4.1) | |
| Gruppo di recettori | ||||
| HR(+)/HER2(-) | 334 (16) | 0 (0) | 143687 (75.9) | <0.001 |
| Triplo negativo | 1604 (77) | 55998 (100) | 0 (0) | |
| HER2(+) | 97 (4.7) | 0 (0) | 38726 (20.5) | |
| Sconosciuto | 49 (2.4) | 0 (0) | 6860 (3.6) | |
| Grado del tumore | ||||
| 1 | 41 (2) | 988 (1.8) | 32015 (16.9) | <0.001 |
| 2 | 237 (11.4) | 9050 (16.2) | 80590 (42.6) | |
| 3 | 1485 (71.3) | 42930 (76.7) | 65482 (34.6) | |
| 4 | 37 (1.8) | 286 (0.5) | 438 (0.2) | |
| Sconosciuto | 284 (13.6) | 3030 (5.4) | 11186 (5.9) | |
| LVSI | ||||
| Non presente | 1505 (72.2) | 36400 (65) | 118082 (62.4) | <0.001 |
| presente | 263 (12.6) | 11091 (19.8) | 45681 (24.1) | |
| Sconosciuto | 316 (15.2) | 8507 (15.1) | 25510 (13.4) | |
| Tipo di chirurgia | ||||
| BCS | 876 (42) | 29142 (52) | 92022 (48.6) | <0.001 |
| Mastectomia | 1200 (57.6) | 26561 (47.4) | 95910 (50.7) | |
| Nessun intervento | 8 (0.4) | 295 (0.5) | 1341 (0.7) | |
| Chirurgia ascellare | ||||
| Nessun intervento | 47 (2.3) | 1034 (1.8) | 4433 (2.3) | <.001 |
| SLND | 1353 (64.9) | 34880 (62.3) | 109718 (58) | |
| ALND | 666 (32) | 19229 (34.3) | 73181 (38.7) | |
| sconosciuto | 18 (0.9) | 855 (1.5) | 1941 (1) | |
| Radioterapia | ||||
| Sì | 1087 (52.2) | 33938 (60.6) | 109268 (57.7) | <.001 |
| No | 989 (47.5) | 21860 (39) | 79375 (41.9) | |
| Sconosciuto | 8 (0,4) | 200 (0,4) | 630 (0.3) | |
| Obiettivi di radiazione | ||||
| Seno/CW solo | 803 (73.9) | 24704 (72.8) | 72410 (66.3) | <0.001 |
| Seno/CW + Nodi regionali | 284 (26.1) | 9234 (27.2) | 36858 (33.7) | |
| Chemioterapia | ||||
| Sì | 1571 (75.4) | 44321 (79.1) | 133965 (70.8) | <0.001 |
| No | 499 (23.9) | 11195 (20) | 53062 (28) | |
| Sconosciuto | 14 (0.7) | 482 (0.9) | 2246 (1.2) | |
| Sequenza chemioterapia-intervento | ||||
| adiuvante | 1241 (59,5) | 31519 (56.3) | 116645 (61.6) | <0.001 |
| Neoadjuvant | 324 (15.5) | 12581 (22.5) | 16717 (8.8) | |
| Nessuno | 519 (24.9) | 11898 (21.2) | 55911 (29.5) | |
| Terapia ormonale | ||||
| Sì | 220 (10.6) | 1178 (2.1) | 103906 (54.9) | <0.001 |
| No | 1798 (86.3) | 53274 (95.1) | 76820 (40.6) | |
| Sconosciuto | 66 (3.2) | 1546 (2.8) | 8547 (4.5) | |
| Anno di diagnosi | ||||
| 2010 | 309 (14.8) | 9605 (17.2) | 36712 (19.4) | <0.001 |
| 2011 | 393 (18.9) | 11163 (19.9) | 38815 (20.5) | |
| 2012 | 458 (22) | 11205 (20) | 39364 (20.8) | |
| 2013 | 463 (22.2) | 11992 (21.4) | 37764 (20) | |
| 2014 | 461 (22.1) | 12033 (21.5) | 36618 (19,3) |
Abbreviazioni: BC, cancro al seno; ALND, dissezione linfonodale ascellare; BCS, chirurgia conservativa del seno; CW, parete toracica; HER2, recettore del fattore di crescita epidermico umano; HR, recettore ormonale; LVSI, invasione linfovascolare; SLND, dissezione linfonodale sentinella.
Trattamento per tipo di cancro al seno
La maggior parte delle pazienti (99%) è stata sottoposta a chirurgia oncologica del seno, compresa la valutazione chirurgica dell’ascella (97%). La mastectomia è stata più comunemente usata nel gruppo BC metaplastico (58% vs. 47% TNBC vs. 51% altri BC, P<0.001), così come la SLND (65% vs. 62% TNBC vs. 58% altri BC; P<0.001). L’irradiazione linfonodale regionale è stata usata più spesso come parte del trattamento per l’altro BC che per BC metaplastico e TNBC (26%, 27% e 34%; P<0.001), rispettivamente.
Per quanto riguarda la terapia sistemica, la chemioterapia neoadiuvante è stata usata quasi due volte più spesso per BC metaplastico e TNBC che per altri BC (16%, 23%, 9%; P<0.001), e circa un quarto di tutte le donne non ha ricevuto alcuna chemioterapia. La terapia ormonale è stata usata meno spesso per il TNBC (2%), ma faceva parte del paradigma di trattamento per l’11% del BC metaplastico e il 55% degli altri casi di BC.
Analisi della sopravvivenza
Il tempo mediano di follow-up era di 44,5 mesi. I pazienti con BC metaplastico hanno avuto significativamente peggiore OS non aggiustata, indipendentemente dallo stadio clinico (Fig. 2). Le stime di OS a 5 anni per il BC metaplastico, TNBC e altri pazienti BC con malattia di stadio I erano 85%, 87% e 91%; quelli per lo stadio II erano 73%, 77% e 87%, e quelli per lo stadio III erano 43%, 53% e 75% (P<0,001). I tassi di OS a 3 anni per i pazienti con malattia metastatica erano 2-4 volte più alti per il TNBC e altri gruppi BC al 30% e 64% rispetto al 15% per BC metaplastica (P<0.001). La sopravvivenza per sottotipo molecolare è stata anche analizzata (Fig. 3). Tra i pazienti con BC metaplastico, nessuna differenza di OS era evidente per sottotipo molecolare (HR(+)/HER2(-), HER2(+), o tn-metaplastico BC) (P=0.778). Al contrario, per il BC non metaplastico, il sottotipo triplo-negativo è stato associato a una peggiore OS rispetto ai sottotipi HER+ e HR(+)/HER2(-) (P<0.001). Anche la razza non sembra essere associata alla sopravvivenza tra i pazienti con BC metaplastico (tassi di OS a 5 anni 73% per i bianchi contro il 74% per i neri, P=0,876), mentre la razza è stata associata alla OS sia nel TNBC (P<0,001) che negli altri gruppi BC (P<0,001; Fig. 4).
Curve di sopravvivenza complessiva dei tipi di cancro al seno per stadio clinico, esaminando i tumori metaplastici, triplo negativi e altri tumori del seno. Abbreviazione: MBC, tumore al seno metaplastico.
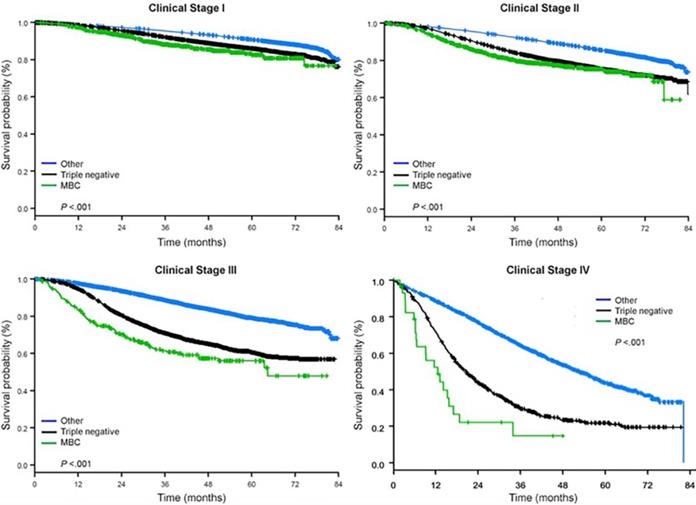 (Clicca sull’immagine per ingrandirla.)
(Clicca sull’immagine per ingrandirla.)
Curve di sopravvivenza globale per pazienti con tumore al seno metaplastico e non metaplastico stratificato per stato del recettore. Abbreviazioni: HER2, recettore 2 del fattore di crescita epidermico umano; HR, recettore ormonale; MBC, cancro al seno metaplastico.
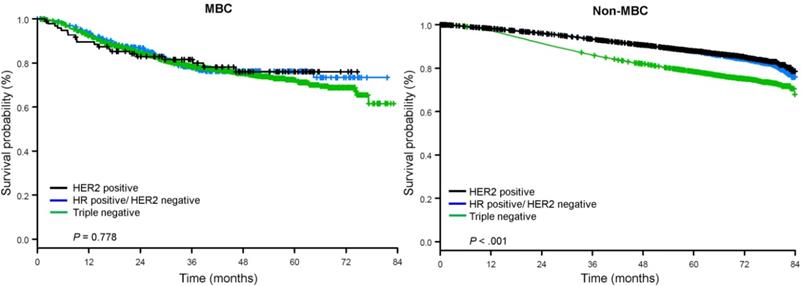 (Clicca sull’immagine per ingrandirla.)
(Clicca sull’immagine per ingrandirla.)
Curve di sopravvivenza totale per pazienti con cancro al seno metaplastico, triplo negativo e di altro tipo stratificato per razza. Abbreviazioni: BC, cancro al seno.
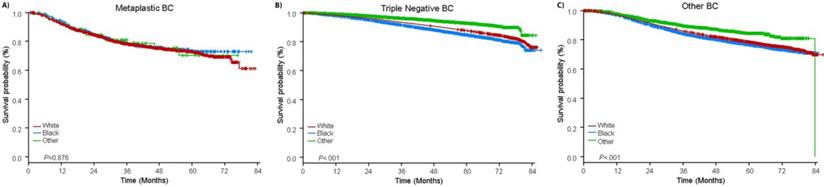 (Clicca sull’immagine per ingrandirla.)
(Clicca sull’immagine per ingrandirla.)
Analisi multivariabile dei fattori associati alla sopravvivenza globale per i pazienti con BC metaplastico.
| Fattori associati alla sopravvivenza globale nel BC metaplastico | |||
|---|---|---|---|
| Variabile (riferimento) | Rapporto di rischio (intervallo di confidenza al 95%) | Valore P | |
| Età | Aumento annuale | 1.024 (1.015-1.033) | <0.0001 |
| Invasione linfovascolare (nessuna) | Presente | 1.307 (1.017-1.679) | 0.0364 |
| Stato N clinico (cN0) | cN+ | 1,758 (1,328-2,326) | <0.0001 |
| Stato T clinico (cT1) | cT0 | 2.226 (0.301-16.447) | <0.0001 |
| cT2 | 1.454 (1.102-1.918) | ||
| cT3 | 3.029 (2.183-4.204) | ||
| cT4 | 3.145 (2.124-4.657) | ||
| Stato M clinico (cM0) | cM1 | 3.330 (2.020-5.488) | <0.0001 |
| Chirurgia ascellare (SLND) | ALND | 1.333 (1.065-1.670) | 0.0247 |
| No Surgery | 1.538 (0.884-2.675) | ||
| Radiazioni (No) | Sì | 0.709 (0.572-0.878) | 0.0016 |
| Chemotherapy (No) | Yes | 0.579 (0.446-0.752) | <0.0001 |
Abbreviazioni: ALND, dissezione linfonodale ascellare; BC, cancro al seno; SLND, dissezione del linfonodo sentinella.
Nell’analisi multivariata, l’età crescente, la classificazione T clinica più alta, la presenza di malattia linfonodale clinica o LVSI, e il trattamento con ALND erano tutti correlati a risultati peggiori per i pazienti con BC metaplastico, TNBC, e altri BC (Tabella supplementare 1). L’aggiunta della chemioterapia e della radioterapia ha migliorato indipendentemente l’OS indipendentemente dal tipo di cancro al seno. Altre caratteristiche del paziente e del tumore associate con la sopravvivenza in TNBC e altri BC, tra cui la razza, comorbidità e grado del tumore, non sono stati associati con i risultati di sopravvivenza per BC metaplastica su analisi multivariata.
Dato i risultati relativamente poveri tra i pazienti con BC metaplastica, analisi di sottogruppo sono state fatte sul gruppo BC metaplastica per valutare se qualsiasi modalità di trattamento sono stati associati con risultati migliori. Dopo aver aggiustato per lo stato linfonodale (cN0 vs. N+), il trattamento con chirurgia ascellare più aggressiva (ALND vs. SLND è stato associato con risultati peggiori, un fenomeno che è stato visto anche tra TNBC e altri BC (Tabella 2). Tra coloro che hanno ricevuto la radioterapia, il trattamento con irradiazione linfonodale regionale rispetto alla sola radiazione al seno o alla parete toracica non ha influenzato significativamente gli esiti tra i pazienti con BC metaplastico (P=0.077 e 0.200 per N0 clinico e N+, rispettivamente). La ricezione della chemioterapia neoadiuvante è stata associata a risultati peggiori rispetto alla chemioterapia adiuvante tra i pazienti con BC metaplastico clinicamente nodoso (HR 1.9, 95% CI 1.3-2.6, P<0.001), ma non per quelle con BC metaplastico clinicamente nodoso (P=0,43).
Discussione
Il carcinoma mammario metaplastico è una forma rara ma particolarmente aggressiva di carcinoma mammario, soprattutto se confrontato con altri sottotipi di tumore al seno. Questa entità di malattia è stata relativamente sottorappresentata nella letteratura. Un’ampia ricerca di Rayson et al. sulle pubblicazioni dal 1966 al 1997 ha prodotto un totale di soli 27 casi. I grandi database nazionali come il NCDB sono vantaggiosi per studiare i tumori rari come il BC metaplastico. Tuttavia, l’incidenza della diagnosi di BC metaplastico negli Stati Uniti secondo questi database è ancora bassa a meno di 500 casi all’anno. Nel nostro studio, abbiamo trovato che BC metaplastico è stato più comunemente diagnosticato come un grande tumore con caratteristiche di rischio avverse come il grado di tumore scarsamente differenziato e lo stato del recettore triplo-negativo. I pazienti con BC metaplastico avevano una sopravvivenza significativamente peggiore indipendentemente dallo stadio alla presentazione rispetto al triplo-negativo e altri BC. Ricezione di chemioterapia e radioterapia erano predittori indipendenti di una migliore OS, ma la sequenza della chemioterapia sembrava influenzare i risultati, in particolare per i pazienti con BC metaplastico senza coinvolgimento linfonodale clinico, riconoscendo che alcuni di questi pazienti avevano coinvolgimento linfonodale patologico. Tuttavia, i nostri risultati possono riflettere la potenziale eterogeneità nei meccanismi biologici sottostanti che guidano le risposte ai trattamenti in questo particolare gruppo di pazienti BC e sottolineare la necessità di una migliore stratificazione del rischio e opzioni di terapia sistemica per migliorare i risultati.
Anche se la maggior parte metaplastica BC hanno un fenotipo triplo negativo, il comportamento di metaplastica BC sembra essere unico rispetto ad altri TNBCs. TNBC tende ad avere una prognosi peggiore rispetto ad altri tipi di BC, e la nozione che BC metaplastica è più aggressiva di TNBC è stata confermata da più piccole, indagini retrospettive. Tali studi hanno mostrato modelli simili di diagnosi a stadi avanzati per BC metaplastica rispetto a TNBC, a causa di tassi più elevati di malattia cT3-4 piuttosto che coinvolgimento linfonodale, e in una revisione singola istituzione di 46 casi di BC metaplastica, pazienti con BC metaplastica avevano un rischio significativamente più elevato di recidiva di malattia locale (30% vs 15%; P=0.004). Queste caratteristiche, infine, sono state correlate con tassi inferiori di sopravvivenza libera da malattia a 5 anni (30% vs. 90%; P<0.001) e tassi di OS (65% vs. 87%; P=0.002) per i pazienti con BC metaplastico rispetto al TNBC. Uno studio Surveillance Epidemiology and End Results di 1.1112 pazienti con BC metaplastico ha anche mostrato tassi di sopravvivenza cancro-specifici peggiori a 3 anni per il BC metaplastico rispetto al TNBC (78% vs. 84%). Quando si esamina il BC tn-metaplastico, Li et al. hanno trovato una peggiore sopravvivenza libera da malattia (HR 1.48, 95% CI 1.19-1.84, P<0.01) e OS (HR 1.42 ; P<.01) per BC tn-metaplastico rispetto al TNBC. Il nostro studio, che ha incluso uno dei più grandi gruppi di pazienti con BC metaplastico fino ad oggi (n=2.084), rafforza questi risultati e sottolinea che lo stato del recettore non è un predittore indipendente di sopravvivenza per BC metaplastico (P=0.778) come lo è per il BC non metaplastico.
Un componente terapeutico critico associato a migliori risultati per tutti i pazienti BC metaplastici nel nostro studio è stato l’uso della chemioterapia (HR 0,58, 95% CI 0,45-0,75, P<0,001). Il nostro rapporto è il primo a nostra conoscenza a riferire sui risultati nel BC metaplastico basato sulla sequenza della chemioterapia. Sorprendentemente, la nostra sottoanalisi ha trovato che per i pazienti con BC metaplastico cN0 in particolare, la chemioterapia neoadiuvante è stata associata a peggiore OS rispetto alla chemioterapia adiuvante (HR 1,88, 95% CI 1,34-2,64, P<0,001), mentre la sequenza della chemioterapia non ha avuto alcun effetto sul BC metaplastico clinicamente nodo-positivo. Una possibile spiegazione di questo può essere che i nostri pazienti con BC metaplastico avevano un più alto stato clinico T, che in altri rapporti è stato associato a tassi più bassi di risposta completa patologica e conseguenti peggiori risultati di sopravvivenza. Inoltre, metodi di stadiazione clinica (cioè esame fisico solo, incorporazione di ecografia) può introdurre eterogeneità in una popolazione N0 clinica mancando vero carico di malattia nodale, che di per sé può essere associato a risultati inferiori. Nel complesso, metaplastica BC risposta alla chemioterapia neoadiuvante è stato segnalato per essere basso come 18%, che è molto inferiore ai tassi di risposta noti per TNBC per antracicline e taxani basato su regimi di chemioterapia.
Basato sulla sopravvivenza più poveri e relativamente rapido sviluppo di diffusione metastatica a distanza rispetto ad altri sottotipi di cancro al seno notato nel nostro studio e in altri rapporti, la necessità di opzioni di terapia sistemica migliore è chiaramente evidente per BC metaplastica. Profilo trascrizionale ha mostrato questo sottotipo di cancro per esibire una firma tumorale con caratteristiche simili alle cellule staminali, frequenti aberrazioni nel percorso PI3K/AKT/mTOR e sovraespressione del fattore di crescita endoteliale vascolare (VEGF). Queste caratteristiche sono simili a quelle trovate nei TNBC mesenchimali. Sono in corso sforzi promettenti per identificare regimi alternativi di terapia sistemica per queste pazienti, compreso un recente studio di fase I che ha mostrato migliori tassi di risposta oggettiva alla doxorubicina liposomiale, bevacizumab (anticorpo monoclonale contro VEGF-A), ed everolimus (inibitore mTOR) in pazienti con TNBC metaplastico con un’aberrazione del percorso PI3K.
Per quanto riguarda i trattamenti locali, la mastectomia è stata più comunemente utilizzata nel nostro studio per il BC metaplastico, ma non è stata associata a una migliore sopravvivenza rispetto alla chirurgia conservativa del seno. Inoltre, nessun beneficio di sopravvivenza è stato trovato dal trattamento che ha incorporato ALND rispetto a SLND. La radioterapia, tuttavia, era un predittore significativo di sopravvivenza, con i pazienti BC metaplastici trattati con radioterapia adiuvante che avevano il 30% in meno di probabilità di morire rispetto a quelli che non hanno ricevuto radiazioni. Limitazioni rilevanti nella nostra analisi di radioterapia includono dettagli sconosciuti per quanto riguarda la pianificazione del trattamento, modalità selezionata, garanzia di qualità, o se sono state utilizzate tecniche come profonda inspirazione breath-hold. Mentre la recidiva loco-regionale non può essere esaminata nel NCDB, una serie istituzionale di 113 pazienti con BC metaplastico (54% che ha ricevuto la radioterapia) ha mostrato che la radiazione era l’unico fattore che si correlava con una ridotta recidiva locoregionale (rischio relativo senza radiazione 3.1; 95% CI 1.13-9.88, P=0.027).
I nostri risultati devono essere interpretati con cautela, date le grandi limitazioni di non sapere quali regimi di chemioterapia sono stati utilizzati, la durata dei trattamenti, o la risposta alla chemioterapia neoadiuvante, in quanto tali informazioni non sono disponibili nel NCDB. Riconosciamo anche le limitazioni dei fattori di rischio clincopatologici catturati nell’NCDB, senza i quali potrebbe non essere possibile caratterizzare pienamente le differenze cliniche che guidano alcune delle differenze di risultato che abbiamo trovato, come i peggiori risultati di sopravvivenza con ALND anche quando si controlla lo stato dei linfonodi. Anche se la nostra dimensione del campione di pazienti BC metaplastica era piccola rispetto agli studi BC non metaplastica, è paradossalmente anche probabilmente il più grande studio esistente fino ad oggi esaminando questa domanda dato il numero limitato di pazienti con BC metaplastica riportato in serie istituzionali. Ulteriori indagini sono necessarie per capire la predilezione biologica per la diffusione metastatica in BC metaplastica e convalidare i nostri risultati in serie di dati separati di pazienti BC metaplastica.
Il nostro attuale standard di cura non è chiaramente adeguato per questa popolazione unica di cancro, e ottenere dati randomizzati su BC metaplastica in futuro richiederà sforzi di cooperazione a causa del piccolo numero di pazienti. Il NCDB fornisce un punto di forza degno di nota, che è la capacità di studiare i modelli di trattamento e gli esiti associati a una diagnosi rara. Con 2.084 individui con BC metaplastico in questa coorte, questa è una delle più grandi indagini BC metaplastico segnalato nell’era moderna. Sopravvivenza per questi pazienti è povero rispetto a quelli con qualsiasi altri tipi di BC, e anche se questo fatto probabilmente spinge l’incorporazione della terapia aggressiva, il nostro studio suggerisce che più ampio trattamento locale-regionale (ad esempio, ALND o irradiazione linfonodale regionale) dovrebbe essere attentamente considerato su una base caso per caso. Nel complesso, l’uso della terapia sistemica è cruciale per la gestione del BC metaplastico indipendentemente dal carico nodale, e lo sviluppo di efficaci terapie mirate basate sull’analisi del profilo genomico del tumore mostra la promessa per il futuro.
Materiale supplementare
![]()
Tabella supplementare.
Riconoscimenti
Speciale grazie a Christine Wogan per assistenza editoriale.
Finanziamento
Sostenuto in parte dal Cancer Center Support (Biostatistics Core) Grant CA016672 dal National Cancer Institute, National Institutes of Health, a The University of Texas MD Anderson Cancer Center.
Interessi concorrenti
Gli autori hanno dichiarato che non esistono interessi concorrenti.
1. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA Cancer J Clin. 2018;68(1):7-30
2. Yerushalmi R, Hayes MM, Gelmon KA. Carcinoma della mammella-tipo raro: revisione della letteratura. Ann Oncol. 2009;20(11):1763-1770
3. Günhan-Bilgen I, Memiş A, Ustün EE, Zekioglu O, Ozdemir N. Metaplastic carcinoma of the breast: clinical, mammographic, and sonographic findings with histopathologic correlation. AJR Am J Roentgenol. 2002;178(6):1421-1425
4. Jung S-Y, Kim HY, Nam B-H. et al. Peggior prognosi delle pazienti con cancro al seno metaplastico rispetto alle altre pazienti con cancro al seno triplo-negativo. Breast Cancer Res Treat. 2010;120(3):627-637
5. Wargotz ES, Norris HJ. Carcinomi metaplastici del seno: V. Carcinoma metaplastico con cellule giganti osteoclastiche. Hum Pathol. 1990;21(11):1142-1150
6. Wargotz ES, Norris HJ. Carcinomi metaplastici del seno. I. Carcinoma produttore di matrice. Hum Pathol. 1989;20(7):628-635
7. Wargotz ES, Deos PH, Norris HJ. Carcinomi metaplastici del seno. II. Carcinoma a cellule fusate. Hum Pathol. 1989;20(8):732-740
8. Lee H, Jung S-Y, Ro JY. et al. Carcinoma metaplastico della mammella: caratteristiche clinicopatologiche e prognosi. J Clin Pathol. 2012;65(5):441-446
9. He X, Ji J, Dong R. et al. Prognosi in diversi sottotipi di cancro al seno metaplastico: un’analisi basata sulla popolazione. Breast Cancer Res Treat. Ottobre. 2018
10. Database nazionale del cancro.
11. Chagpar AB, Scoggins CR, Martin RCG. et al. Fattori che determinano l’adeguatezza della dissezione dei linfonodi ascellari in pazienti con cancro al seno. Breast J. 2007;13(3):233-237
12. Bembenek A, Schlag PM. Dissezione linfonodale nel cancro al seno. Langenbeck’s Arch Surg. 2000;385(4):236-245
13. Woolson RF. Metodi statistici per l’analisi dei dati biomedici. New York, USA: John Wiley & Sons. 1987
14. Kaplan EL, Meier P. Nonparametric Estimation from Incomplete Observations NONPARAMETRIC ESTIMATION FROM INCOMPLETE OBSERVATIONS*. Fonte J Am Stat Assoc. 1958;53(282):457-481
15. Mantel N. Valutazione dei dati di sopravvivenza e due nuove statistiche di rango che sorgono nella sua considerazione. Cancer Chemother Rep. 1966;50(3):163-170
16. D.R. C. Modelli di regressione e tabelle di vita. Tabelle di vita di Cox. 1972;2:187-220
17. Rayson D, Adjei AA, Suman VJ, Wold LE, Ingle JN. Carcinoma mammario metaplastico: prognosi e risposta alla terapia sistemica. Ann Oncol Off J Eur Soc Med Oncol. 1999;10(4):413-419
18. Bilimoria KY, Stewart AK, Winchester DP, Ko CY. Il National Cancer Data Base: una potente iniziativa per migliorare la cura del cancro negli Stati Uniti. Ann Surg Oncol. 2008;15(3):683-690
19. Ong CT, Campbell BM, Thomas SM. et al. Metaplastic Breast Cancer Treatment and Outcomes in 2500 Patients: Un’analisi retrospettiva di un database oncologico nazionale. Ann Surg Oncol. 2018;25(8):2249-2260
20. Dietze EC, Sistrunk C, Miranda-Carboni G, O’Regan R, Seewaldt VL. Il cancro al seno triplo-negativo nelle donne afro-americane: disparità rispetto alla biologia. Nat Rev Cancer. 2015;15(4):248-254
21. Rakha EA, El-Sayed ME, Green AR, Lee AHS, Robertson JF, Ellis IO. Marcatori prognostici nel cancro al seno triplo-negativo. Cancer. 2007;109(1):25-32
22. ROJAS K, STUCKEY A. Epidemiologia del cancro al seno e fattori di rischio. Clin Obstet Gynecol. 2016;59(4):651-672
23. Liao H-Y, Zhang W-W, Sun J-Y, Li F-Y, He Z-Y, Wu S-G. Le caratteristiche clinicopatologiche e gli esiti di sopravvivenza di diversi sottotipi istologici nel cancro al seno triplo negativo. J Cancer. 2018;9(2):296-303
24. El Zein D, Hughes M, Kumar S. et al. Il carcinoma metaplastico del seno è più aggressivo del cancro al seno triplo negativo: Uno studio da una singola istituzione e revisione della letteratura. Clin Breast Cancer. 2017;17(5):382-391
25. Liedtke C, Mazouni C, Hess KR. et al. Risposta alla terapia neoadiuvante e sopravvivenza a lungo termine in pazienti con cancro al seno triplo-negativo. J Clin Oncol. 2008;26(8):1275-1281
26. Cortazar P, Zhang L, Untch M. et al. Risposta patologica completa e beneficio clinico a lungo termine nel cancro al seno: il CTNeoBC pooled analysis. Lancet. 2014;384(9938):164-172
27. Fisher B, Brown A, Mamounas E. et al. Effetto della chemioterapia preoperatoria sulla malattia loco-regionale in donne con cancro al seno operabile: risultati dal National Surgical Adjuvant Breast and Bowel Project B-18. J Clin Oncol. 1997;15(7):2483-2493
28. Chen IC, Lin CH, Huang CS. et al. Mancanza di efficacia alla chemioterapia sistemica per il trattamento del carcinoma metaplastico del seno nell’era moderna. Breast Cancer Res Treat. 2011;130(1):345-351
29. Hennessy BT, Gonzalez-Angulo A-M, Stemke-Hale K. et al. Caratterizzazione di un sottogruppo naturale di cancro al seno arricchito in caratteristiche di transizione epitelio-mesenchimale e cellule staminali. Cancer Res. 2009;69(10):4116-4124
30. Prat A, Parker JS, Karginova O. et al. Caratterizzazione fenotipica e molecolare del sottotipo intrinseco claudin-low del cancro al seno. Breast Cancer Res. 2010;12(5):R68
31. Yu K-D, Zhu R, Zhan M. et al. Identificazione di sottogruppi rilevanti per la prognosi in pazienti con cancro al seno triplo-negativo chemioresistente. Clin Cancer Res. 2013;19(10):2723-2733
32. Basho RK, Yam C, Gilcrease M. et al. Comparative Effectiveness of an mTOR-Based Systemic Therapy Regimen in Advanced, Metaplastic and Nonmetaplastic Triple-Negative Breast Cancer. Oncologist. 2018;23(11):1300-1309
33. Basho RK, Gilcrease M, Murthy RK. et al. Targeting the PI3K/AKT/mTOR Pathway for the Treatment of Mesenchymal Triple-Negative Breast Cancer. JAMA Oncol. 2017;3(4):509
34. Bergom C, Currey A, Desai N, Tai A, Strauss JB. Deep Inspiration Breath Hold: tecniche e vantaggi per il risparmio cardiaco durante l’irradiazione del cancro al seno. Front Oncol. 2018;8:87
35. Latty D, Stuart KE, Wang W, Ahern V. Review of deep inspiration breath-hold techniques for the treatment of breast cancer. J Med Radiat Sci. 2015;62(1):74-81
36. Leyrer CM, Berriochoa CA, Agrawal S. et al. Fattori predittivi sugli esiti nel cancro al seno metaplastico. Breast Cancer Res Treat. 2017;165(3):499-504
37. Takala S, Heikkilä P, Nevanlinna H, Blomqvist C, Mattson J. Carcinoma metaplastico del seno: Prognosi e risposta al trattamento sistemico nella malattia metastatica. Breast J. 2019;25(3):418-424
38. Harper NW, Hodges KB, Stewart RL. et al. Adjuvant Treatment of Triple-Negative Metaplastic Breast Cancer With Weekly Paclitaxel and Platinum Chemotherapy: Revisione retrospettiva dei casi di una singola istituzione. Clin Breast Cancer. Maggio. 2019