Nome generico: lidocaina cloridrato
Forma farmaceutica: soluzione orale
Rx only
Un anestetico topico per le mucose della bocca e della faringe.
Casi post-marketing di convulsioni, arresto cardiopolmonare e morte in pazienti di età inferiore ai 3 anni sono stati riportati con l’uso di Lidocaina Viscosa 2% quando non è stato somministrato in stretta aderenza alle raccomandazioni di dosaggio e somministrazione. In caso di dolore da dentizione, la lidocaina viscosa 2% non deve essere usata in generale. Per altre condizioni, l’uso del prodotto in pazienti di età inferiore ai 3 anni deve essere limitato a quelle situazioni in cui non sono disponibili alternative più sicure o sono state provate ma hanno fallito.
Per diminuire il rischio di gravi eventi avversi con l’uso di Lidocaina Viscosa 2%, istruire i caregivers ad aderire rigorosamente alla dose prescritta e la frequenza della somministrazione e conservare la bottiglia di prescrizione in modo sicuro fuori dalla portata dei bambini.
- DESCRIZIONE
- Soluzione orale topica della lidocaina – Farmacologia clinica
- Meccanismo di azione
- Emodinamica
- Farmacocinetica e metabolismo
- Indicazioni ed uso per la soluzione orale topica della lidocaina
- Contraindicazioni
- Avvertenze
- Eventi mortali e pericolosi per la vita nei neonati e nei bambini piccoli
- Metemoglobinemia
- Precauzioni
- Informazioni per i pazienti
- Generale
- Interazioni farmacologiche
- Carcinogenesi, mutagenesi, compromissione della fertilità
- Gravidanza
- Madri che allattano
- Uso pediatrico
- Reazioni avverse
- Sistema Nervoso Centrale
- Sovradosaggio
- Gestione delle emergenze da anestetici locali
- DOSAGGIO E AMMINISTRAZIONE
- Adulto
- Pediatrico
- Come fornito
- Package/Label Display Panel
- Package/Label Display Panel
DESCRIZIONE
Lidocaina Viscosa 2% (Lidocaina cloridrato orale soluzione USP) contiene un agente anestetico locale ed è amministrato topicamente. La lidocaina viscosa 2% (soluzione topica orale del cloridrato della lidocaina USP) contiene il cloridrato della lidocaina, che è chimicamente designato come acetamide, 2-(diethylamino)-N-(2,6-dimethylphenyl)-,monohydrochloride ed ha la seguente formula strutturale:
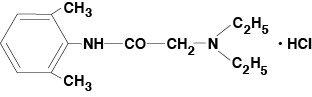
La formula molecolare della lidocaina è C14H22N2O. Il peso molecolare è 234,34.
Composizione della soluzione:
Ogni mL contiene 20 mg (2%) di lidocaina cloridrato USP e i seguenti ingredienti inattivi: carbossimetilcellulosa sodica, aromi, metilparaben, propilparaben, acqua purificata e saccarina sodica.
Soluzione orale topica della lidocaina – Farmacologia clinica
Meccanismo di azione
La lidocaina stabilizza la membrana neuronale inibendo i flussi ionici richiesti per l’inizio e la conduzione degli impulsi, effettuando così l’azione anestetica locale.
Emodinamica
L’eccesso di sangue può causare cambiamenti nella portata cardiaca, nella resistenza periferica totale e nella pressione arteriosa media. Questi cambiamenti possono essere attribuibili a un effetto depressivo diretto dell’agente anestetico locale su vari componenti del sistema cardiovascolare. L’effetto netto è normalmente un’ipotensione modesta quando i dosaggi raccomandati non sono superati.
Farmacocinetica e metabolismo
La lidocaina viene assorbita dopo la somministrazione topica alle membrane mucose, il suo tasso e l’estensione dell’assorbimento dipendono dalla concentrazione e dalla dose totale somministrata, dal sito specifico di applicazione e dalla durata di esposizione. In generale, il tasso di assorbimento degli agenti anestetici locali dopo l’applicazione topica avviene più rapidamente dopo la somministrazione intratracheale. La lidocaina è anche ben assorbita dal tratto gastrointestinale, ma poco farmaco intatto appare nella circolazione a causa della biotrasformazione nel fegato. Il legame plasmatico della lidocaina dipende dalla concentrazione del farmaco e la frazione legata diminuisce con l’aumentare della concentrazione. A concentrazioni da 1 a 4 mcg di base libera per mL, il 60-80% della lidocaina è legato alle proteine. Il legame inoltre dipende dalla concentrazione plasmatica della glicoproteina dell’alfa-1-acido.
La lidocaina attraversa le barriere emato-encefaliche e placentari, presumibilmente per diffusione passiva.
La lidocaina è metabolizzata rapidamente dal fegato ed i metaboliti e la droga immutata sono espulsi dai reni. La biotrasformazione comprende la N-dealchilazione ossidativa, l’idrossilazione dell’anello, la scissione del legame ammidico e la coniugazione. La N-dealchilazione, una via principale di biotrasformazione, produce i metaboliti monoetilglicinexilidide e glicinexilidide. Le azioni farmacologiche/tossicologiche di questi metaboliti sono simili, ma meno potenti di quelle della lidocaina. Circa il 90% della lidocaina somministrata viene escreta sotto forma di vari metaboliti e meno del 10% viene escreto invariato. Il metabolita principale nelle urine è un coniugato di 4-idrossi-2, 6-dimetilanilina.
L’emivita di eliminazione della lidocaina dopo un’iniezione endovenosa del bolo è tipicamente 1,5 – 2 ore. A causa del tasso rapido a cui la lidocaina è metabolizzata, qualsiasi condizione che colpisce la funzione epatica può alterare la cinetica della lidocaina. L’emivita può essere prolungata due volte o più in pazienti con disfunzione epatica. La disfunzione renale non influenza la cinetica della lidocaina ma può aumentare l’accumulo di metaboliti.
Fattori come l’acidosi e l’uso di stimolanti e depressori del SNC influenzano i livelli del SNC di lidocaina necessari per produrre effetti sistemici evidenti. Le manifestazioni avverse oggettive diventano sempre più evidenti con l’aumento dei livelli plasmatici venosi oltre i 6 mcg di base libera per mL. Nella scimmia del rhesus i livelli di sangue arterioso di 18 – 21 mcg/mL sono stati indicati per essere soglia per attività convulsiva.
Indicazioni ed uso per la soluzione orale topica della lidocaina
La lidocaina è indicata per la produzione di anestesia topica delle mucose irritate o infiammate della bocca e della faringe. È inoltre utile per ridurre i conati di vomito durante la presa delle immagini dei raggi X e delle impronte dentarie.
Contraindicazioni
La lidocaina è controindicata in pazienti con una storia nota di ipersensibilità agli anestetici locali del tipo ammide, o ad altri componenti della soluzione.
Avvertenze
Il dosaggio eccessivo, o i brevi intervalli tra le dosi, possono provocare alti livelli di plasma e gravi effetti collaterali. I PAZIENTI DEVONO ESSERE ISTRUITI AD ATTENERSI STRETTAMENTE AL DOSAGGIO RACCOMANDATO E ALLE LINEE GUIDA DI SOMMINISTRAZIONE COME INDICATO IN QUESTO FOGLIETTO ILLUSTRATIVO. IL TRATTAMENTO DI SERIE REAZIONI AVVERSE PUÒ RICHIEDERE L’USO DI ATTREZZATURE RESUSCITATIVE, OSSIGENO E ALTRI FARMACI RESUSCITATIVI.
La lidocaina deve essere usata con estrema cautela se la mucosa nella zona di applicazione è stata traumatizzata, poiché in tali condizioni esiste il potenziale per un rapido assorbimento sistemico.
Eventi mortali e pericolosi per la vita nei neonati e nei bambini piccoli
Casi post-marketing di convulsioni, arresto cardiopolmonare e morte in pazienti di età inferiore ai 3 anni sono stati riportati con l’uso di Lidocaina Viscosa 2% quando non è stata somministrata in stretta aderenza alle raccomandazioni di dosaggio e somministrazione. In caso di dolore da dentizione, la lidocaina viscosa 2% non dovrebbe generalmente essere usata. Per altre condizioni, l’uso del prodotto in pazienti di età inferiore ai 3 anni dovrebbe essere limitato a quelle situazioni in cui le alternative più sicure non sono disponibili o sono state provate ma hanno fallito.
Metemoglobinemia
Casi di metemoglobinemia sono stati riportati in associazione all’uso di anestetici locali. Anche se tutti i pazienti sono a rischio di metemoglobinemia, i pazienti con deficit di glucosio-6-fosfato deidrogenasi, metemoglobinemia congenita o idiopatica, compromissione cardiaca o polmonare, neonati sotto i 6 mesi di età ed esposizione concomitante ad agenti ossidanti o loro metaboliti sono più suscettibili a sviluppare manifestazioni cliniche della condizione. Se gli anestetici locali devono essere usati in questi pazienti, si raccomanda un attento monitoraggio per i sintomi e i segni della metemoglobinemia.
I segni della metemoglobinemia possono verificarsi immediatamente o possono essere ritardati alcune ore dopo l’esposizione, e sono caratterizzati da uno scolorimento cianotico della pelle e/o una colorazione anormale del sangue. I livelli di metemoglobina possono continuare ad aumentare; quindi, il trattamento immediato è richiesto per evitare il sistema nervoso centrale più serio e gli effetti avversi cardiovascolari, compreso le convulsioni, il coma, le aritmie e la morte. Interrompere la Lidocaina Viscosa 2% e qualsiasi altro agente ossidante. A seconda della gravità dei segni e dei sintomi, i pazienti possono rispondere alle cure di supporto, cioè all’ossigenoterapia e all’idratazione. Una presentazione clinica più grave può richiedere il trattamento con blu di metilene, trasfusione di scambio, o ossigeno iperbarico.
Precauzioni
Informazioni per i pazienti
Genitori e assistenti devono essere messi in guardia su quanto segue:
– Per i pazienti sotto i 3 anni di età, particolare attenzione deve essere data alla misurazione accurata della dose prescritta e non somministrare il prodotto più spesso di quanto prescritto. – Per garantire l’accuratezza, si consiglia di utilizzare un dispositivo di misurazione per misurare attentamente il volume corretto. – Il prodotto deve essere usato solo per l’indicazione prescritta. – Per ridurre il rischio di ingestione accidentale, il contenitore del prodotto deve essere ben chiuso e il prodotto deve essere conservato fuori dalla portata dei bambini subito dopo ogni utilizzo. – Se il paziente mostra segni di tossicità sistemica (ad esempio, letargia, respirazione superficiale, attività convulsiva) è necessario richiedere immediatamente assistenza medica di emergenza e non somministrare altro prodotto. – Il prodotto non utilizzato deve essere eliminato in modo da evitare la possibile esposizione di bambini e animali domestici.
Tutti i pazienti devono essere consapevoli che quando gli anestetici topici vengono utilizzati nella bocca o nella gola, la produzione di anestesia topica può compromettere la deglutizione e quindi aumentare il pericolo di aspirazione. Per questo motivo, il cibo non dovrebbe essere ingerito per 60 minuti dopo l’uso di preparati anestetici locali nella zona della bocca o della gola. Questo è particolarmente importante nei bambini a causa della loro frequenza nel mangiare.
L’intorpidimento della lingua o della mucosa buccale può aumentare il pericolo di un trauma da morso. Per questo motivo il cibo e/o la gomma da masticare non devono essere usati mentre la bocca o l’area della gola sono anestetizzate.
Informare i pazienti che l’uso di anestetici locali può causare metemoglobinemia, una condizione grave che deve essere trattata prontamente. Avvisare i pazienti o chi si prende cura di loro di cercare immediatamente assistenza medica se loro o qualcuno nella loro cura sperimentano i seguenti segni o sintomi: pallido, grigio, o pelle di colore blu (cianosi); mal di testa; rapida frequenza cardiaca; mancanza di respiro; stordimento; o affaticamento.
Generale
La sicurezza e l’efficacia della lidocaina dipendono dal corretto dosaggio, tecnica corretta, adeguate precauzioni, e la disponibilità per le emergenze (vedi AVVERTENZE e REAZIONI AVVERSE). Il dosaggio più basso che risulta nell’efficace anestesia dovrebbe essere usato per evitare i livelli elevati del plasma e gli effetti contrari seri. Le dosi ripetute di lidocaina possono causare gli aumenti significativi nei livelli del sangue con ogni dose ripetuta a causa di accumulazione lenta della droga e/o dei suoi metaboliti. La tolleranza varia con lo stato del paziente. I pazienti debilitati, anziani, i pazienti acutamente malati ed i bambini dovrebbero essere dati le dosi ridotte commensurate con la loro età, peso e condizione fisica. La lidocaina dovrebbe anche essere usata con prudenza in pazienti con lo shock severo o il blocco cardiaco.
La lidocaina dovrebbe essere usata con prudenza in persone con sensibilità conosciuta della droga. I pazienti allergici ai derivati dell’acido paraaminobenzoico (procaina, tetracaina, benzocaina, ecc.) non hanno mostrato sensibilità incrociata alla lidocaina.
Interazioni farmacologiche
I pazienti a cui vengono somministrati anestetici locali sono a maggior rischio di sviluppare metemoglobinemia se esposti contemporaneamente ai seguenti farmaci, che potrebbero includere altri anestetici locali:
Esempi di farmaci associati a metemoglobinemia:
|
Classe |
Esempi |
|
Nitrati/Nitriti |
nitroglicerina, nitroprussiato, ossido nitrico, protossido di azoto |
|
Anestetici locali |
benzocaina, lidocaina, bupivacaina, mepivacaina, tetracaina, prilocaina, procaina, articaina, ropivacaina |
|
Agenti antineoplastici |
ciclofosfamide, flutamide, rasburicase, ifosfamide, idrossiurea |
|
antibiotici |
dapsone, sulfamidici, nitrofurantoina, acido para-aminosalicilico |
|
Antimalarici |
clorochina, primaquina |
|
Anticonvulsivanti |
fenitoina, valproato di sodio, fenobarbital |
|
altri farmaci |
acetaminofene, metoclopramide, sulfasalazina, chinino |
Carcinogenesi, mutagenesi, compromissione della fertilità
Non sono stati condotti studi sulla lidocaina negli animali per valutare il potenziale cancerogeno e mutageno o gli effetti sulla fertilità.
Gravidanza
Effetti teratogeni
Categoria B: Studi sulla riproduzione sono stati eseguiti sui ratti a dosi fino a 6,6 volte la dose umana e non hanno rivelato alcuna prova di danni al feto causati dalla lidocaina. Non ci sono, tuttavia, studi adeguati e ben controllati in donne incinte. Poiché gli studi sulla riproduzione animale non sono sempre predittivi della risposta umana, questo farmaco dovrebbe essere usato in gravidanza solo se chiaramente necessario.
Madri che allattano
Non è noto se questo farmaco è escreto nel latte umano. Poiché molte droghe sono escrete in latte umano, la cautela dovrebbe essere esercitata quando la lidocaina è amministrata alle donne d’allattamento.
Uso pediatrico
Il dosaggio nei bambini dovrebbe essere ridotto, commisurato all’età, al peso corporeo ed alle condizioni fisiche. Vedere DOSAGE AND ADMINISTRATION.
Reazioni avverse
Le esperienze avverse in seguito alla somministrazione di lidocaina sono simili in natura a quelle osservate con altri agenti anestetici locali amidici. Queste esperienze avverse sono, in generale, correlate alla dose e possono derivare da alti livelli plasmatici causati da un dosaggio eccessivo o da un rapido assorbimento, o possono derivare da un’ipersensibilità, idiosincrasia o diminuita tolleranza da parte del paziente. Le esperienze avverse gravi sono generalmente di natura sistemica. I seguenti tipi sono quelli più comunemente riportati:
Sistema Nervoso Centrale
Le manifestazioni del SNC sono eccitatorie e/o depressive e possono essere caratterizzate da stordimento, nervosismo, apprensione, euforia, confusione, vertigini, sonnolenza, tinnito, visione offuscata o doppia, vomito, sensazioni di calore, freddo o intorpidimento, contrazioni, tremori, convulsioni, incoscienza, depressione respiratoria e arresto. Le manifestazioni eccitatorie possono essere molto brevi o non verificarsi affatto, nel qual caso la prima manifestazione di tossicità può essere sonnolenza che si fonde con incoscienza e arresto respiratorio.
La sonnolenza dopo la somministrazione di lidocaina è di solito un segno precoce di un alto livello ematico del farmaco e può verificarsi come conseguenza del rapido assorbimento.
Sistema cardiovascolare
Le manifestazioni cardiovascolari sono solitamente depressive e sono caratterizzate da bradicardia, ipotensione e collasso cardiovascolare, che può portare all’arresto cardiaco.
Allergiche
Le reazioni allergiche sono caratterizzate da lesioni cutanee, orticaria, edema o reazioni anafilattoidi. Le reazioni allergiche possono verificarsi come risultato della sensibilità all’agente anestetico locale o al metilparabene e/o al propilparabene usati in questa formulazione. Le reazioni allergiche come risultato della sensibilità alla lidocaina sono estremamente rare e, se si verificano, devono essere gestite con mezzi convenzionali. La rilevazione della sensibilità tramite test cutaneo è di dubbio valore.
Sovradosaggio
Le emergenze acute da anestetici locali sono generalmente legate ad alti livelli plasmatici incontrati durante l’uso terapeutico degli anestetici locali. (Vedere REAZIONI AVVERSE, AVVERTENZE e PRECAUZIONI)
Gestione delle emergenze da anestetici locali
La prima considerazione è la prevenzione, meglio realizzata con un attento e costante monitoraggio dei segni vitali cardiovascolari e respiratori e dello stato di coscienza del paziente dopo ogni somministrazione di anestetico locale.
Il primo passo nella gestione delle convulsioni consiste nell’attenzione immediata al mantenimento di una via aerea aperta e alla ventilazione assistita o controllata con ossigeno. In situazioni in cui il personale addestrato è prontamente disponibile, la ventilazione dovrebbe essere mantenuta e l’ossigeno dovrebbe essere fornito da un sistema di erogazione in grado di consentire l’immediata pressione positiva delle vie aeree tramite maschera. Immediatamente dopo l’istituzione di queste misure ventilatorie, l’adeguatezza della circolazione dovrebbe essere valutata, tenendo presente che i farmaci usati per trattare le convulsioni a volte deprimono la circolazione quando somministrati per via endovenosa. Se le convulsioni persistono nonostante un adeguato supporto respiratorio, e se lo stato della circolazione lo permette, si possono somministrare per via endovenosa piccoli incrementi di un barbiturico ad azione ultra-corta (come il tiopentale o il tiamylal) o una benzodiazepina (come il diazepam). Il medico dovrebbe avere familiarità, prima dell’uso di anestetici locali, con questi farmaci anticonvulsivanti. Il trattamento di supporto della depressione circolatoria può richiedere la somministrazione di fluidi per via endovenosa e, quando appropriato, un vasopressore come indicato dalla situazione clinica (ad esempio, efedrina).
Se non vengono trattati immediatamente, sia le convulsioni che la depressione cardiovascolare possono provocare ipossia, acidosi, bradicardia, aritmie e arresto cardiaco. Se l’arresto cardiaco dovrebbe accadere, le misure resuscitative cardiopolmonari standard dovrebbero essere istituite.
La dialisi è di valore trascurabile nel trattamento del sovradosaggio acuto con lidocaina.
La LD50 orale di lidocaina in ratti femminili non digiuni è 459 (346 – 773) mg/kg (come il sale) e 214 (159 – 324) mg/kg (come il sale) in ratti femminili digiuni.
DOSAGGIO E AMMINISTRAZIONE
Adulto
La dose singola massima raccomandata di lidocaina per gli adulti sani dovrebbe essere tale che la dose di lidocaina non superi 4.5 mg/kg o 2 mg/lb di peso corporeo e non superi in ogni caso un totale di 300 mg.
Per il trattamento sintomatico delle membrane mucose irritate o infiammate della bocca e della faringe, la dose abituale per gli adulti è di 15 mL non diluiti. Per l’uso in bocca, la soluzione deve essere fatta scorrere nella bocca e sputata. Per l’uso nella faringe, la soluzione non diluita deve essere gargarizzata e può essere inghiottita. Questa dose non dovrebbe essere somministrata a intervalli inferiori a tre ore, e non più di otto dosi dovrebbero essere date in un periodo di 24 ore. Il dosaggio deve essere aggiustato in base all’età, al peso e alla condizione fisica del paziente (vedi PRECAUZIONI).
Pediatrico
Si deve prestare attenzione a garantire un dosaggio corretto in tutti i pazienti pediatrici poiché ci sono stati casi di sovradosaggio dovuti a dosaggio inappropriato.
È difficile raccomandare una dose massima di qualsiasi farmaco per i bambini poiché questa varia in funzione dell’età e del peso. Per i bambini sopra i 3 anni di età che hanno una massa magra normale e uno sviluppo corporeo normale, la dose massima è determinata dal peso o dall’età del bambino. Per esempio: in un bambino di 5 anni che pesa 50 libbre, la dose di lidocaina non dovrebbe superare 75 a 100 mg (3,7 a 5 mL di lidocaina).
Per i neonati e nei bambini sotto i 3 anni di età, la soluzione deve essere accuratamente misurata e non più di 1,2 mL essere applicato alla zona immediata con un applicatore con punta di cotone. Attendere almeno 3 ore prima di dare la dose successiva; un massimo di quattro dosi può essere dato in un periodo di 12 ore. La lidocaina dovrebbe essere usata soltanto se la circostanza di fondo richiede il trattamento con un volume del prodotto che è di meno o uguale a 1,2 mL.
Come fornito
Lidocaina viscosa 2% (soluzione topica orale del cloridrato della lidocaina USP)
La soluzione topica orale 2% è fornita come chiara, soluzione incolore e viscosa.
NDC 0054-0548-44: Flacone da 20 mL
NDC 0054-3500-49: Flacone da 100 mL
Conserva a 20° a 25°C (68° a 77°F).
Dispensare in un contenitore a prova di bambino come definito nella USP/NF.
AVVOLGERE BENE PRIMA DELL’USO.
Distr. da: West-Ward
Pharmaceuticals Corp.
Eatontown, NJ 07724
Revised October 2018
Package/Label Display Panel
NDC 0054-3500-49 Lidocaine Viscous (Lidocaine Hydrochloride Oral Topical Solution USP) 100mL

Package/Label Display Panel
NDC 0054-0548-44 Lidocaina Viscosa (cloridrato di lidocaina soluzione orale topica USP) 15mL

| LIDOCAINA VISCOUS soluzione cloridrato di lidocaina |
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
| LIDOCAINA VISCOUS lidocaina cloridrato soluzione |
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
Etichettatore – West-Ward Pharmaceuticals Corp. (080189610)
| Stabilimento | |||
| Nome | Indirizzo | ID/FEI | Operazioni |
| West-Ward Columbus Inc. | 058839929 | MANUFACTURE(0054-3500, 0054-0548) | |
Medical Disclaimer