Contenuti
- 1 Funzione
- 2 Lattato Deidrogenasi umana
- 2.1 Struttura
- 2.2 Catalisi
- 2.3 Cinetica
- 2.4 Regolazione
- 3 Strutture 3D della lattato deidrogenasi
Funzione
L-lattato deidrogenasi (L-LDH) catalizza l’interconversione di piruvato e NADH+ in L-lattato e NAD+.
H-lattato deidrogenasi (H-LDH) catalizza l’interconversione di D-lattato e ferricitocromo c in piruvato e ferrocitocromo c.
La lattato deidrogenasi (LDH) è un enzima importante nell’uomo. Si presenta in diverse regioni del corpo, ogni regione ha una conformazione unica di diverse subunità. LDH è un enzima chiave nella respirazione anaerobica. La respirazione anaerobica è la respirazione in assenza di ossigeno. Questa via è importante per la glicolisi in due modi principali. Il primo è che se il piruvato dovesse accumularsi la glicolisi e quindi la generazione di ATP rallenterebbe. Il secondo è che la respirazione anaerobica permette la rigenerazione di NAD+ da NADH. Il NAD+ è necessario quando la gliceraldeide-3-fosfato deidrogenasi ossida la gliceraldeide-3-fosfato nella glicolisi, che genera NADH. La lattato deidrogenasi è responsabile della conversione anaerobica di NADH in NAD+. nella lattato deidrogenasi da Cryptosporidium parvum (4nd4).
La lattato deidrogenasi umana
Struttura
è una proteina quaternaria formata dalla combinazione di due subunità, M e H (muscolo e cuore) in una struttura di quattro delle subunità. Le varie combinazioni che si trovano nel corpo umano sono:
- (4H) Cuore
- (3H1M) Reticuloendoteliale
- (2H2M) Polmoni
- (1H3M) Reni
- (4M) Muscolo e Fegato
La di LDH come mostrato qui è composta dal 40% di alfa eliche e 23% di fogli beta. I dati SCOP classificano questa forma di lattato deidrogenasi come mista beta-alfa-beta, con principalmente fogli beta paralleli.
Vedi anche
- Lattato deidrogenasi umana
- Jasper Lactate Final
- piega di Rossmann.
Catalisi
Gli studi hanno dimostrato che il meccanismo di reazione della LDH segue una sequenza ordinata.
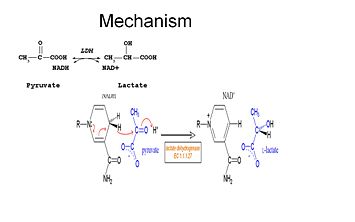
Per poter ossidare il lattato il NADH deve legarsi all’enzima per primo seguito dal lattato. . Una volta che il NADH è legato all’enzima, è possibile che il lattato si leghi (il substrato ossamato è mostrato; il gruppo -CH3 è sostituito da -NH2 per formare ossamato). Il lattato si lega all’enzima tra l’anello di nicotinamide e diversi residui di LDH. Il trasferimento di uno ione idruro avviene rapidamente in entrambe le direzioni, dando una miscela dei due complessi terziari, enzima-NAD+-lattato ed enzima-NADH-piruvato, infine il piruvato si dissocia dall’enzima seguito dal NAD+.
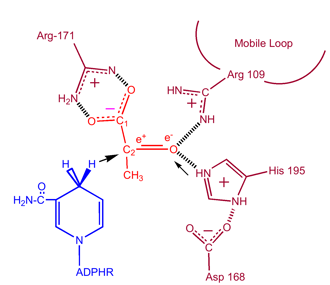
Cinetica
Gli studi cinetici della lattato deidrogenasi con ossalato e ossamato (analoghi strutturali del lattato e del piruvato) hanno dimostrato il meccanismo sopra descritto. Il passo limitante del tasso in questa reazione è il tasso di dissociazione di NAD+ e NADH. La conversione del piruvato in lattato con la successiva rigenerazione di NAD+ è molto favorevole.
Regolazione
Come il meccanismo è di equilibrio, non sembra esserci una regolazione specifica per la lattato deidrogenasi, invece dipende dall’attivazione della riparazione anaerobica e dalla presenza di piruvato e NADH, o lattato e NAD+.
Strutture 3D della lattato deidrogenasi
Strutture 3D della lattato deidrogenasi
