US Pharm. 2016;41(6):HS14-HS18.
ABSTRACT: La malattia di Graves è un disturbo autoimmune che si verifica quando il sistema immunitario attacca la ghiandola tiroidea e la induce a produrre troppo ormone tiroideo (ipertiroidismo). La causa esatta della malattia di Graves non è nota. Il disturbo può colpire chiunque a qualsiasi età, ma è più comune nelle donne. Se non trattata, la malattia di Graves può causare una crisi grave e pericolosa per la vita (cioè una tempesta tiroidea). Gli obiettivi principali del trattamento sono l’eliminazione dell’ormone tiroideo in eccesso e la riduzione delle conseguenze a lungo termine della malattia. I trattamenti includono lo iodio radioattivo, i farmaci antitiroidei (propiltiouracile, metimazolo) e la chirurgia. I beta-bloccanti possono essere utilizzati per fornire sollievo sintomatico.
La malattia di Graves prende il nome dal medico che per primo ha descritto la condizione in Irlanda nel 1835-Robert J. Graves.1 Viene anche chiamata malattia di Basedow, dal nome di un medico tedesco, Karl Adolph von Basedow, che ha anche descritto il disturbo nel 1840. Egli non sapeva che Graves aveva descritto la stessa malattia qualche anno prima. Il termine morbo di Basedow è più comunemente usato nell’Europa continentale; negli Stati Uniti, è chiamato morbo di Graves.1
La tiroide, una ghiandola a forma di farfalla situata nella parte anteriore del collo, è un importante organo del sistema endocrino.2 Questa ghiandola rilascia gli ormoni tiroxina (T4) e triiodotironina (T3), che controllano il metabolismo del corpo.3-6 L’ormone tiroideo aiuta il corpo a utilizzare l’energia, a rimanere caldo e a mantenere il cervello, il cuore, i muscoli e altri organi che funzionano correttamente. Il controllo del metabolismo è importante per regolare l’umore, il peso e i livelli di energia mentale e fisica. Quando il corpo produce troppo ormone tiroideo, la condizione è chiamata ipertiroidismo. Una ghiandola tiroidea sottoattiva porta all’ipotiroidismo.
Perché gli ormoni tiroidei influenzano vari sistemi del corpo, i segni e i sintomi associati alla malattia di Graves possono essere di ampia portata e influenzare significativamente il benessere generale di una persona. I segni comuni dell’ipotiroidismo includono letargia, pelle secca, capelli e unghie fragili e sensibilità alle basse temperature.3,4 I segni tipici dell’ipertiroidismo sono spesso l’opposto e comprendono tachicardia, sensibilità al calore e pelle umida e grassa.3-7 Anche se un certo numero di disturbi può provocare ipertiroidismo, la malattia di Graves è una causa comune.
Anche se la malattia di Graves può colpire chiunque, è più comune tra le donne e ha un esordio prima dei 40 anni.1,7-9 L’incidenza è circa 1 su 2.000 persone (0,05%). I fattori che aumentano il rischio di malattia di Graves sono descritti nella TABELLA 1.4,8,10,11

Patofisiologia
La malattia di Graves è un disordine autoimmune che può verificarsi quando il sistema immunitario attacca erroneamente il tessuto tiroideo sano, portando all’iperattività della ghiandola tiroidea. Normalmente, la funzione tiroidea è regolata da un ormone rilasciato dalla ghiandola pituitaria. Quando è necessario, il sistema immunitario del corpo produce anticorpi progettati per colpire un virus specifico, un batterio o un’altra sostanza estranea. Nella malattia di Graves, il corpo produce un anticorpo contro alcune delle cellule della ghiandola tiroidea. L’anticorpo associato alla malattia di Graves, l’anticorpo del recettore della tireotropina, imita l’ormone pituitario regolatore e annulla la normale regolazione della tiroide da parte del corpo, causando una sovrapproduzione di ormoni tiroidei.2,6,8,9
Questi anticorpi, chiamati immunoglobuline stimolanti la tiroide (STI), fanno crescere la tiroide e producono più ormone tiroideo del necessario. Le STI si legano ai recettori delle cellule tiroidee, che normalmente sono “punti di attracco” per l’ormone stimolante la tiroide (TSH). I TSI quindi ingannano la tiroide a crescere e produrre troppo ormone tiroideo, portando all’ipertiroidismo. La ghiandola tiroidea può ingrandirsi quando la dieta del paziente manca di sufficiente iodio o quando i livelli di TSH diventano elevati in risposta a un difetto nella normale sintesi dell’ormone da parte della ghiandola tiroidea. Nella malattia di Graves, l’autoimmunità mediata dai linfociti B e T è nota per essere diretta agli antigeni tiroidei familiari: tireoglobulina, perossidasi tiroidea, simpatizzante dello ioduro di sodio e recettore della tireotropina. Il recettore della tireotropina è l’autoantigene primario della malattia di Graves ed è responsabile della manifestazione dell’ipertiroidismo. I sintomi cardinali dell’ipertiroidismo includono occhi sporgenti (esoftalmo), intolleranza al calore, aumento di energia, tachicardia, difficoltà a dormire, diarrea e ansia. Segni e sintomi specifici della malattia di Graves sono elencati nella TABELLA 2.4,10,11 Se non trattata, la malattia di Graves può causare una grave tireotossicosi o tempesta tiroidea.9,10,12,13

Le manifestazioni non comuni della malattia di Graves includono la dermopatia di Graves (un arrossamento e un ispessimento della pelle, spesso sugli stinchi o sulla parte superiore dei piedi) e l’oftalmopatia di Graves (un accumulo di certi carboidrati nella pelle).2,8
Complicazioni della malattia di Graves
Ci sono molte complicazioni associate alla malattia di Graves, inclusi problemi di gravidanza, disturbi cardiaci, osteoporosi e tempesta tiroidea. Le possibili complicazioni durante la gravidanza includono aborto spontaneo, parto pretermine, disfunzione tiroidea fetale, scarsa crescita fetale, insufficienza cardiaca materna e preeclampsia.4,5,8 Se non trattata, la malattia di Graves può portare a disturbi del ritmo cardiaco, cambiamenti nella struttura e nella funzione dei muscoli cardiaci e l’incapacità del cuore di pompare abbastanza sangue al corpo.5,8,10 L’ipertiroidismo non trattato può anche portare a ossa deboli e fragili.5,8
La tempesta tiroidea è una complicazione rara e pericolosa per la vita, nota anche come ipertiroidismo accelerato o crisi tireotossica.2,9,13-16 È più probabile quando l’ipertiroidismo grave non viene trattato o viene trattato in modo inadeguato. Gli effetti avversi gravi includono febbre, sudorazione profusa, vomito, diarrea, delirio, debolezza grave, convulsioni, battito cardiaco marcatamente irregolare, ittero, pressione sanguigna gravemente bassa e coma. La tempesta tiroidea spesso richiede cure immediate di emergenza.5,8,15
Test e diagnosi
La diagnosi della malattia di Graves include diverse fasi. Durante un esame fisico, gli occhi saranno esaminati per vedere se sono irritati o sporgenti, e se la ghiandola tiroidea è ingrandita.8 La frequenza cardiaca, la pressione sanguigna e qualsiasi segno di tremori saranno monitorati. Gli esami del sangue indicano che i livelli di TSH e tiroide sono solitamente elevati nella malattia di Graves.8 La quantità e il tasso di iodio radioattivo assorbito dalla tiroide aiuta a determinare se la malattia di Graves o un’altra condizione è la causa dell’ipertiroidismo. L’ecografia può mostrare se la ghiandola tiroidea è ingrossata, ed è più utile nelle persone che non possono sottoporsi alla captazione dello iodio radioattivo, come le donne in gravidanza. I test di imaging (TAC o risonanza magnetica) possono aiutare a identificare e diagnosticare l’oftalmopatia di Graves.5
Trattamento
Gli obiettivi principali del trattamento dell’ipertiroidismo sono l’eliminazione dell’ormone tiroideo in eccesso e la riduzione delle conseguenze a lungo termine.9 I trattamenti includono lo iodio radioattivo, i farmaci antitiroidei (propiltiouracile, metimazolo) e la chirurgia.2,8-10 I beta-bloccanti sono talvolta aggiunti per fornire sollievo sintomatico.9,13,15
Terapia con iodio radioattivo (RIT): La dose usuale per la RIT varia da 5 a 15 mCi di 131I. In generale, dosaggi più alti sono necessari per i pazienti che hanno gozzi grandi o basso assorbimento di radioiodio, o che sono stati pretrattati con farmaci antitiroidei.15,16
Perché la tiroide ha bisogno di iodio per produrre ormoni, il radioiodio va nelle cellule tiroidee e, nel tempo, le cellule tiroidee iperattive vengono distrutte. La ghiandola tiroidea si riduce, e in diverse settimane o mesi, i sintomi ipertiroidei diminuiscono gradualmente.16 La RIT può aumentare il rischio di nuovi o peggiorati sintomi dell’oftalmopatia di Graves. Questo effetto avverso è solitamente lieve e temporaneo, ma la terapia può non essere utilizzata se la persona ha già problemi agli occhi da moderati a gravi. Altri effetti collaterali di questa terapia includono tenerezza nel collo e un aumento temporaneo dei livelli di ormone tiroideo. Poiché questo trattamento può causare un declino della funzione tiroidea complessiva, la RIT non viene solitamente utilizzata nelle donne in gravidanza o che allattano. Potrebbero essere necessari altri trattamenti per fornire al corpo quantità normali di ormone tiroideo. I pazienti che attualmente assumono farmaci antitiroidei devono sospendere il farmaco almeno 2 giorni prima di assumere il radiofarmaco.11,16 Con lo iodio radioattivo, l’obiettivo della terapia è quello di causare uno stato ipotiroideo dovuto alla distruzione della ghiandola tiroidea, che di solito si verifica da 2 a 3 mesi dopo la somministrazione del farmaco. La controindicazione assoluta per la radioiodina è la gravidanza.14,16,17
Medicina antitiroidea (ATM): Gli ATM funzionano bloccando l’uso dello iodio da parte della tiroide per produrre ormoni.5,11 Questi farmaci includono PTU orale e MMI. Il PTU può essere usato quando i pazienti non possono tollerare l’MMI, lo iodio radioattivo o la chirurgia. Quando si usano questi farmaci, nel tempo può verificarsi una ricaduta dell’ipertiroidismo. Gli ATM bloccano la reazione di accoppiamento tra monoiodotirosina e diiodotirosina per produrre T4 e T3, impedendo così efficacemente la sintesi dell’ormone tiroideo.9,11 Inoltre, il PTU, ma non l’MMI, inibisce la conversione periferica di T4 in T3.9 Le dosi iniziali orali di PTU vanno da 300 a 600 mg al giorno (dose massima giornaliera = 1.200 mg). Le dosi orali iniziali di MMI, che è 10 volte più potente del PTU, variano tra 30 e 60 mg al giorno (dose massima giornaliera = 120 mg).9,11,13 Anche se questi farmaci sono tradizionalmente divisi in tre o quattro dosi giornaliere, possono essere somministrati come dosi singole.9 Il miglioramento clinico è di solito osservato dopo 4-8 settimane, a quel punto la dose dovrebbe essere ridotta secondo un programma mensile.9 Le dosi orali tipiche di mantenimento per ciascun agente sono da 50 a 300 mg per il PTU e da 5 a 30 mg per l’MMI. Il trattamento dovrebbe essere continuato per 12-24 mesi se l’obiettivo è quello di ottenere una remissione per tutta la vita.9,11,13
Le MMI possono essere usate prima o dopo la RIT come trattamento supplementare. Gli effetti avversi di entrambi i farmaci includono rash, dolori articolari, insufficienza epatica e una diminuzione dei globuli bianchi che combattono la malattia. A causa del rischio di difetti alla nascita, l’MMI non è solitamente usato per trattare donne incinte nel primo trimestre. Il PTU può essere considerato il farmaco preferito appena prima e durante il primo trimestre di gravidanza. La FDA ha emesso un avviso di scatola nera sul PTU che indica la sua capacità di causare lesioni epatiche potenzialmente fatali o gravi e insufficienza epatica acuta negli adulti e nei pazienti pediatrici.18
Beta-Bloccanti: Questi farmaci non inibiscono la produzione di ormoni tiroidei, ma bloccano l’effetto degli ormoni sul corpo. Possono essere usati per dare sollievo a battiti cardiaci irregolari, tremori, ansia o irritabilità, intolleranza al calore, sudorazione, diarrea e debolezza muscolare. I beta-bloccanti comunemente usati includono propranololo, atenololo, metoprololo, lopressor e nadololo. Poiché i beta-bloccanti possono complicare la gestione dell’asma e del diabete, questi pazienti dovrebbero usare questi farmaci con cautela.5,11
Chirurgia: La chirurgia per rimuovere tutta o parte della tiroide (tiroidectomia o tiroidectomia subtotale) è anche un’opzione per il trattamento della malattia di Graves. Dopo la procedura, i pazienti avranno probabilmente bisogno di un trattamento per fornire al corpo quantità normali di ormone tiroideo. I rischi dell’intervento chirurgico includono potenziali danni alle corde vocali e alle ghiandole paratiroidi. Le ghiandole paratiroidi producono un ormone che controlla il livello di calcio nel sangue. Le complicazioni sono rare sotto la cura di un chirurgo esperto in chirurgia tiroidea.5,11
Trattamento dell’oftalmopatia di Graves
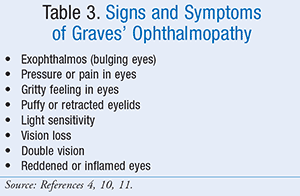
L’oftalmopatia di Graves può essere divisa in due fasi cliniche: la fase infiammatoria e la fase fibrotica.5 La fase infiammatoria è caratterizzata da edema e deposito di glicosaminoglicano nei muscoli extraoculari. Questo porta alle manifestazioni cliniche di gonfiore orbitale, sguardo, diplopia, edema periorbitale e, a volte, dolore. L’oftalmopatia di Graves non sempre migliora con il trattamento della malattia di Graves. I sintomi dell’oftalmopatia di Graves (TABELLA 3) possono anche peggiorare per 3-6 mesi. Dopo di che, i segni e i sintomi di solito si stabilizzano per un anno circa e poi cominciano a migliorare, spesso da soli. I sintomi lievi dell’oftalmopatia di Graves possono essere gestiti utilizzando lacrime artificiali OTC durante il giorno e gel lubrificanti di notte.5
Se i sintomi sono più gravi, il medico può raccomandare diversi trattamenti, tra cui corticosteroidi, chirurgia di decompressione orbitale, radioterapia orbitale e terapie non farmacologiche. Il trattamento con prednisone può essere necessario per ridurre il gonfiore dietro i bulbi oculari.11 Gli effetti avversi dei corticosteroidi includono ritenzione di liquidi, aumento di peso, livelli elevati di glucosio nel sangue, aumento della pressione sanguigna e cambiamenti di umore. La chirurgia di decompressione orbitale è una procedura che rimuove l’osso tra la cavità oculare (orbita) e i seni, gli spazi d’aria accanto all’orbita.11 Questo dà agli occhi spazio per tornare alla loro posizione originale. Questo trattamento è di solito utilizzato se la pressione sul nervo ottico minaccia la perdita della vista. Le possibili complicazioni includono la visione doppia. La radioterapia orbitale usa raggi X mirati nel corso di diversi giorni per distruggere parte del tessuto dietro gli occhi.2,11
Stile di vita e rimedi domestici: Mangiare bene e fare esercizio fisico può aumentare il miglioramento di alcuni sintomi durante il trattamento. Poiché la tiroide controlla il metabolismo, il paziente può avere la tendenza ad aumentare di peso quando l’ipertiroidismo viene corretto. Le ossa fragili possono anche verificarsi con la malattia di Graves, e gli esercizi di sollevamento pesi possono aiutare a mantenere la densità ossea.2,4,6
I pazienti possono applicare impacchi freschi ai loro occhi, come l’umidità aggiunta può essere calmante. Si dovrebbe anche consigliare ai pazienti di indossare occhiali da sole per ridurre la sensibilità ai raggi ultravioletti (UV) e alla luce intensa. Il collirio lubrificante può alleviare la sensazione di secchezza e graffio sulla superficie degli occhi. Un gel a base di paraffina, come Refresh Lacri-Lube, può essere applicato di notte. I pazienti dovrebbero sollevare la testa del loro letto. Tenere la testa più in alto rispetto al resto del corpo riduce l’accumulo di liquidi nella testa e può alleviare la pressione sugli occhi. Infine, i pazienti dovrebbero essere consigliati di non fumare, poiché il fumo peggiora l’oftalmopatia di Graves.
Trattamento della dermopatia di Graves
L’uso di creme o pomate OTC contenenti idrocortisone può aiutare ad alleviare il gonfiore e l’arrossamento. Inoltre, l’uso di impacchi di compressione sulle gambe può essere utile.5,11
Conclusione
La farmacoterapia per la malattia di Graves è complessa ma gestibile. Poiché il risultato desiderato dei farmaci antitiroidei è quello di distruggere la ghiandola tiroidea e causare uno stato ipotiroideo, i pazienti richiederanno un continuo monitoraggio clinico, consulenza (TABELLA 4), e la sostituzione della tiroide per tutta la vita con ormone tiroideo.

1. Ellis H. Robert Graves: 1796-1852. Br J Hosp Med (Lond). 2006;67(6):313.
2. Yeung SJ. Malattia di Graves. Panoramica. Medcape. 18 novembre 2015. http://emedicine.medscape.com/article/120619-overview. Accesso 8 marzo 2016.
3. Garber JR, Cobin RH, Gharib H, et al. Linee guida di pratica clinica per ipotiroidismo negli adulti: cosponsorizzato dalla American Association of Clinical Endocrinologists e la American Thyroid Association. Pratica Endocr. 2012;18(6):988-1028.
4. Malattia di Graves. MedlinePlus. 21 aprile 2015. www.nlm.nih.gov/medlineplus/ency/article/000358.htm. Accessed March 8, 2016.
5. Cockerham KP, Chan SS. Malattia degli occhi della tiroide. Neurol Clin. 2010;28:729-755.
6. Yeung SJ. Malattia di Graves. Epidemiologia. Medcape. 18 novembre 2015. http://emedicine.medscape.com/article/120619-overview#a6. Accessed March 8, 2016.
7. Woeber KA. Aggiornamento sulla gestione di ipertiroidismo e ipotiroidismo. Arch Fam Med. 2007;9(8):743-747.
8. Malattia di Graves. Fattori di rischio. Mayo Clinic. www.mayoclinic.org/diseases-conditions/graves-disease/basics/risk-factors/con-20025811. Accesso 8 marzo 2016.
9. Yeung SJ. Malattia di Graves. Contesto. Medcape. 18 novembre 2015. http://emedicine.medscape.com/article/120619-overview#a4. Accesso 8 marzo 2016.
10. Yeung SJ. Malattia di Graves. Fisiopatologia. Medcape. 18 novembre 2015. http://emedicine.medscape.com/article/120619-overview#a5. Accessed March 8, 2016.
11. Yeung SJ. Trattamento della malattia di Graves & gestione. 18 novembre 2015. http://emedicine.medscape.com/article/120619-treatment. Accessed March 8, 2016.
12. Nayak B, Burman K. Tireotossicosi e tempesta tiroidea. Endcrinol Metab Clin North Am. 2006;35(4):663-686.
13. Mandel SJ, Larsen PR, Davies TF. Tireotossicosi. In: Melmed S, Polonsky KS, Larsen PR, Kronenberg HM, eds. Williams Textbook of Endocrinology. 12° ed. Philadelphia, PA: Elsevier Saunders; 2011:362-405.
14. Bhattacharyya A, Wiles PG. Crisi tireotossica che si presenta come addome acuto. 1997;90(12):681-682.
15. Bahn RS, Burch HB, Cooper DS, et al. Ipertiroidismo e altre cause di tireotossicosi: linee guida di gestione della American Thyroid Association e American Association of Clinical Endocrinologists. Endocr Pract. 2011;17(3):456-520.
16. McDermott MT, Kidd GS, Dodson LE, et al. Tempesta tiroidea indotta da radioiodio. Rapporto di caso e revisione della letteratura. Am J Med. 1983;75(2):353-359.
17. Read CH Jr, Tansey MJ, Menda Y. 36 anni di analisi retrospettiva dell’efficacia e della sicurezza dello iodio radioattivo nel trattamento dei giovani pazienti di Graves. J Clin Endocrinol Metab. 2004;89(9):4229-4233.
18. FDA Drug Safety Communication. Nuovo avvertimento in scatola su gravi lesioni al fegato con propiltiouracile. 21 aprile 2010. www.fda.gov/Drugs/DrugSafety/PostmarketDrugSafetyInformationforPatientsandProviders/ucm209023.htm. Accessed March 8, 2016.