Cosa sono gli enzimi e cosa fanno nel nostro corpo? Gli enzimi sono fondamentalmente proteine prodotte dagli organismi viventi per realizzare certe reazioni metaboliche e biochimiche nel corpo. Sono catalizzatori biologici che accelerano le reazioni all’interno del corpo. Scopriamo di più su di loro.
- Video suggerito:
- Qual è la struttura degli enzimi?
- Sfogliate altri argomenti sotto Biomolecole
- Tipi di enzimi:
- Come funzionano gli enzimi?
- Teoria 1: Ipotesi della serratura e della chiave
- Teoria 2: Ipotesi di adattamento indotto
- Quali fattori influenzano l’attività enzimatica nella cellula?
- Esempio risolto per te
Video suggerito:
Qual è la struttura degli enzimi?
Gli enzimi, come già detto, sono catalizzatori biologici. Mentre affrettano o accelerano un processo, in realtà stanno fornendo un percorso alternativo per il processo. Ma, nel processo, la struttura o la composizione degli enzimi rimane inalterata.
Gli enzimi sono effettivamente costituiti da migliaia di aminoacidi che sono collegati in modo specifico per formare diversi enzimi. Le catene enzimatiche si piegano per formare forme uniche e sono queste forme che forniscono all’enzima il suo caratteristico potenziale chimico. La maggior parte degli enzimi contiene anche un componente non proteico noto come cofattore.
Sfogliate altri argomenti sotto Biomolecole
- Biomacromolecole
- Monomeri di legame
- Enzimi
- Base metabolica per vivere
- Acidi nucleici
- Polisaccaridi
- Proteine
Tipi di enzimi:
Le reazioni biochimiche che avvengono nel corpo sono fondamentalmente di 6 tipi e gli enzimi che realizzano queste reazioni sono chiamati di conseguenza:
- Ossidoreduttasi: Questi enzimi portano a reazioni di ossidazione e riduzione e quindi sono chiamati ossidoreduttasi. In queste reazioni, vengono trasferiti elettroni sotto forma di ioni idruro o atomi di idrogeno. Quando un substrato viene ossidato, questi enzimi agiscono come donatori di idrogeno. Questi enzimi sono chiamati deidrogenasi o reduttasi. Quando l’atomo di ossigeno è l’accettore, questi enzimi sono chiamati ossidasi.
- Transferasi: Questi enzimi sono responsabili del trasferimento di gruppi funzionali da una molecola all’altra. Esempio: l’alanina aminotransferasi che trasferisce il gruppo alfa-ammino tra l’alanina e l’aspartato ecc. Alcune transferasi trasferiscono anche gruppi fosfato tra ATP e altri composti, residui di zucchero per formare disaccaridi come l’esochinasi nella glicolisi.
- Idrolasi: Questi enzimi catalizzano reazioni che coinvolgono il processo di idrolisi. Alcune idrolasi funzionano come enzimi digestivi perché rompono i legami peptidici nelle proteine. Le idrolasi possono anche essere un tipo di transferasi perché trasferiscono la molecola d’acqua da un composto all’altro. Esempio: Glucosio-6-fosfatasi che rimuove il gruppo fosfato dal glucosio-6-fosfato, lasciando glucosio e H3PO4.
- Lasi: Questi enzimi catalizzano reazioni in cui i gruppi funzionali sono aggiunti per rompere i doppi legami nelle molecole o in cui i doppi legami sono formati dalla rimozione di gruppi funzionali. Esempio: La piruvato decarbossilasi è una liasi che rimuove la CO2 dal piruvato. Altri esempi includono deaminasi e deidratasi.
- Isomerasi: Questi enzimi catalizzano le reazioni in cui un gruppo funzionale viene spostato in un’altra posizione all’interno della stessa molecola in modo che la molecola risultante sia effettivamente un isomero della molecola precedente. Esempio: triosefosfato isomerasi e fosfoglucosio isomerasi per convertire il glucosio 6-fosfato in fruttosio 6-fosfato.
- Ligasi: Questi enzimi svolgono una funzione opposta a quella delle idrolasi. Mentre le idrolasi rompono i legami aggiungendo acqua, le ligasi formano legami rimuovendo il componente acqua. Esistono diverse sottoclassi di ligasi che implicano la sintesi di ATP.
Come funzionano gli enzimi?
Per qualsiasi reazione che avvenga nell’universo, c’è una richiesta di energia. Nei casi in cui non c’è energia di attivazione, un catalizzatore gioca un ruolo importante per ridurre l’energia di attivazione e portare avanti la reazione. Questo funziona anche negli animali e nelle piante. Gli enzimi aiutano a ridurre l’energia di attivazione delle molecole complesse nella reazione. I seguenti passi semplificano come un enzima lavora per accelerare una reazione:
Passo 1: Ogni enzima ha un ‘sito attivo’ che è dove una delle molecole di substrato può legarsi. Così, si forma un complesso enzima-substrato.
Step 2: Questa molecola enzima-substrato reagisce ora con il secondo substrato per formare il prodotto e l’enzima viene liberato come secondo prodotto.
Ci sono molte teorie che spiegano come funzionano gli enzimi. Ma ci sono due teorie importanti che discuteremo qui.
Teoria 1: Ipotesi della serratura e della chiave
Questa è la più accettata delle teorie dell’azione enzimatica.

Questa teoria afferma che il substrato si adatta esattamente al sito attivo dell’enzima per formare un complesso enzima-substrato. Questo modello descrive anche perché gli enzimi sono così specifici nella loro azione, perché sono specifici per le molecole di substrato.
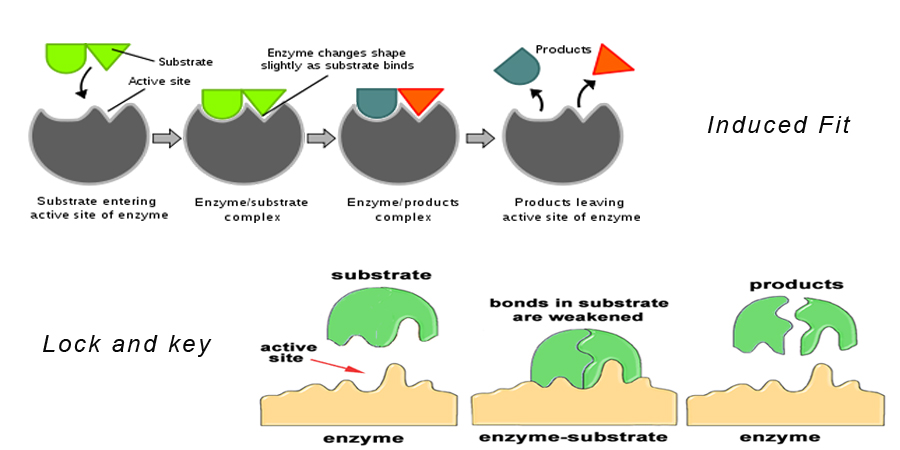
Teoria 2: Ipotesi di adattamento indotto
Questa è simile all’ipotesi della serratura e della chiave. Dice che la forma della molecola dell’enzima cambia quando si avvicina alla molecola del substrato in modo tale che la molecola del substrato si adatti esattamente al sito attivo dell’enzima.
Quali fattori influenzano l’attività enzimatica nella cellula?
- Concentrazione di enzimi e substrati: Il tasso di reazione aumenta con l’aumentare della concentrazione del substrato fino a un punto, oltre il quale ogni ulteriore aumento della concentrazione del substrato non produce alcun cambiamento significativo nel tasso di reazione. Questo accade perché dopo una certa concentrazione del substrato, tutti i siti attivi sull’enzima sono pieni e non può avvenire nessuna ulteriore reazione.
- Temperatura: Con l’aumento della temperatura, l’attività dell’enzima aumenta a causa dell’aumento dell’energia cinetica delle molecole. C’è un livello ottimale quando gli enzimi lavorano al meglio e al massimo. Questa temperatura è spesso la normale temperatura corporea del corpo. Quando la temperatura aumenta oltre un certo limite, gli enzimi, che sono in realtà costituiti da proteine, cominciano a disintegrarsi e il tasso di reazione rallenta.
- pH: Gli enzimi sono molto sensibili ai cambiamenti del pH e lavorano in una finestra molto piccola di livelli di pH ammissibili. Al di sotto o al di sopra del livello di pH ottimale, c’è il rischio che gli enzimi si disintegrino e quindi la reazione rallenti.
- Inibitori: Presenza di alcune sostanze che inibiscono l’azione di un particolare enzima. Questo accade quando la sostanza inibitrice si attacca al sito attivo dell’enzima impedendo così l’attacco del substrato e rallentando il processo.
Esempio risolto per te
Q: Un enzima agisce?
a. Aumentando l’energia di attivazione
b. Diminuendo l’energia di attivazione
c. Diminuendo il pH
d. Aumento del pH
Sol: a. Aumento dell’energia di attivazione
I reagenti non subiscono un cambiamento chimico automaticamente. Lo fanno nello stato di transizione. Lo stato di transizione ha più energia libera dei reagenti o dei prodotti. L’incapacità dei reagenti di subire un cambiamento a causa della richiesta di energia extra per convertirli allo stato di transizione è chiamata “barriera energetica”. L’energia richiesta per superare la barriera energetica è chiamata ‘Energia di attivazione’.