La fibrillazione atriale (FA) è la più frequente tachiaritmia sostenuta, che si verifica nell’1% al 2% della popolazione generale. L’isolamento della vena polmonare (PVI) è il pilastro dell’ablazione della FA.1 Sebbene questa procedura sia efficace nel prevenire la ricorrenza dell’aritmia nei pazienti con FA parossistica, se eseguita da sola, ha solo un successo limitato nella FA persistente.1,2 I dati iniziali hanno suggerito che la ricorrenza dell’aritmia potrebbe essere diminuita dall’ablazione aggiuntiva della linea o dall’ablazione dell’elettrogramma atriale frazionato complesso. Tuttavia, il beneficio di un’ablazione aggiuntiva oltre la PVI non è stato confermato dai recenti risultati delle meta-analisi3 e degli studi randomizzati controllati,4 sottolineando l’importanza di una PVI duratura, anche nella FA persistente.
Negli ultimi anni, l’ablazione con crioballoon è diventata un valido approccio alternativo all’ablazione con radiofrequenza (RF) e ha dimostrato di essere almeno altrettanto efficace della PVI nei pazienti con FA parossistica. I recenti risultati dello studio FIRE & ICE hanno definitivamente risolto il dibattito in questo campo.5 Inoltre, a causa della relativa semplicità, della curva di apprendimento più rapida -e forse ancora più importante- della notevole riproducibilità6 di questa procedura, essa è stata ampiamente adottata nella pratica clinica.6
D’altra parte, il trattamento interventistico della FA persistente rimane impegnativo: questo approccio non è stato standardizzato o perfezionato e c’è spazio per l’innovazione. In questo contesto, la questione di un possibile ruolo della crioablazione è interessante.
EVIDENZA CLINICA
Anche se c’è un interesse crescente per l’efficacia dell’ablazione della FA nei pazienti con FA persistente, i dati di follow-up dopo l’uso del nuovo catetere con crioballoon di seconda generazione da 28 mm (Arctic Front Advance, Medtronic Inc., Minneapolis, MN) sono ancora limitati. Ad oggi, i risultati dell’ablazione post-cryoballoon nella FA persistente sono stati valutati indirettamente da meta-analisi, confronti non randomizzati,7 e studi osservazionali.8-10
Ciconte et al.9 hanno riportato che il 60% dei pazienti con FA persistente era libero da tachiaritmia atriale dopo il trattamento con il nuovo catetere cryoballoon. La durata della FA persistente, che era un predittore indipendente di recidiva dell’aritmia durante il follow-up, fornisce un chiaro supporto all’ablazione nelle fasi più precoci della malattia.
In uno studio retrospettivo di 48 pazienti con FA persistente, il tasso di successo clinico a 1 anno era del 69%.10
Un altro studio a braccio singolo ha valutato l’efficacia della crioablazione di seconda generazione in un gruppo di 100 pazienti con FA persistente come procedura di indice (durata media 5,5 ± 3,7 mesi).8 Dopo un follow-up medio di 10,6 ± 6,3 mesi, non ci sono state recidive di tachiaritmia atriale nel 67% dei pazienti dopo un periodo di sospensione di 3 mesi. L’unico predittore indipendente significativo di recidiva era la comparsa di tachiaritmia atriale durante il periodo di sospensione.
Anche uno studio monocentrico, nonprospettico e non randomizzato ha valutato la radiofrequenza rispetto alla crioablazione solo in pazienti con FA persistente.7 In quello studio, l’esito procedurale dell’ablazione a radiofrequenza (utilizzando un catetere per ablazione a forza di contatto) rispetto alla crioablazione (utilizzando il crioballoon di seconda generazione da 28 mm) è stato valutato in una coorte di 100 pazienti con FA persistente refrattaria ai farmaci (la durata media della FA era di 7,2 e 7,6 mesi, rispettivamente, nei gruppi di ablazione a radiofrequenza e crioablazione). Sia i tempi della procedura che della fluoroscopia erano significativamente più brevi nel gruppo di crioablazione, ma il tasso di pazienti liberi da aritmie atriali era simile tra i 2 gruppi dopo 12 mesi di follow-up (60% nella crioablazione vs 56% nei gruppi di ablazione RF, P = .71). All’analisi multivariata, gli unici predittori indipendenti di fallimento sono stati trovati ancora una volta la durata della FA persistente e le recidive durante il periodo di sospensione.
Infine, uno studio prospettico, multicentrico, non randomizzato ha confrontato i risultati dopo una singola procedura di ablazione, utilizzando l’ablazione con crioballoon di prima generazione per il solo PVI vs ablazione a radiofrequenza aperta attraverso un approccio graduale in una coorte di pazienti con FA persistente abbinati per propensione.11 I risultati, che mostrano circa il 55% di libertà dalle aritmie atriali durante un follow-up medio di 15,6 ± 11,5 mesi dopo una singola ablazione, sia con il crioballoon che con la RF, erano simili ai dati disponibili. Diversi risultati sono stati degni di nota:
- –
In primo luogo, i risultati clinici erano simili nei 2 bracci di trattamento, anche se il gruppo RF è stato sottoposto a un’ablazione aggiuntiva e più estesa oltre il PVI.
- –
In secondo luogo, il tasso di complicazioni era simile con le 2 tecniche.
- –
In terzo luogo, la durata della procedura era più breve con la crioablazione.
C’è ancora incertezza sulla fisiopatologia e sulla strategia ottimale per l’ablazione della FA persistente, e quindi il pilastro di questa terapia rimane il raggiungimento di un PVI durevole.4 Per ottenere ciò, la crioablazione sembra essere un valido approccio terapeutico alternativo alla RF. L’esecuzione di un’ablazione aggiuntiva sopra il PVI è associata a tempi procedurali più lunghi.4 Poiché l’approccio all’ablazione con RF non è stato standardizzato (la maggior parte dei pazienti nel braccio RF ha sviluppato lesioni aggiuntive), non è chiaro se i risultati siano dovuti alla fonte di energia o alla strategia di ablazione. Inoltre, i risultati a medio termine non sembrano essere significativamente migliorati da lesioni biatriali aggiuntive oltre al PVI nei pazienti con FA persistente.4
SHOOTING AT THE RIGHT TARGET?
Le ragioni della mancanza di un beneficio maggiore da ablazioni aggiuntive rimangono da chiarire. Una possibilità è il potenziale iatrogeno di un approccio al substrato con un’ablazione più estesa, che può favorire lo sviluppo di nuove aree di aritmogenesi a causa di tessuto non completamente ablato o linee incomplete di blocco della conduzione. Un’altra possibilità è che l’area colpevole non sia identificata di routine e che né gli elettrogrammi atriali frazionati complessi né le lesioni lineari siano gli obiettivi complementari ottimali per l’ablazione.12 In questa ipotesi, rimane la necessità di individuare l’occhio del ciclone (mirando ai rotori o ai gangli),13 eventualmente attraverso l’uso di algoritmi di mappatura più recenti. I dati disponibili forniscono anche un sostegno al ruolo della durata della FA, e di conseguenza al rimodellamento elettrico della FA (la FA genera la FA), perché solo la durata della FA era un predittore indipendente della ricorrenza dell’aritmia nel confronto con il propensity-score,11 come precedentemente riportato da Tilz et al.2
Diversi studi in corso contribuiranno a chiarire la sicurezza e l’efficacia della crioablazione nei pazienti con FA persistente. Lo studio Cryoballoon Ablation for Early Persistent Atrial Fibrillation (Cryo4 Persistent AF – NCT02213731) è uno studio pilota europeo multicentrico, prospettico, a braccio singolo, che mira a valutare il tasso di successo della PVI solo mediante crioablazione a 1 anno in pazienti che presentano una storia di FA persistente inferiore a 12 mesi. Questo studio è ancora in fase di reclutamento e i primi risultati sono attesi per la fine del 2017. Il prossimo obiettivo sarà quello di confrontare i risultati in uno studio randomizzato tra l’approccio RF stepwise e la crioablazione PVI in un gruppo omogeneo di pazienti con FA persistente. I risultati di questo studio randomizzato su larga scala sono attesi con impazienza.
STRENGTHS AND LIMITATIONS
Nei pazienti con FA persistente, anche i diametri massimi PV più elevati (tra 20mm e 23mm) sono sostanzialmente inferiori al valore critico di 28mm (il diametro massimo del crioballoon utilizzato nella pratica clinica di routine).14 A causa di questa discrepanza tra i diametri del palloncino e delle PV, quando questo dispositivo è posizionato contro l’antrum PV, la sua parte di raffreddamento è in contatto sia con l’antra PV che con il tessuto atriale adiacente, il che sembra essere un importante vantaggio di questa procedura. Kenigsberg et al.,15 hanno calcolato l’area del tessuto cardiaco ablato dopo la crioablazione della PV mediante la mappatura elettroanatomica tridimensionale del voltaggio dell’atrio sinistro dopo la crioablazione. Utilizzando questo metodo, questi autori hanno ben dimostrato che, dopo la crioablazione con il dispositivo cryoballoon di 28 mm, la percentuale della superficie della parete posteriore dell’atrio sinistro che è rimasta elettricamente intatta era solo il 27%.
Da notare, anche se il cryoballoon concettualmente mira solo le PV, esegue anche sostanziale debulking elettrico della parete posteriore dell’atrio sinistro (Figura). Estendendo la circonferenza dell’area di raffreddamento, questo dispositivo può conferire un beneficio collaterale ablando i contribuenti locali alle strutture che contribuiscono a innescare e mantenere la FA, come i plessi gangliari e i rotori, che forse ha importanti implicazioni terapeutiche per i pazienti con FA persistente.13 Questa caratteristica potrebbe anche spiegare, almeno in parte, i risultati degli studi sopra menzionati.
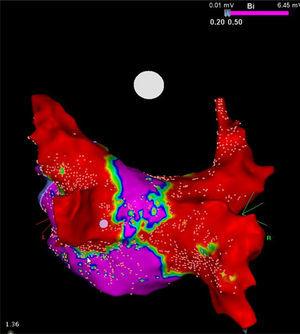
Mappa di tensione ad alta densità della parete posteriore dopo una procedura di crioablazione in un paziente con fibrillazione atriale persistente. Si noti lo stretto corridoio (viola) che rimane tra entrambe le grandi cicatrici (rosse) ottenute con il crioballoon Artic Front Advance da 28 mm (Medtronic, Minneapolis, MN, Stati Uniti). Per gentile concessione del Prof. Mario Oliveira, Ospedale Santa Marta, Lisbona, Portogallo.
Anche se i tassi di successo della crioballina sono paragonabili a quelli della RF in studi non randomizzati su pazienti con FA persistente, il tasso relativamente alto di ricorrenza dell’aritmia in entrambi i gruppi rimane inspiegabile e potrebbe non essere attribuibile solo al recupero della conduzione delle PV. Questa possibilità è stata menzionata negli studi che sollevano preoccupazioni sul ruolo delle fonti non-PVI che forniscono il meccanismo per la ricaduta.9
Nella FA persistente, il trattamento invasivo rimane impegnativo a causa della sua diversa fisiopatologia. Sono necessari nuovi approfondimenti meccanicistici per consentire un approccio personalizzato alla FA persistente ma, finché non saranno disponibili tali conoscenze, la PVI autonoma di prima intenzione può essere sufficiente, almeno per i pazienti con FA persistente meno grave. Sulla base di questo approccio “meno è più”, cryoballoon PVI può dimostrare di essere una strategia di ablazione adeguata nella FA persistente, permettendo PVI affidabile con debulking adiacente del miocardio atriale vicino. Ulteriori modifiche del substrato non sembrano fornire ulteriori benefici. Questa procedura “minimalista” è una prima opzione accettabile nei pazienti che presentano una storia relativamente recente di FA persistente sintomatica, cioè con “più trigger che substrato” (o con un substrato concentrato intorno agli ostia PVs…). In effetti, il grande (28 mm) crioballoon di seconda generazione fornisce risultati simili a quelli di procedure più complesse che utilizzano energia RF e metodi sofisticati. Da notare che la curva di apprendimento, la riproducibilità e la sicurezza sembrano essere a favore del dispositivo cryoballoon nelle mani meno esperte. In questo contesto, e nel sottogruppo di pazienti di cui sopra, il PVI con il grande crioballoon di seconda generazione sembra essere un approccio iniziale ragionevole, fornendo un miglioramento significativo per più della metà dei candidati. Per i pazienti con recidive di FA, questa prima procedura non sarà inutile. Infatti, in una quantità considerevole di substrato (che circonda l’antra PV destra e sinistra) che è già stato trattato, la seconda procedura, con RF questa volta, si concentrerà principalmente sui focolai extra-PVs, potenziali frammentati, circuiti micro- o macroreentranti ecc.
A nostro parere, questa strategia in 2 fasi è compatibile con l’impiego di centri a basso e medio volume che si concentrano principalmente sulle PVIs, e lavorano fianco a fianco con centri di riferimento terziari che eseguono le procedure più complesse. Questi ultimi dovranno occuparsi del 40% circa di pazienti che hanno recidive dopo il primo “crio-debolimento”.
“Meno è più”, ma non è ancora abbastanza…
CONFLITTI DI INTERESSE
S. Boveda riceve parcelle di consulenza da Medtronic, Boston Scientific e Livanova.
.