- Tabella delle geometrie
- OBIETTIVI DI APPRENDIMENTO
- PUNTI CHIAVE
- Punti chiave
- Termini chiave
- Modello VSEPR
- Geometrie molecolari
- Come determinare la geometria molecolare – YouTube: Questo video descrive un metodo per trovare rapidamente le forme geometriche principali per le molecole semplici.
- Geometrie molecolari
- OBIETTIVI DI APPRENDIMENTO
- Punti chiave
- Punti chiave
- Termini chiave
- Metodo AXE
- Geometrie principali (senza coppie solitarie di elettroni):
- Planare trigonale
- Tetraedrico
- Ottaedrico
- Interattivo: Geometria degli elettroni: Le molecole assumono forme diverse a causa dei modelli di elettroni condivisi e non condivisi. In questi esempi tutti gli elettroni che influenzano la forma delle molecole sono condivisi nei legami covalenti che tengono insieme gli atomi per formare le molecole.
- Coppie di elettroni soli
- OBIETTIVI DI APPRENDIMENTO
- PUNTI CHIAVE
- Punti chiave
- Termini chiave
- Geometrie molecolari con elettroni di coppia solitaria
- Numero di coordinazione e atomo centrale
- L’effetto repulsivo degli elettroni della coppia solitaria
- Interattivo: Elettroni non condivisi e la forma “piegata”: Usa il modello 3D per vedere come gli elettroni non condivisi respingono quelli condivisi nei legami tra idrogeno e ossigeno, facendo sì che la molecola abbia una forma “piegata”.
- LICENZE E ATTRIBUZIONI
- CC LICENSED CONTENT, SHARED PREVIOUSLY
- CC LICENSED CONTENT, SPECIFIC ATTRIBUTION
Tabella delle geometrie
La teoria VSEPR determina le geometrie molecolari (lineare, trigonale, trigonale bipiramidale, tetraedrica e ottaedrica).
OBIETTIVI DI APPRENDIMENTO
Applica il modello VSEPR per determinare la geometria di una molecola che non contiene coppie solitarie di elettroni sull’atomo centrale.
PUNTI CHIAVE
Punti chiave
- Fondamentalmente, il modello VSEPR teorizza che le regioni di carica elettrica negativa si respingono a vicenda, facendo sì che esse (e i legami chimici che formano) stiano il più lontano possibile.
- Le geometrie molecolari prendono in considerazione il numero di atomi e il numero di elettroni di coppia solitaria.
- Le principali geometrie senza elettroni di coppia solitaria sono: lineare, trigonale, tetraedrica, bipiramidale trigonale e ottaedrica.
Termini chiave
- Teoria VSEPR: un modello chimico usato per predire la forma delle singole molecole basato sulla repulsione elettrostatica delle coppie di elettroni
Modello VSEPR
Il modello VSEPR (valence shell electron pair repulsion) si concentra sulle coppie di elettroni leganti e non leganti presenti nel guscio più esterno (valenza) di un atomo che si collega con due o più altri atomi.
Fondamentalmente, il modello VSEPR teorizza che queste regioni di carica elettrica negativa si respingono a vicenda, inducendo loro (e i legami chimici che formano) a stare il più lontano possibile. Pertanto, le due nuvole di elettroni contenute in una semplice molecola triatomica ![]() si estenderanno in direzioni opposte. Una separazione angolare di 180° pone i due orbitali di legame il più lontano possibile l’uno dall’altro; ci aspettiamo quindi che i due legami chimici si estendano in direzioni opposte, producendo una molecola lineare.
si estenderanno in direzioni opposte. Una separazione angolare di 180° pone i due orbitali di legame il più lontano possibile l’uno dall’altro; ci aspettiamo quindi che i due legami chimici si estendano in direzioni opposte, producendo una molecola lineare.

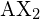 . I due atomi X (in bianco) sono a 180° l’uno dall’altro.
. I due atomi X (in bianco) sono a 180° l’uno dall’altro.Se l’atomo centrale contiene anche una o più coppie di elettroni non legati, queste regioni aggiuntive di carica negativa si comporteranno come quelle associate agli atomi legati. Gli orbitali che contengono le varie coppie di legami e non legami nel guscio di valenza si estendono dall’atomo centrale in direzioni che minimizzano le loro repulsioni reciproche. Se l’atomo centrale possiede orbitali d parzialmente occupati, può essere in grado di ospitare cinque o sei coppie di elettroni, formando quello che a volte viene chiamato un “ottetto espanso”.
Geometrie molecolari
Le geometrie molecolari (lineare, trigonale, tetraedrica, trigonale bipiramidale e ottaedrica) sono determinate dalla teoria VSEPR. Una tabella di geometrie utilizzando la teoria VSEPR può facilitare il disegno e la comprensione delle molecole. La tabella delle geometrie molecolari si trova nella prima figura. La seconda figura serve come aiuto visivo per la tabella.


Come determinare la geometria molecolare – YouTube: Questo video descrive un metodo per trovare rapidamente le forme geometriche principali per le molecole semplici.
Geometrie molecolari
La teoria VSEPR descrive cinque forme principali di molecole semplici: lineare, trigonale planare, tetraedrica, trigonale bipiramidale e ottaedrica.
OBIETTIVI DI APPRENDIMENTO
Applica il modello VSEPR per determinare la geometria delle molecole in cui l’atomo centrale contiene una o più coppie solitarie di elettroni.
Punti chiave
Punti chiave
- Lineare: una molecola triatomica semplice del tipo
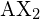 ; i suoi due orbitali di legame sono distanti 180°.
; i suoi due orbitali di legame sono distanti 180°. - Trigonale planare: triangolare e in un piano, con angoli di legame di 120°.
- Tetraedrico: quattro legami su un atomo centrale con angoli di legame di 109,5°.
- Bipiramidale trigonale: cinque atomi attorno all’atomo centrale; tre in un piano con angoli di legame di 120° e due alle estremità opposte della molecola.
- Ottaedrico: sei atomi attorno all’atomo centrale, tutti con angoli di legame di 90°.
Termini chiave
- Teoria VSEPR: il modello Valence Shell Electron Pair Repulsion (VSEPR) è usato per predire la forma delle singole molecole in base all’estensione della repulsione elettrostatica elettrone-coppia
Metodo AXE
Un altro modo di guardare alle geometrie molecolari è attraverso il “metodo AXE” di conteggio degli elettroni. A in AXE rappresenta l’atomo centrale e ha sempre un pedice implicito uno; X rappresenta il numero di legami sigma tra l’atomo centrale e quello esterno (i legami covalenti multipli – doppi, tripli, ecc. – contano come una X); ed E rappresenta il numero di coppie di elettroni solitari che circondano l’atomo centrale. La somma di X ed E, nota come numero sterico, è anche associata al numero totale di orbitali ibridati usati dalla teoria del legame di valenza. VSEPR usa il numero sterico e la distribuzione di X ed E per prevedere le forme geometriche molecolari.

Nota che le geometrie sono nominate solo in base alle posizioni atomiche, non alla disposizione degli elettroni.

Geometrie principali (senza coppie solitarie di elettroni):
In un modello lineare, gli atomi sono collegati in linea retta, e un angolo di legame è semplicemente l’angolo geometrico tra due legami adiacenti. Una molecola triatomica semplice del tipo ![]() ha i suoi due orbitali di legame a 180°. Esempi di molecole triatomiche per le quali la teoria VSEPR predice una forma lineare includono
ha i suoi due orbitali di legame a 180°. Esempi di molecole triatomiche per le quali la teoria VSEPR predice una forma lineare includono ![]() (che non possiede abbastanza elettroni per conformarsi alla regola dell’ottetto) e
(che non possiede abbastanza elettroni per conformarsi alla regola dell’ottetto) e ![]() . Quando si scrive la formula del punto di elettroni per l’anidride carbonica, si noti che i legami C-O sono doppi; questo non fa differenza per la teoria VSEPR. L’atomo di carbonio centrale è ancora unito ad altri due atomi. Le nuvole di elettroni che collegano i due atomi di ossigeno sono distanti 180°.
. Quando si scrive la formula del punto di elettroni per l’anidride carbonica, si noti che i legami C-O sono doppi; questo non fa differenza per la teoria VSEPR. L’atomo di carbonio centrale è ancora unito ad altri due atomi. Le nuvole di elettroni che collegano i due atomi di ossigeno sono distanti 180°.

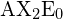 nella tabella.
nella tabella.Planare trigonale
Le molecole con la forma planare trigonale sono triangolari e in un piano, o superficie piatta. Una molecola ![]() come
come ![]() ha tre regioni di densità elettronica che si estendono dall’atomo centrale. La repulsione tra queste sarà minima quando l’angolo tra due qualsiasi è 120o.
ha tre regioni di densità elettronica che si estendono dall’atomo centrale. La repulsione tra queste sarà minima quando l’angolo tra due qualsiasi è 120o.
Tetraedrico
Tetra- significa quattro, e -hedral si riferisce ad una faccia di un solido; “tetraedrico” significa letteralmente “avere quattro facce”. “Questa forma si trova quando ci sono quattro legami tutti su un atomo centrale, senza coppie di elettroni solitari. In accordo con la teoria VSEPR, gli angoli di legame tra i legami elettronici sono 109,5o. Un esempio di molecola tetraedrica è il metano ![]() . I quattro legami equivalenti puntano in quattro direzioni geometricamente equivalenti in tre dimensioni, corrispondenti ai quattro angoli di un tetraedro centrato sull’atomo di carbonio.
. I quattro legami equivalenti puntano in quattro direzioni geometricamente equivalenti in tre dimensioni, corrispondenti ai quattro angoli di un tetraedro centrato sull’atomo di carbonio.

La forma bipiramidale trigonale si forma quando un atomo centrale è circondato da cinque atomi in una molecola. Nella geometria, tre atomi sono nello stesso piano con angoli di legame di 120°; gli altri due atomi sono alle estremità opposte della molecola. Alcuni elementi del gruppo 15 della tavola periodica formano composti del tipo ![]() ; esempi sono
; esempi sono ![]() e
e ![]() .
.

Ottaedrico
Octa- significa otto, e -hedral si riferisce ad una faccia di un solido, così “ottaedrico” significa letteralmente “avere otto facce”. Gli angoli di legame sono tutti di 90°, e proprio come quattro coppie di elettroni subiscono una repulsione minima quando sono diretti verso gli angoli di un tetraedro, sei coppie di elettroni cercano di puntare verso gli angoli di un ottaedro. Un esempio di molecola ottaedrica (![]() ) è l’esafluoruro di zolfo (
) è l’esafluoruro di zolfo (![]() ).
).
https://lab.concord.org/embeddable.html#interactives/jsmol/electron-geometry.json
Interattivo: Geometria degli elettroni: Le molecole assumono forme diverse a causa dei modelli di elettroni condivisi e non condivisi. In questi esempi tutti gli elettroni che influenzano la forma delle molecole sono condivisi nei legami covalenti che tengono insieme gli atomi per formare le molecole.
Coppie di elettroni soli
Gli elettroni non leganti sono in orbitali che occupano spazio, respingono gli altri orbitali, e cambiano la forma di una molecola.
OBIETTIVI DI APPRENDIMENTO
Riconoscere l’effetto delle coppie di elettroni solitari sulle geometrie delle molecole.
PUNTI CHIAVE
Punti chiave
- Gli orbitali che contengono le varie coppie di legame e non legame nel guscio di valenza si estendono dall’atomo centrale in direzioni che minimizzano le loro repulsioni.
- Un orbitale non legante non ha un nucleo atomico alla sua estremità per attirare la nuvola di elettroni verso di sé; la carica in un tale orbitale sarà quindi concentrata più vicino all’atomo centrale.
- Gli orbitali non leganti esercitano più repulsione su altri orbitali rispetto agli orbitali leganti.
Termini chiave
- numero di coordinazione: in chimica e cristallografia, il numero dei vicini di un atomo centrale in una molecola o in un cristallo
- coppia solitaria: un insieme di valenza di due elettroni che esiste senza legame o condivisione con altri atomi
Geometrie molecolari con elettroni di coppia solitaria
Finora, abbiamo discusso solo le geometrie senza coppie di elettroni solitari. Come avrete probabilmente notato nella tabella delle geometrie e nel metodo AXE, l’aggiunta di coppie solitarie cambia la forma di una molecola. Abbiamo detto prima che se l’atomo centrale contiene anche una o più coppie di elettroni non legati, queste regioni aggiuntive di carica negativa si comporteranno come quelle associate agli atomi legati. Gli orbitali che contengono le varie coppie di legame e non legame nel guscio di valenza si estenderanno dall’atomo centrale in direzioni che minimizzano le loro reciproche repulsioni.

Numero di coordinazione e atomo centrale
Il numero di coordinazione si riferisce al numero di coppie di elettroni che circondano un dato atomo, spesso indicato come atomo centrale. Le geometrie delle molecole con coppie solitarie saranno diverse da quelle senza coppie solitarie, perché la coppia solitaria appare come uno spazio vuoto in una molecola. Entrambe le classi di geometria prendono il nome dalle forme delle figure geometriche immaginarie (per lo più poligoni solidi regolari) che sarebbero centrate sull’atomo centrale e avrebbero una coppia di elettroni ad ogni vertice.
Nella molecola dell’acqua (![]() ), l’atomo centrale è
), l’atomo centrale è ![]() , e la formula del punto elettronico di Lewis prevede che ci siano due coppie di elettroni non leganti. L’atomo di ossigeno sarà quindi coordinato tetraedricamente, il che significa che si trova al centro del tetraedro. Due delle posizioni di coordinazione sono occupate dalle coppie di elettroni condivisi che costituiscono i legami O-H, e le altre due dalle coppie non leganti. Quindi, anche se l’atomo di ossigeno è coordinato tetraedricamente, la geometria di legame (forma) della molecola
, e la formula del punto elettronico di Lewis prevede che ci siano due coppie di elettroni non leganti. L’atomo di ossigeno sarà quindi coordinato tetraedricamente, il che significa che si trova al centro del tetraedro. Due delle posizioni di coordinazione sono occupate dalle coppie di elettroni condivisi che costituiscono i legami O-H, e le altre due dalle coppie non leganti. Quindi, anche se l’atomo di ossigeno è coordinato tetraedricamente, la geometria di legame (forma) della molecola ![]() è descritta come piegata.
è descritta come piegata.

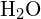 è descritta come piegata.
è descritta come piegata.L’effetto repulsivo degli elettroni della coppia solitaria
C’è un’importante differenza tra orbitali elettronici di legame e non. Poiché un orbitale non legante non ha un nucleo atomico alla sua estremità per attirare la nuvola di elettroni verso di sé, la carica in un tale orbitale sarà concentrata più vicino all’atomo centrale; di conseguenza, gli orbitali non leganti esercitano più repulsione su altri orbitali rispetto agli orbitali leganti. In ![]() , i due orbitali non leganti spingono gli orbitali leganti più vicini tra loro, rendendo l’angolo H-O-H di 104,5° invece dell’angolo tetraedrico di 109,5°.
, i due orbitali non leganti spingono gli orbitali leganti più vicini tra loro, rendendo l’angolo H-O-H di 104,5° invece dell’angolo tetraedrico di 109,5°.
La struttura a punto elettronico di ![]() pone una coppia di elettroni non leganti nel guscio di valenza dell’atomo di azoto. Questo significa che ci sono tre atomi legati e una coppia solitaria per un numero di coordinazione di quattro intorno all’azoto, lo stesso che si verifica in
pone una coppia di elettroni non leganti nel guscio di valenza dell’atomo di azoto. Questo significa che ci sono tre atomi legati e una coppia solitaria per un numero di coordinazione di quattro intorno all’azoto, lo stesso che si verifica in ![]() .
.

 : La coppia solitaria attaccata all’azoto centrale crea angoli di legame che differiscono dal tetraedrico di 109,5°.
: La coppia solitaria attaccata all’azoto centrale crea angoli di legame che differiscono dal tetraedrico di 109,5°.Possiamo quindi prevedere che i tre atomi di idrogeno si troveranno agli angoli di un tetraedro centrato sull’atomo di azoto. L’orbitale di coppia solitario punterà verso il quarto angolo del tetraedro, ma poiché quella posizione sarà libera, la molecola ![]() stessa non può essere tetraedrica; invece, assume una forma piramidale, più precisamente, quella di una piramide trigonale (una piramide a base triangolare). Gli atomi di idrogeno sono tutti nello stesso piano, con l’azoto fuori dal piano. Gli elettroni non leganti spingono gli orbitali leganti leggermente insieme, rendendo gli angoli di legame H-N-H circa 107°.
stessa non può essere tetraedrica; invece, assume una forma piramidale, più precisamente, quella di una piramide trigonale (una piramide a base triangolare). Gli atomi di idrogeno sono tutti nello stesso piano, con l’azoto fuori dal piano. Gli elettroni non leganti spingono gli orbitali leganti leggermente insieme, rendendo gli angoli di legame H-N-H circa 107°.
Nelle molecole a 5 coordinate che contengono coppie solitarie, questi orbitali non leganti (che sono più vicini all’atomo centrale e quindi hanno più probabilità di essere respinti da altri orbitali) risiederanno preferenzialmente nel piano equatoriale. Questo li metterà ad angoli di 90° rispetto a non più di due orbitali di legame orientati assialmente. Possiamo quindi prevedere che una molecola ![]() (una in cui l’atomo centrale A è coordinato ad altri quattro atomi X e ad una coppia di elettroni non leganti) come
(una in cui l’atomo centrale A è coordinato ad altri quattro atomi X e ad una coppia di elettroni non leganti) come ![]() avrà una forma ad “altalena”.
avrà una forma ad “altalena”.

Sostituendo coppie non leganti per atomi legati si riduce la coordinazione triangolare bipiramidale a forme molecolari ancora più semplici.
https://lab.concord.org/embeddable.html#interactives/jsmol/unshared-electrons.json
Interattivo: Elettroni non condivisi e la forma “piegata”: Usa il modello 3D per vedere come gli elettroni non condivisi respingono quelli condivisi nei legami tra idrogeno e ossigeno, facendo sì che la molecola abbia una forma “piegata”.
LICENZE E ATTRIBUZIONI
CC LICENSED CONTENT, SHARED PREVIOUSLY
- Cura e revisione. Fornito da: Boundless.com. Licenza: CC BY-SA: Attribution-ShareAlike
CC LICENSED CONTENT, SPECIFIC ATTRIBUTION
- VSEPR Theory. Fornito da: Wikipedia. Situato a: http://en.wikipedia.org/wiki/VSEPR_Theory. Licenza: CC BY-SA: Attribution-ShareAlike
- Geometria molecolare. Fornito da: Wikipedia. Situato a: http://en.wikipedia.org/wiki/Molecular_geometry. Licenza: CC BY-SA: Attribution-ShareAlike
- VSEPR Theory. Fornito da: Wikipedia. Situato a: http://en.wikipedia.org/wiki/VSEPR%20Theory. Licenza: CC BY-SA: Attribution-ShareAlike
- Geometria molecolare. Fornito da: Wikipedia. Situato a: http://en.wikipedia.org/wiki/Molecular_geometry. Licenza: Pubblico dominio: No Known Copyright
- geometrie VSEPR. Fornito da: Wikimedia. Situato a: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Licenza: CC BY-SA: Attribution-ShareAlike
- Come determinare la geometria molecolare – YouTube. Situato a: http://www.youtube.com/watch?v=pA9ML0HVOYE. Licenza: Pubblico dominio: No Known Copyright. Termini di licenza: Licenza standard YouTube
- Linear-3D-balls. Fornito da: Wikipedia. Situato a: http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Licenza: CC BY: Attribuzione
- Geometria molecolare. Fornito da: Wikipedia. Situato a: http://en.wikipedia.org/wiki/Molecular_geometry. Licenza: CC BY-SA: Attribution-ShareAlike
- VSEPR Theory. Fornito da: Wikipedia. Situato a: http://en.wikipedia.org/wiki/VSEPR_Theory. Licenza: CC BY-SA: Attribution-ShareAlike
- VSEPR Theory. Fornito da: Wikipedia. Situato a: http://en.wikipedia.org/wiki/VSEPR%20Theory. Licenza: CC BY-SA: Attribution-ShareAlike
- Geometria molecolare. Fornito da: Wikipedia. Situato a: http://en.wikipedia.org/wiki/Molecular_geometry. Licenza: Pubblico dominio: No Known Copyright
- geometrie VSEPR. Fornito da: Wikimedia. Situato a: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Licenza: CC BY-SA: Attribution-ShareAlike
- Come determinare la geometria molecolare – YouTube. Situato a: http://www.youtube.com/watch?v=pA9ML0HVOYE. Licenza: Pubblico dominio: No Known Copyright. Termini di licenza: Licenza standard YouTube
- Linear-3D-balls. Fornito da: Wikipedia. Situato a: http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Licenza: CC BY: Attribuzione
- Teoria VSEPR. Fornito da: Wikipedia. Situato a: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Licenza: Pubblico dominio: No Known Copyright
- VSEPR Theory. Fornito da: Wikipedia. Situato a: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Licenza: Pubblico dominio: No Known Copyright
- numero di coordinamento. Fornito da: Wiktionary. Situato a: http://en.wiktionary.org/wiki/coordination_number. Licenza: CC BY-SA: Attribution-ShareAlike
- John Hutchinson, Studi di sviluppo del concetto in chimica. 18 settembre 2013. Fornito da: OpenStax CNX. Situato a: http://cnx.org/content/m12594/latest/?collection=col10264/latest. Licenza: CC BY: Attribuzione
- Senza limiti. Fornito da: Boundless Learning. Situato a: http://www.boundless.com//chemistry/definition/lone-pair. Licenza: CC BY-SA: Attribution-ShareAlike
- Geometria molecolare. Fornito da: Wikipedia. Situato a: http://en.wikipedia.org/wiki/Molecular_geometry. Licenza: Pubblico dominio: No Known Copyright
- geometrie VSEPR. Fornito da: Wikimedia. Situato a: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Licenza: CC BY-SA: Attribution-ShareAlike
- Come determinare la geometria molecolare – YouTube. Situato a: http://www.youtube.com/watch?v=pA9ML0HVOYE. Licenza: Pubblico dominio: No Known Copyright. Termini di licenza: Licenza standard YouTube
- Linear-3D-balls. Fornito da: Wikipedia. Situato a: http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Licenza: CC BY: Attribuzione
- Teoria VSEPR. Fornito da: Wikipedia. Situato a: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Licenza: Pubblico dominio: No Known Copyright
- VSEPR Theory. Fornito da: Wikipedia. Situato a: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Licenza: Pubblico dominio: No Known Copyright
- VSEPR Theory. Fornito da: Wikipedia. Situato a: http://en.wikipedia.org/wiki/VSEPR_Theory. Licenza: Pubblico dominio: No Known Copyright
- Tetrahedral_Structure_of_Water.png. Fornito da: Wikimedia. Situato a: https://commons.wikimedia.org/wiki/File:Tetrahedral_Structure_of_Water.png. Licenza: Pubblico Dominio: No Known Copyright
un modello di chimica usato per predire la forma di molecole individuali basate sulla repulsione elettrostatica a coppie di elettroni.coppia di repulsione elettrostatica
il numero totale di atomi che confinano direttamente con un atomo centrale in una molecola o ione
due (una coppia di) elettroni di valenza che non sono usati per formare un legame covalente