Le interazioni tra cervello e processo di coagulazione hanno una lunga storia, compresa l’osservazione che il meccanismo di coagulazione all’interno del sistema nervoso centrale ha una serie di differenze da quello trovato in altri organi – l’endotelio del cervello esprime poca trombomodulina, per esempio.
Qualunque sia il meccanismo, è difficile evitare l’osservazione che il trattamento con anticoagulazione (per esempio, con eparina a basso peso molecolare) spesso inverte drammaticamente i sintomi, compresa l’emicrania, le difficoltà di memoria e la corea. Tali osservazioni suggeriscono che la patologia cerebrale in molti casi potrebbe non essere tanto l’infarto, ma potrebbe riguardare più il “fango” della fornitura di sangue e l’ossigenazione compromessa.
Migrania &Ictus
“Ha sofferto di mal di testa da adolescente?”
“Sì, dottore. Erano quasi settimanali per un certo periodo. Sono andati via per qualche anno, ma ora sono tornati con una vendetta. Sono presenti nella mia famiglia.”
Così parla la paziente trentenne con APS (i membri maschi della famiglia appaiono meno spesso nelle cliniche APS).
Questo è un indizio diagnostico così importante nella valutazione di un paziente con possibile APS. Eppure, nonostante i molti anni di esperienza di APS, ci sono sorprendentemente pochi dati che valutano il vero ruolo di APS nel mondo più ampio di emicrania. Ci sono così tante ragioni per studiare l’associazione – la risposta all’anticoagulazione – di solito buona, spesso sorprendente – lo studio dei fratelli e altri membri della famiglia di pazienti con emicrania/APS. E soprattutto, i legami che vengono ora riportati tra emicrania e ictus.
La sindrome di Hughes è molto una condizione neurologica. La funzione cerebrale sembra essere particolarmente colpita – più pazienti APS si vedono, più ampia & diffusione delle increspature neuro-psichiatriche.
Come l’emicrania, l’ictus è una delle complicazioni riconosciute della sindrome APS/Hughes. Sono state riportate cifre fino a 1 su 5 ictus giovani (sotto i 45 anni) con test aPL positivi.14-19
Tuttavia, come per l’emicrania, il riconoscimento dell’aPL nell’eziologia dell’ictus è, in generale, ancora scarso. Per esempio, l’ictus infantile – ben riconosciuto clinicamente – è un obiettivo primario per gli studi sugli aPL.
Alcuni anni fa, il governo del Regno Unito ha lanciato una grande iniziativa sull’ictus, educando il pubblico sui sintomi, i segni e il trattamento dell’ictus. La sindrome antifosfolipidica non era sulla lista.
Pezie
Nel 1985, abbiamo osservato che nei pazienti con lupus, le convulsioni erano più comuni nei pazienti con test aPL positivi.20 Da allora, è diventato chiaro che l’epilessia, in tutte le sue forme, è un importante accompagnamento dell’APS. Tanto che in uno studio sull’epilessia idiopatica negli adolescenti, 1 su 5 è stato trovato positivo all’aPL.21

Lo screening iniziale dell’ostetrica o dell’ostetrico dovrebbe includere un semplice questionario per escludere l’APS.
Image Credit: SPL/Science Source
Le implicazioni di queste osservazioni sono molte. Lasciatemi fare due esempi clinici:
In primo luogo, l’epilessia del lobo temporale nell’APS può essere sotto-riconosciuta. Uno dei miei pazienti, una donna con APS classica, è diventata un tecnico EEG. Durante la sua formazione ha usato quattro dei suoi fratelli come cavie. Tre avevano un’attività anormale del lobo temporale. È interessante vedere quanto spesso una storia familiare di epilessia salta fuori nell’anamnesi dei pazienti con APS.
Il secondo aneddoto clinico è stato pubblicato altrove.22 Una paziente di 42 anni aveva una storia passata di lupus lieve. Tuttavia, il suo problema principale – e con un impatto significativo sulla sua vita frenetica – erano le crisi ricorrenti, sia piccole che grandi, queste ultime richiedevano cure specialistiche e la combinazione di una serie di farmaci antiepilettici. Durante il suo soggiorno a Londra, ha sviluppato una TVP (è stata trovata positiva all’aPL), e l’anticoagulazione di routine con warfarin è stata iniziata. Un bonus immediato e inaspettato fu una marcata riduzione della frequenza e della gravità delle crisi, che richiedeva un trattamento antiepilettico molto meno aggressivo.
‘THE STILLBIRTH SCANDAL: Ogni giorno nel Regno Unito nascono tre bambini morti che avrebbero potuto vivere. Una nascita su 200 di donne britanniche sarà nata morta. È tempo che il NHS adotti nuove politiche e un nuovo atteggiamento”. -The Times (Londra), 28 novembre 2012
Perdita di memoria
Possibilmente la manifestazione più comune di APS è la perdita di memoria. Spesso, il problema vede la luce solo quando al paziente viene chiesto del sintomo. Così molti pazienti confessano di essere preoccupati per l’Alzheimer. Ad oggi, gli studi clinici dettagliati sono pochi e lontani tra loro. Di tanto in tanto, e, va detto, in modo abbastanza desultorio, abbiamo effettuato test psicometrici su pazienti APS selezionati e i risultati sono stati spesso sorprendenti. Ancora di più, visto il notevole miglioramento osservato nei test di memoria quando si inizia l’anticoagulazione.23
Sclerosi multipla
In considerazione della prominenza delle caratteristiche neurologiche, compresi i disturbi visivi e la mielopatia fluttuante, osservate nell’APS, non sorprende che un certo numero di casi sia diagnosticato come SM.24,25
L’argomento è tutt’altro che semplice. Alcuni in neurologia dichiarano che i test aPL positivi sono, in effetti, a volte visti nella SM classica. Io preferirei ribaltare il quadro. Tali pazienti, almeno alcuni, possono essere prima APS e poi SM. Anche se aneddoticamente un certo numero di questi casi risponde all’anticoagulazione, in altri la risposta è, nel migliore dei casi, borderline. Uthman ha recentemente rivisto la letteratura abbastanza consistente sull’APS rispetto alla SM.26
Altre caratteristiche neurologiche
Queste includono problemi di equilibrio (alcuni casi si presentano come Meniere), corea (a volte grave),27,28 anosmia, disturbi del sonno (incluse cataplessia e narcolessia) e, recentemente, disturbi autonomici con una serie di casi di POTS (sindrome da tachicardia ortostatica posturale).29
Una delle questioni su cui si discute è la prevalenza delle manifestazioni psichiatriche.
È stata mia opinione che la psicosi acuta sia stata più una caratteristica del lupus che dell’APS, ma in questo potrei sbagliarmi. Uno dei miei pazienti, una donna con APS e OCD (disturbo ossessivo compulsivo), è migliorato con il trattamento anticoagulante. È interessante notare che suo figlio adolescente, anche lui un paziente con OCD (e aPL positivo), ha trovato che le manifestazioni neuropsichiatriche erano molto meno prominenti quando il trattamento con aspirina è stato iniziato.
Non il cervello
Ossa & articolazioni-Ha subito qualche frattura? Una domanda che forse non fa parte dell’anamnesi di routine nei pazienti APS. Eppure, la frattura ossea spontanea sta diventando ben riconosciuta dopo la segnalazione di 27 fratture metatarsali spontanee da parte del dottor Shirish Sangle in pazienti APS.30
I rapporti aneddotici suggeriscono che le fratture ossee (ischemiche) possono essere una manifestazione importante della malattia: Il mio collega, il professor Munther Khamashta, ha un paziente con sindrome di Hughes con DEXA e studi paratiroidei normali che ha avuto 57 fratture spontanee. Chiaramente, questa è un’area importante per la ricerca clinica.
Anche il dolore da necrosi avascolare (AVN) dell’anca non è raro nei nostri pazienti APS. La risonanza magnetica ha mostrato un AVN precoce in alcuni casi senza altri fattori di rischio, come gli steroidi. La mia impressione clinica è che il dolore all’anca spesso migliora quando viene iniziata l’eparina o il warfarin.
Cuore-Una grande preoccupazione è la presenza di angina e altri sintomi cardiaci nell’APS. Nonostante alcune prime segnalazioni di ischemia miocardica e trombosi coronarica, è solo negli ultimi anni che sono aumentate le pubblicazioni che rivelano un’alta frequenza di queste complicazioni.
Due esempi sono la ricerca di Greco et al che mostra una prevalenza relativamente alta di test aPL positivi in pazienti con ischemia cardiaca, e la sorprendente osservazione che le donne fumatrici della pillola che erano aPL positive avevano un rischio relativo di 22 volte per lo sviluppo di infarto miocardico.31,32
I legami cardiaci sono aumentati dalla segnalazione di un’associazione con la sindrome cardiaca X, angina con angiografie coronariche normali.33 E’ lecito scommettere che il test aPL diventerà uno standard nella clinica cardiologica, specialmente nelle donne sintomatiche sotto i 40 anni.
Come l’emicrania, l’ictus è una delle complicazioni riconosciute della sindrome APS/Hughes. Sono state riportate cifre fino a 1 ictus su 5 giovani (sotto i 45 anni) che hanno test aPL positivi.
Tratto GI & fegato-Da quando abbiamo fatto le nostre osservazioni sulle lesioni stenotiche focali in varie arterie, comprese le arterie celiache e mesenteriche, ci siamo concentrati maggiormente sui sintomi di angina addominale nei pazienti con aPL/APS.34 Questa è una condizione difficile da quantificare, ma abbiamo visto un certo numero di casi in cui il clopidogrel o l’eparina ha portato ad un miglioramento (a volte marcato) del dolore post-prandiale.
Anche se il coinvolgimento del fegato nel lupus è raro, i test di funzionalità epatica anormali nell’APS sono frequenti. Anche se questi possono presagire una grave trombosi epatica, come la sindrome di Budd-Chiari o la sindrome HELLP in gravidanza che avverte dell’imminente APS catastrofica, più comunemente, hanno una prognosi più benigna.35,36
Un caso molto positivo: All’inizio degli anni ’80, ho visto un’adolescente con TVP, aPL positivo e sindrome di Budd-Chiari.
Prognosi povera?
Dopo più di trent’anni, sta ancora bene con un attento warfarin a vita gestito dai suoi medici in Portogallo.
Malattia di Goldblatt, il rene & APS-Stenosi dell’arteria renale, visto su uno sfondo chiaro di arterie altrimenti normali, può imitare le prime osservazioni di Goldblatt sullo sviluppo di ipertensione in animali con arterie renali sperimentalmente occluse. La scoperta di lesioni localizzate di stenosi dell’arteria renale da parte di Sangle ha portato a risultati simili in altri vasi, portando a teorie sulla patologia trombotica/endoteliale localizzata.37
Pelle: livedo reticularis, un enigma – Sebbene le ulcere cutanee, le vene dilatate e le emorragie subunguali da schegge siano sequele ben note della trombosi cutanea nell’APS, la livedo reticularis ha un alone di mistero.38,39
Diagnosticamente, la sua presenza è un indizio importante nei pazienti sospettati di avere la sindrome di Hughes, compresa l’APS sieronegativa.
Riguardando alcune delle condizioni menzionate in questo articolo – SM, emicrania, fratture multiple, problemi di memoria – per esempio, ci si chiede se un’attenta annotazione della presenza o assenza di livedo potrebbe rivelarsi significativa nella diagnosi differenziale di queste condizioni.
Una cosa è certa: La presenza di livedo aggiunge una dimensione in più alla gravità del quadro clinico.
Gravidanza
Naturalmente, la storia principale della sindrome è in gravidanza, dove il tasso di successo dei parti sani nelle gravidanze aPL-positive è salito da meno del 15% a oltre il 90%. Senza dubbio, la diagnosi e il trattamento di questi casi è stato un progresso significativo nel mondo dell’ostetricia.40
Sfortunatamente, tutti noi che lavoriamo con l’APS ci siamo occupati di pazienti aPL-positivi (alcuni dei quali avevano subito aborti precoci) che hanno perso un bambino alla fine della gravidanza. Stillbirth.
Due anni fa, il Times di Londra pubblicò un articolo intitolato “The Stillbirth Scandal”, evidenziando le scarse cifre di nati morti nel Regno Unito.41 Eppure alcuni casi di nati morti nelle donne aPL-positive avrebbero potuto essere evitati. Per esempio, un recente studio dell’Utah ha scoperto che le gravidanze con aPL avevano una probabilità da tre a cinque volte maggiore di nati morti.42
I test aPL di routine in gravidanza sarebbero utili? Ci sono considerazioni sui costi. L’aborto spontaneo è comune e le cause sono numerose. Quindi, la raccomandazione attuale è di riservare il test a quelle donne con tre o più aborti spontanei. Questo sembra duro. Forse un semplice processo di screening potrebbe aiutare.
Ho suggerito che parte dello screening iniziale dell’ostetrica o dell’ostetrico dovrebbe includere un semplice questionario in tre parti:
- Ha avuto una trombosi?
- Si tratta di emicrania?
- Ha una storia familiare di malattia autoimmune (cioè, lupus, RA, sclerosi multipla, malattie della tiroide)?
Sono sicuro che un questionario così semplice potrebbe aiutare a identificare un piccolo gruppo a rischio.
Nella maggior parte dei centri, una volta che la madre e il bambino sono mandati a casa in sicurezza, non c’è un follow-up a lungo termine. Eppure spesso, i pazienti APS che si presentano, diciamo, all’età di 40 anni con un problema trombotico, danno una storia passata di aborto spontaneo 20 anni prima. In un mondo ideale, le donne con aborto ricorrente meritano un regolare follow-up a lungo termine. Ma il mondo è lontano dall’ideale.
Lupus & APS
I primi studi clinici sull’APS furono condotti in cliniche lupus, e avrebbero potuto benissimo includere “caratteristiche del lupus”. Forse sorprendentemente, il tempo ha mostrato poca differenza tra l’APS primaria e l’APS associata al lupus. Ci sono, senza dubbio, alcune caratteristiche classiche del lupus (ad esempio, l’endocardite di Libman Sachs, l’ictus, le convulsioni) che hanno più probabilità di essere legate agli aPL. Sembra anche probabile che la positività degli aPL nel lupus conferisca un indice di cronicità più elevato.
Il passare del tempo ha anche rivelato una scoperta positiva: È molto insolito per i pazienti con APS primaria sviluppare il lupus negli anni successivi.
Il Big 3
L’associazione tra sindrome di Hughes, Sjögren e ipotiroidismo è così comune che ho preso a chiamarli i big 3. Clinicamente, è un’associazione importante perché i sintomi clinici delle tre condizioni – fatica, circolazione fredda, dolori e problemi di equilibrio e di memoria – sono comuni a tutti e tre. Allo stesso modo, molti di questi pazienti sono gravati dall’etichetta di fibromialgia.
Ognuna delle tre sindromi interconnesse può rispondere bene al trattamento – per esempio, la Sjögren clinica all’idrossiclorochina e così via. Molti di questi pazienti sono in trattamento con i miei due alberi – salice (aspirina) e china (chinino).
APS sieronegativa
Credo che uno dei benefici del tempo trascorso in laboratorio da un clinico in formazione sia il riconoscimento che molti test di laboratorio sono aperti alla variazione. Molti, molti studi hanno tentato di valutare l’importanza del titolo, della classe delle immunoglobuline, della tripla o doppia positività, della rilevanza di “altri” aPL come l’antifosfatidilserina ecc.43,44
In generale, tutti questi hanno rilevanza, ma nella clinica, alcuni non sono adatti, come quei pazienti con tutte le caratteristiche cliniche dell’APS i cui test aPL rimangono ostinatamente negativi.
Alcuni anni fa, abbiamo scritto un articolo introducendo il termine APS sieronegativa, richiamando l’attenzione sui pazienti con forti caratteristiche cliniche di APS ma con test negativi.45 Il concetto risale ai primi giorni della RA sieronegativa e del lupus sieronegativo, entrambe etichette che, sebbene basate sulla sola osservazione clinica, hanno avuto importanti conseguenze terapeutiche e prognostiche.
Tre possibili spiegazioni per la APS sieronegativa sono: 1) la diagnosi non è corretta (improbabile in tutti i casi); 2) i test precedentemente positivi sono diventati negativi nel tempo (non comune nella mia esperienza); o 3) sono necessari nuovi test.46
Forse la ragione più potente per l’apertura mentale sull’APS sieronegativa viene dagli studi familiari. Alcune settimane fa, ho visto una coppia di gemelli identici – il primo con APS sieropositivo classico, che poi ha portato con sé la sua sorella gemella (assolutamente) identica. La seconda gemella aveva una serie di sintomi identici, ma a differenza della prima gemella, aveva test aPL negativi. Entrambi i pazienti hanno risposto al trattamento.
Una volta all’anno, teniamo un incontro di pazienti nel nostro ospedale. All’ultimo incontro, abbiamo preparato un semplice questionario anonimo con due domande: Lei è un paziente con APS o un amico/coniuge? Ha qualche parente stretto di sesso femminile (sorella, madre, zia) con una malattia autoimmune (cioè, lupus, RA, tiroide, sclerosi multipla, APS)? Il risultato: Il 60% dei pazienti aveva una storia positiva di malattie autoimmuni in parenti stretti. Meno del 20% di amici/coniugi ha risposto positivo.
Può essere che la mia esperienza è distorta da bias di rinvio da famiglie di pazienti APS-ma sieropositivo o no, la maggior parte dei pazienti con APS sieronegativo rispondere altrettanto bene al trattamento.
Se alcuni di questi individui nello studio di famiglia ha, infatti, hanno APS sieronegativo ancora erano potenzialmente sensibili al trattamento, quindi le possibilità sono intriganti. Forse una percentuale più alta della nostra emicrania, dell’ictus giovane, dell’angina giovane potrebbe beneficiare di uno sguardo più attento per più indizi di APS – lo Schirmer secco, il livedo, la storia familiare di malattia autoimmune – per esempio.
Aspetti del trattamento
In molti modi, è deludente confessare che 30 anni dopo, ci sono pochi nuovi trattamenti. L’introduzione dei nuovi anticoagulanti orali nel trattamento dell’APS è stata prevedibilmente cauta, ed è troppo presto per generalizzare.47
Statine, IVIG e idrossiclorchina sono state gettate nel mix e, naturalmente, la terapia con cellule anti-B ha ricevuto aneddoti favorevoli. Uno studio recente da Parigi ha suggerito che il sirolimus, usato nel trapianto renale, potrebbe avere un effetto protettivo sulla vasculopatia indotta da aPL.48
Così nel 2016, l’attuale trattamento dell’APS è ancora in gran parte limitato all’aspirina, al clopidogrel, all’eparina e al warfarin.
L’aspirina a basso dosaggio, nonostante i suoi detrattori, è, ovviamente, la prima scelta in molti pazienti APS. Tuttavia, il clopidogrel rimane un’alternativa utile nei pazienti con gastrite o negli asmatici. Ma c’è un terzo ruolo per il clopidogrel – importante nel mondo reale della medicina pratica – cioè in quei pazienti che, per qualsiasi motivo, hanno provato l’aspirina, senza chiaro beneficio.
Eparina-L’eparina a basso peso molecolare ha, nella maggior parte dei paesi, ampiamente sostituito la vecchia eparina, e con essa, i timori di trombocitopenia e osteoporosi sono ampiamente scomparsi. Questo è un punto importante da fare, perché molti medici sono riluttanti a prolungare l’uso dell’eparina.
Due osservazioni: Primo, un certo numero di pazienti migliorano drasticamente con l’eparina, per poi sentirsi meno bene con il warfarin.
Dove andare dopo? Quando i problemi di dosaggio, la resistenza al warfarin e la compliance sono (si spera) esclusi, un’opzione immediata è un ritorno temporaneo all’eparina. In alcuni casi, il temporaneo si è trasformato in semi-lungo termine. Nella nostra clinica APS abbiamo un paio di dozzine di questi pazienti che, per scelta, sono rimasti sull’eparina sottocutanea per due anni o più. Sì, hanno sperimentato lividi, ma finora, non abbiamo visto peggioramenti nelle scansioni DEXA.
La seconda osservazione (e molto clinica) riguarda una prova di eparina. È un’osservazione regolare che le pazienti aPL/APS sotto eparina durante la gravidanza sono spesso senza mal di testa per tutti gli otto o nove mesi. Questo ci ha portato a sviluppare uno strumento clinico, un trial terapeutico che ci ha aiutato molto. Il trial è un ciclo di tre o quattro settimane di eparina LMW.49
Lasciate che vi dia un esempio del suo utilizzo: Nel paziente aPL/APS con mal di testa sempre più gravi nonostante l’aspirina/clopidogrel (e con una risonanza magnetica cerebrale normale), una prova di 10.000 unità di dalteparina (o enoxaparina) per tre o quattro settimane può ottenere risultati notevoli. In primo luogo, può dare un’indicazione sorprendentemente chiara se l’anticoagulazione è la strada giusta. In secondo luogo, nel paziente traumatizzato che ha seguito il percorso familiare di molteplici consultazioni specialistiche, con un successo clinico al limite, può essere un punto di svolta importante – il primo segno palpabile di miglioramento.
Warfarin-C’è poco di nuovo da dire sul warfarin. È stato vilipeso dai media, ma rimane uno dei farmaci più utili nel nostro armamentario. Il warfarin, per dirla in termini semplici, protegge dall’ictus e dall’infarto nell’APS.
Si è parlato della frequente necessità di un INR più alto in molti pazienti APS, specialmente quelli con caratteristiche neurologiche. Sono un forte sostenitore dell’uso di macchine per l’autotest dell’INR quando possibile nei nostri pazienti.
Purtroppo, alcune cliniche anticoagulanti si oppongono all’uso di macchine per l’autotest. Per me, questo è sbagliato. Guardate la libertà che ha raggiunto l’autotest per i diabetici insulino-dipendenti.
Come medici, credo che abbiamo il dovere (fino a quando non si affermano migliori e più nuovi anticoagulanti) di sostenere il warfarin come una medicina ampiamente sicura ed efficace che ha salvato molte migliaia di vite.
Nel 2015, l’attuale trattamento della sindrome di Hughes è ancora in gran parte limitato all’aspirina, clopidogrel, eparina & warfarin.
Miscellanea
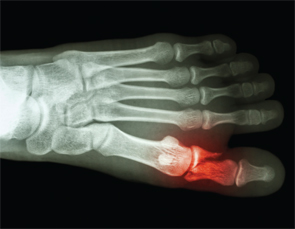
La frattura ossea spontanea sta diventando ben riconosciuta dopo la segnalazione di 27 fratture metatarsali spontanee da parte del dott. Shirish Sangle in pazienti APS.
Image Credit: Puwadol Jaturawutthichai/.com
La famiglia – Non è una sorpresa che la storia familiare sia un indizio importante nella sindrome di Hughes. La malattia autoimmune (in particolare la tiroide) spunta regolarmente come diagnosi nei parenti dei nostri pazienti. Ma quanto spesso vengono diagnosticati questi casi familiari? Gli esempi potrebbero includere la figlia di 17 anni di un paziente APS che soffre di mal di testa e febbre ghiandolare, il fratello con sclerosi multipla o la madre e la zia di un paziente APS appena diagnosticato che ha subito un ictus nei loro primi 40 anni.
Non è inconcepibile che l’APS abbia cambiato il corso della storia, come nel caso riportato dal mio amico, il dott. Gerald Weissmann, della regina Anna d’Inghilterra che ebbe 17 gravidanze fallite e morì senza figli, portando così alla fine del regno degli Stuart e all’inizio degli Hanoveriani – con Giorgio III, le tasse delle colonie americane, la rivoluzione e la nascita degli Stati Uniti.50
La prole – Fino ad oggi, la maggior parte degli studi ha suggerito che la prole di madri aPL-positive non ha grandi effetti negativi (a parte, forse, il successivo sviluppo di caratteristiche APS ereditate in alcuni). Tuttavia, alcuni casi preoccupanti di problemi fetali e neonatali indicano la necessità di ulteriori studi. Gli studi in corso dei dottori Anne Parke, Angela Tincani, Maria Claire Boffa e altri forniranno, col tempo, alcuni di questi dati mancanti.51,52
Classificazione vs. diagnosi-
Caro dottore, le sarei grato se potesse consigliarmi su questa paziente. Ha sviluppato una trombosi con la pillola contraccettiva orale. Ha avuto un test positivo per l’aPL, ma non ha ripetuto il test 12 settimane dopo.
Come nel caso del lupus, i criteri di classificazione a volte si confondono con la diagnosi. Molti pazienti non vengono armati di test “a distanza di 12 settimane” (questo criterio è stato introdotto per coprire il rischio che un’infezione intercorrente possa aver portato a un test aPL transitorio positivo – non un fattore importante nella nostra valutazione di questo paziente).
Ci sono anche considerazioni finanziarie, come nel seguente studio da Beirut, Libano.
“Solo il 50,5% aveva sia aCL che LA testati. … Il costo di ogni test era di circa 50 dollari per il paziente. … Resta da vedere se i costi del test possano spiegare in parte la percentuale molto piccola di pazienti che si sono sottoposti a un test di conferma di follow-up.”
Il passare del tempo ha anche rivelato una scoperta positiva: È molto insolito per i pazienti con APS primaria sviluppare il lupus negli anni successivi.
Il riconoscimento delle molte manifestazioni non trombotiche dell’APS ha aggiunto l’importanza di separare la diagnosi dalla classificazione. Forse, i progressi di laboratorio nella misurazione dei potenziali marcatori di rischio ci verranno, col tempo, in aiuto.44
Paura di volare – Questo aneddoto clinico appare regolarmente nella mia clinica. Tanto che credo che abbia bisogno di ulteriori studi. Un certo numero di miei pazienti APS, in particolare prima che il trattamento sia stato iniziato, soffrono gravemente di jet lag prolungato dopo un volo a lungo raggio, con stanchezza, mal di testa e confusione, che a volte dura per giorni.
Interessante, una volta che il trattamento con eparina o warfarin è iniziato con successo, questo fenomeno scompare. Non si sa se questi sintomi siano legati a una lieve ipossia cerebrale dovuta a una pressione in cabina leggermente ridotta. Tuttavia, alcuni dei miei pazienti con APS integrano il loro trattamento con aspirina prima di un volo a lungo raggio con un’iniezione di eparina LMW. Anche se l’effetto placebo può essere considerevole, sono sufficientemente impressionato dall’esperienza clinica di questi pazienti (osservanti) per credere che il fenomeno del jet lag prolungato in molti dei nostri pazienti è molto reale.
Il futuro – Al 14° Congresso Internazionale sugli anticorpi antifosfolipidi tenutosi a Rio de Janeiro nel 2013, mi è stato chiesto di fare delle previsioni sul futuro dell’APS.23 In sintesi, credo:
- il test aPL diventerà mondiale e di routine;
- Saranno disponibili kit di test aPL da banco;
- Un sottogruppo sostanziale di persone che soffrono di emicrania avrà una nuova speranza;
- L’APS sarà riconosciuta come il principale legame tra emicrania e ictus;
- Gli attacchi di cuore nelle giovani donne (specialmente quelle sotto i 45 anni) saranno ridotti;
- Gli ictus in quelle sotto i 45 anni saranno ridotti;
- Alcuni casi di malattia arteriosa accelerata saranno riconosciuti come associati all’aPL (non trattata);
- Alcuni casi di perdita di memoria sono trattabili;
- L’aPS continuerà ad avere un profondo effetto sulla nostra valutazione clinica e sul trattamento del lupus; e
- Infine, per tornare al tema iniziale, l’incidenza di nati morti sarà ridotta, grazie, in parte, ad un approccio più proattivo al test aPL in gravidanza.
Per ripetere una frase tratta dall’articolo del 1983:1
Per quelli di noi induriti nel nichilismo da anni di studio dei vari autoanticorpi nel LES, c’è un raro senso di eccitazione per le implicazioni delle associazioni ora riportate.
Trenta anni dopo, quell’eccitazione clinica rimane immutata.
 Graham R.V. Hughes, MD, FRCP, è un reumatologo consulente e capo del London Lupus Centre. Si è formato al London Hospital e ha trascorso due anni a New York lavorando all’introduzione del test di legame al DNA, sotto la guida del dottor Charles Christian. Nel 1971, ha aperto una clinica specializzata a Londra, occupandosi esclusivamente del lupus e delle malattie correlate. È fondatore e direttore della rivista internazionale Lupus. Nel 1983, ha descritto la sindrome antifosfolipidica e nel 1991, ha ricevuto il premio ILAR (ricerca mondiale) per questo lavoro. Altre onorificenze includono Dottore Honoris Causa nelle Università di Marsiglia e Barcellona, e Maestro dell’ACR.
Graham R.V. Hughes, MD, FRCP, è un reumatologo consulente e capo del London Lupus Centre. Si è formato al London Hospital e ha trascorso due anni a New York lavorando all’introduzione del test di legame al DNA, sotto la guida del dottor Charles Christian. Nel 1971, ha aperto una clinica specializzata a Londra, occupandosi esclusivamente del lupus e delle malattie correlate. È fondatore e direttore della rivista internazionale Lupus. Nel 1983, ha descritto la sindrome antifosfolipidica e nel 1991, ha ricevuto il premio ILAR (ricerca mondiale) per questo lavoro. Altre onorificenze includono Dottore Honoris Causa nelle Università di Marsiglia e Barcellona, e Maestro dell’ACR.
- Hughes GR. Trombosi, aborto, malattia cerebrale e l’anticoagulante lupus. Br Med J (Clin Res Ed). 1983 Oct 15;287(6399):1088-1089.
- Harris EN, Gharavi AE, Boey ML, et al. Anticardiolipina negli anticorpi: Rilevamento tramite radioimmunodosaggio e associazione con la trombosi nel LES. Lancet. 1983 Nov 26;2(8361):1211-1214.
- Boey ML, Colaco CB, Gharavi AE, et al. Trombosi nel LES: associazione sorprendente con la presenza di anticoagulante lupus circolante. Br Med J (Clin Res Ed). 1983 Oct 8;287:1021-1023.
- Hughes GR. L’orazione di Prosser White 1983: La malattia del tessuto connettivo e la pelle. Clin Exp Dermatol. 1984 Nov;9(6):535-544.
- Asherson RA, Mackworth-Young CG, Boey ML, Hughes GRV. Ipertensione polmonare nel lupus eritematoso sistemico. Br Med J (Clin Res Ed). 1983 Oct 8;287(6398):1024-1025.
- Derue GJ, Englert HJ, Harris EN, et al. Perdita fetale nel lupus sistemico: Associazione con anticorpi anticardiolipina. J Obstet Gynaecol. 1985;5(4):207-209.
- Hughes GR, Harris NN, Gharavi AE. La sindrome anticardiolipina. J Rheumatol. 1986 Jun;13(3):486-489.
- Hughes GR. La sindrome di Hughes: La sindrome anticardiolipina. Una visione storica. Lupus. 1998;7 Suppl 2:S1-S4.
- Carecchio M, Cantello R, Comi C. Rivisitazione del meccanismo molecolare nella sindrome da antifosfolipidi: oltre il danno vascolare. J Immunol Res. 2014;2014:239398.
- Bluestein HG, Zvaifler NJ. Anticorpi linfocitotossici reattivi al cervello nel siero di pazienti con SLE. J Clin Invest. 1976 Feb;57(2):509-516.
- Bresnihan B, Oliver N, Grigor R, Hughes GR. Reattività cerebrale degli aniticorpi linfocitotossici nel lupus eritematoso sistemico con e senza coinvolgimento cerebrale. Clin Exp Immunol. 1977 Dec;30(3):333-337.
- Bresnihan B, Hohmeister R, Cutting J, et al. The neuropsychiatric disorder in SLE: Evidence for both vascular and immune mechanisms. Ann Rheum Dis. 1979 Aug;38(4):301-306.
- Denburg SD, Behmann SA, Carbotte RM, et al. Antigeni dei linfociti nel lupus eritematoso sistemico neuropsichiatrico. Relazione delle specificità anticorpali dei linfociti con la malattia clinica. Arthritis Rheum. 1994 Mar;37(3):369-375.
- Harris EN, Gharavi AE, Asherson RA, et al. Infarto cerebrale nel LES. Associazione con anticorpi anticardiolipina. Clin Exp Rheumatol. 1984 Jan-Mar;2(1):47-51.
- Navarrete MG, Brey RL, Levine SR. “Malattia cerebrale nella sindrome da antifosfolipidi” in Hughes Syndrome-Antiphospholipid Syndrome. Khamashta MA, ed. Springer, London: 2000.
- Sanna G, Bertolaccini ML, Cuadrado MJ, et al. Central nervous system involvement in the antiphospholipid (Hughes) syndrome. Reumatologia (Oxford). 2003 Feb;42(2):200-213.
- Etminan M, Takkouche B, Isorna FC, Samii A. Rischio di ictus ischemico in persone con emicrania: Revisione sistematica e meta-analisi di studi osservazionali. BMJ. 2005 Jan 8;330(7482):63.
- Nencini P, Baruffi MC, Abbate R, et al. Lupus anticoagulant e anticorpi anticardiolipina in giovani adulti con ischemia cerebrale. Ictus. 1992 Feb;23(2):189-193.
- Hughes GR. Sindrome antifosfolipidica, emicrania e ictus. Lupus. 2010 Apr;19(5):555-556.
- Mackworth-Young CG, Hughes GR. Epilessia: Un sintomo precoce del lupus eritematoso sistemico. J Neurol Neurosurg Psychiatry. 1985 Feb;48(2):185.
- Cimaz R, Meroni PL, Shoenfeld Y. Epilessia come parte del lupus eritematoso sistemico e della sindrome antifosfolipidica sistemica (sindrome di Hughes). Lupus. 2006;15(4):191-194.
- Hughes GR. “Epilessia diplomatica” in Understanding Hughes Syndrome. Springer-Verlag, London: 2009.
- Hughes GR. Sindrome di Hughes/APS. 30 anni dopo, cosa abbiamo imparato? Discorso di apertura al 14° Congresso internazionale sugli anticorpi antifosfolipidi. Rio de Janeiro, ottobre 2013. Lupus. 2014;23:400-406.
- Cuadrado MJ, Khamashta MA, Ballesteros A, et al. Le manifestazioni neurologiche della sindrome di Hughes (antifosfolipidi) possono essere distinte dalla sclerosi multipla? Analisi di 27 pazienti e revisione della letteratura. Medicina (Baltimora). 2000 Jan;79(1):57-68.
- Hughes GR. Emicrania, perdita di memoria e “sclerosi multipla”. Caratteristiche neurologiche della sindrome antifosfolipidica (di Hughes). Postgrad Med J. 2003 Feb;79(928):81-83.
- Uthman I, Noureldine MH, Berjawi A, et al. Hughes syndrome and multiple sclerosis. Lupus. 2015 Feb;24(2):115-121.
- Cervera R, Asherson RA, Font J, et al. Corea nella sindrome antifosfolipidica. Caratteristiche cliniche, radiologiche e immunologiche di 50 pazienti della nostra clinica e della letteratura recente. Medicina (Baltimora). 1997 May;76(3):203-212.
- Baizabal-Carvallo JF, Bonnet C, Jankovic J. Movement disorders in systemic lupus erythematosus and the antiphospholipid syndrome. J Neural Transm (Vienna). 2013 Nov;120(11):1579-1589.
- Schofield JR, Blitshteyn S, Shoenfeld Y, et al. Sindrome da tachicardia posturale (POTS) e altri disturbi autonomici nella sindrome da antifosfolipidi (Hughes) (APS). Lupus. 2014 Jun;23(7):697-702.
- Sangle S, D’Cruz DP, Khamashta MA, et al. Anticorpi antifosfolipidi, lupus eritematoso sistemico e fratture metatarsali non traumatiche. Ann Rheum Dis. 2004 Oct;63(10):1241-1243.
- Greco TP1, Conti-Kelly AM, Greco T Jr. et al. I più recenti anticorpi antifosfolipidi predicono esiti negativi nei pazienti con sindrome coronarica acuta. Am J Clin Pathol. 2009 Oct;132(4):613-620.
- Urbanus RT, Siegerink B, Roest M, et al. Anticorpi antifosfolipidi e rischio di infarto miocardico e ictus ischemico nelle giovani donne nello studio RATIO: Uno studio caso-controllo. Lancet Neurol. 2009 Nov;8(11):998-1005.
- Nair S, Khamashta MA, Hughes GR. Sindrome X e sindrome di Hughes. Lupus. 2002;11(5):332.
- Sangle SR, Jan W, Lau IS, et al. Stenosi dell’arteria celiaca e sindrome antifosfolipidica (Hughes)/anticorpi antifosfolipidi. Clin Exp Rheumatol. 2006 May-Jun;24(3):349.
- Mackworth-Young CG, Melia WM, Harris EN, et al. La sindrome di Budd-Chiari. Possibile ruolo patogenetico degli anticorpi antifosfolipidi. J Hepatol. 1986;3(1):83-86.
- Hanouna G, Morel N, Le Thi Huong D, et al. Sindrome antifosfolipidica catastrofica e gravidanza: Un’esperienza di 13 casi. Reumatologia (Oxford). 2013 Sep;52(9):1635-1641.
- Sangle SR, D’Cruz DP, Jan W, et al. stenosi dell’arteria renale nella sindrome antifosfolipidica (Hughes) e ipertensione. Ann Rheum Dis. 2003 Oct;62(10):999-1002.
- Englert HJ, Loizou S, Derue GG, et al. Caratteristiche cliniche e immunologiche di livedo reticularis nel lupus. Am J Med. 1989 Oct;87(4):408-410.
- Sangle SR, D’Cruz DP. Livedo reticularis: Un enigma. Isr Med Assoc J. 2015 Feb;17(2):104-107.
- Ateka-Barrutia O, Khamashta MA. La sfida della gravidanza per le pazienti con SLE. Lupus. 2013 Oct;22(12):1295-1308.
- Hughes GR. Lo scandalo dei nati morti. Lupus. 2013 Jul;22(8):759-760.
- Silver RM, Parker CB, Reddy UM, et al. Antiphospholipid antibodies in stillbirth. Obstet Gynecol. 2013 Sep;122(3):641-657.
- Rodriguez-Garcia JL, Bertolaccini ML, Cuadrado MJ, et al. Manifestazioni cliniche della sindrome antifosfolipidica (APS) con e senza anticorpi antifosfolipidi (il cosiddetto ‘APS sieronegativo’). Ann Rheum Dis. 2012 Feb;71(2):242-244.
- Meroni PL, Chighizab CB, Rovelli F, et al. Sindrome antifosfolipidica nel 2014: Più manifestazioni cliniche, nuovi attori patogeni e biomarcatori emergenti. Artrite Res Ther. 2014;16(2):209.
- Hughes GR, Khamashta MA. Sindrome antifosfolipidica sieronegativa. Ann Rheum Dis. 2003 Dec;62(12):1127.
- Rodguez-Garcia JL, Bertolaccini ML, Cuadrado MJ, et al. manifestazioni cliniche della sindrome antifosfolipidica (APS) con e senza anticorpi antifosfolipidi. Ann Rheum Dis. 2012 Feb;71(2):242-244.
- Giles I, Khamashta M, D’Cruz D, et al. A new dawn of anticoagulation for patients with antiphospholipid syndrome. Lupus. 2012 Oct;21(12):1263-1265.
- Canuad G, Bienaimé C, Taborin F, et al. Inibizione della via mTORC nella sindrome antifosfolipidica. New Eng J Med. 2014 Jul 24;371(4):303-312.
- Hughes GR. Eparina, anticorpi antifosfolipidi e il cervello. Lupus. 2012 Sep;21(10):1039-1040.
- Weissmann G. Il lupus della regina Anna: Fosfolipidi e il corso dell’impero. FASEB J. 2014 Apr;28(4):1527-1530.
- Mekinian A, Lachassinne E, Nicaise-Roland P, et al. European registry of babies born to mothers with antiphospholipid syndrome. Ann Rheum Dis. 2013 Feb;72(2):217-222.
- Nalli C, Iodice A, Andreoti L, et al. Bambini nati da madri SLE e APS. Lupus. 2014 Oct;23(12):1246-1248.
- Major S, Pashayan N, Atweh S, et al. Practice patterns of antiphospholipid syndrome at a tertiary teaching hospital in Lebanon. Lupus. 2002;11(11):759–764.