INTRODUZIONE
Le contrazioni ventricolari premature (PVC) che hanno origine nel tratto di efflusso del ventricolo destro (RVOT) appaiono di solito in pazienti senza malattia cardiaca strutturale. Possono presentarsi sotto forma di PVC isolato o incessante, o come tachicardia (fino al 80% della tachicardia ventricolare idiopatica). Il principale meccanismo causale è l’attività innescata, ma sono stati postulati anche meccanismi di rientro o di automaticità anormale.
I pazienti di solito presentano sintomi associati all’esercizio, allo stress o all’uso di stimolanti. I sintomi possono influenzare la qualità della vita e il tipo incessante di VE può portare alla tachicardiomiopatia.
I betabloccanti o il verapamil di solito mostrano solo un’efficacia limitata nel controllo di questo tipo di PVC. L’ablazione a radiofrequenza può essere efficace, ma è ostacolata dal fatto che questo PVC ha un’inducibilità limitata e imprevedibile. I metodi convenzionali guidati dalla fluoroscopia possono essere di uso limitato se le PVC sono scarse, perché la mappatura dell’attivazione è complessa e la mappatura della stimolazione ha una bassa risoluzione spaziale.
I sistemi di mappatura senza contatto (NCMS) si sono dimostrati utili nella localizzazione dei battiti ectopici e come guida nella loro ablazione.1, 2 In questo articolo descriviamo l’ablazione delle PVC RVOT utilizzando l’Ensite Array NCMS (St. Jude Medical, St. Paul, Minnesota, Stati Uniti). Questo sistema utilizza un catetere multielettrodo array (MAC) con un palloncino 7.5ml e 64 microelettrodi per individuare la tachicardia. Il MAC fornisce oltre 3000 elettrogrammi unipolari virtuali simultaneamente da un singolo battito e li visualizza in un’immagine tridimensionale dalla camera di interesse.
METODI Caratteristiche dei pazienti
Quattro pazienti senza malattia cardiaca strutturale ma con incessante PVC RVOT sintomatico sono stati sottoposti ad ablazione utilizzando NCMS tra gennaio 2006 e dicembre 2009. L’età media dei pazienti era di 43±6 anni e il 50% erano maschi.
Tutti avevano una scarsa qualità della vita a causa di PVC altamente sintomatico e frequente (media, 30 763±4710 PVC / giorno). Tutti avevano fallito con almeno 2 farmaci antiaritmici, uno dei quali era sempre un betabloccante. L’ablazione era stata tentata in precedenza in 2 dei pazienti utilizzando un sistema convenzionale, ma senza successo.
In tutti i pazienti, l’attività extrasistolica era scarsa il giorno della procedura. I farmaci antiaritmici sono stati sospesi almeno 5 semilavorati prima della procedura e la sedazione è stata evitata.
Studio elettrofisiologico
Un catetere di ablazione da 4 mm (Livewire TC, St. Jude Medical) è stato posizionato nel ventricolo destro (RV). Se, dopo l’infusione di isoproterenolo e la stimolazione ventricolare, non è stato possibile ottenere un PVC sufficiente per eseguire la mappatura dell’attivazione, allora è stato introdotto il MAC.
Il MAC è stato avanzato su un filo guida da 0,035″ utilizzando la fluoroscopia e il palloncino è stato posizionato nel RVOT da 2 a 3 cm dalla valvola polmonare. L’anticoagulazione con eparina è stata avviata a questo punto. L’anatomia del RV è stata quindi ricostruita, con particolare attenzione al RVOT e alla situazione della valvola polmonare (Figura 1). Una distanza di
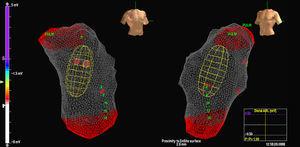
Figura 1. Immagine del catetere di array multielettrodo nel tratto di efflusso ventricolare destro.
Successivamente, 3 battiti extrasistolici sono stati analizzati per ogni morfologia PVC presentato dal paziente e mappe isopotenziali e isocrone sono stati ottenuti offline. I filtri da 30 a 500Hz sono stati utilizzati per gli elettrogrammi bipolari e un filtro passa-alto a 2Hz è stato utilizzato con gli elettrogrammi unipolari virtuali.
La mappa isopotenziale rappresenta dinamicamente l’attivazione utilizzando aree di massima ampiezza di tensione e mostra come il fronte d’onda viaggia. Il punto di attivazione più precoce è definito come il punto che mostra l’attivazione più precoce rispetto all’inizio del QRS e mostra una morfologia QS con rapida deflessione negativa sull’elettrogramma unipolare. La mappa isopotenziale identifica anche il punto di partenza del fronte d’onda prima che si diffonda al resto del miocardio. La mappa isocrona è una mappa convenzionale del tempo di attivazione della superficie endocardica, e utilizza un segnale unipolare virtuale.
Il target per l’ablazione era sia l’area di attivazione più precoce che il punto di partenza del fronte di attivazione. La radiofrequenza è stata applicata occasionalmente in questi siti, con un controllo della temperatura limitato a 50W, temperature inferiori a 55°C, e una durata di 60s. L’ablazione è stata considerata riuscita se il PVC è scomparso durante l’applicazione e non è stato reindotto.
Tutte le procedure sono state eseguite dallo stesso elettrofisiologo, che ha diretto l’ingegnere che operava il NCMS.
RISULTATI
Tre pazienti avevano una singola morfologia di PVC, mentre un paziente aveva 2 morfologie. In 3 casi, la posizione era settale, mentre negli altri 2 casi era nella parete libera del RVOT. In tutti i casi, è stata la mappa isopotenziale (Figura 2) a localizzare più accuratamente il focus di origine; la mappa isocrona era di valore relativamente scarso (Figura 3).
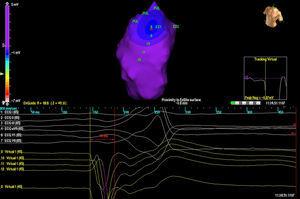
Figura 2. Mappa isopotenziale in un paziente con 2 diverse extrasistoli ventricolari originate dal tratto di efflusso ventricolare destro. Ogni uscita è rappresentata dalle lettere EX (1 e 2). Il punto di attivazione più precoce è mostrato in EX1, con l’immagine di QS negli unipolari virtuali (sotto).
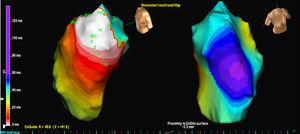
Figura 3. Mappa isocrona dell’uscita EX1 per le stesse extrasistole ventricolari analizzate nella Figura 1 . Il bianco indica la prima attivazione e il viola indica l’ultima attivazione.
Abbiamo anche confermato in tutti i casi che il PVC non era causato meccanicamente e che coincideva con la morfologia del PVC clinico. In un paziente, il palloncino era molto vicino alla superficie endocardica dove il PVC ha avuto origine e ha dovuto essere riposizionato in modo da consentire un’adeguata mobilizzazione dell’elettrocatetere di ablazione.
Una media di 3 applicazioni di radiofrequenza per focus è stata utilizzata per ablare sia il punto di prima attivazione che il punto di partenza del fronte di attivazione. Il tempo medio di applicazione era 113±15s per ogni focus. Un aumento dell’attività ectopica è stato osservato per precedere la cessazione dell’applicazione.
Il tempo medio di fluoroscopia era 31±11 (21-46) min e il tempo totale della procedura era 136±38min, anche se questo è diminuito lungo la curva di apprendimento, da 190min per la prima procedura a 100min per la quarta.
Abbiamo raggiunto un tasso di successo acuto del 100% senza complicazioni e nessuna ricomparsa di PVC con infusione di isoproterenolo o ripetizione del protocollo di stimolazione. Dopo una media di 30±16 mesi, i pazienti sono rimasti asintomatici senza terapia farmacologica, e nel monitoraggio Holter alla visita di follow-up di 1 anno il numero medio di PVC era 159±113/giorno.
DISCUSSIONE
Anche se altri autori hanno dimostrato l’utilità della NCMS per ablare la PVC del RVOT,2, 3 il suo uso non è diffuso.4 Nella nostra esperienza, sono stati ottenuti risultati eccellenti fin dai primi casi. Per l’ablazione della tachicardia ventricolare del RVOT sono di solito riportate percentuali di successo superiori all’80%5; tuttavia, abbiamo ottenuto una percentuale di successo più elevata anche se siamo stati in grado di mappare solo il PVC isolato. Il nostro endpoint acuto era la scomparsa di PVC, ed è stato limitato dalla bassa frequenza di PVC durante la procedura. Questo ha reso necessario confermare l’efficacia dell’ablazione durante il follow-up attraverso la diminuzione della frequenza del PVC nel monitoraggio Holter.
L’aritmia nei nostri pazienti aveva un’origine focale, che è coerente con le osservazioni di altri autori.2, 6 L’ablazione era limitata al punto di attivazione più precoce, che può aver contribuito all’alta percentuale di successo.
L’NCMS ha richiesto solo un singolo battito per individuare con precisione l’origine del PVC. Anche se abbiamo preferito confermare la posizione mappando altri PVC identici, il sito di origine non è stato modificato. Nella nostra esperienza, l’ablazione di successo è stata ottenuta basandosi esclusivamente sulla mappa isopotenziale.
Una delle limitazioni del sistema è che individua il primo punto di attivazione nell’endocardio della camera esplorata, anche quando il punto non si trova nell’endocardio, ma nell’epicardio o in un’altra camera collegata. In questi casi, l’analisi virtuale unipolare aiuta a indicare che l’origine non è nell’endocardio del RV, come in quel caso il punto endocardico più precoce presenterebbe un rS.
Inoltre, il MAC può produrre PVC meccanico e, essendo situato nel RVOT, può essere confuso con PVC clinico. Per differenziare, abbiamo analizzato la corrispondenza elettrocardiografica con il PVC clinico e abbiamo confermato che il punto di origine del PVC non era in contatto con il palloncino.
Il PVC può anche avere origine molto vicino a dove si trova il MAC, impedendo così l’accesso al catetere di ablazione. In questi casi, può essere necessario riposizionare il palloncino.
Nella nostra serie, la NCMS si è dimostrata un mezzo efficace e sicuro per rimuovere il PVC RVOT isolato e difficile da indurre e ha contribuito a ridurre la complessità delle procedure coinvolte.
CONFLITTI DI INTERESSE
Nessuno dichiarato.
Riconoscimenti
Vorremmo ringraziare Joaquín Panduro per la sua revisione critica del manoscritto.
Ricevuto 21 gennaio 2011
Accettato 1 maggio 2011