Elettroni di Nucleo e Valenza
Come si continua attraverso la tavola periodica in questo modo, scrivendo le configurazioni elettroniche di atomi sempre più grandi, diventa noioso continuare a copiare le configurazioni dei sottogusci interni riempiti. In pratica, i chimici semplificano la notazione usando un simbolo di gas nobile tra parentesi per rappresentare la configurazione del gas nobile della riga precedente, perché tutti gli orbitali in un gas nobile sono riempiti. Per esempio, rappresenta la configurazione elettronica 1s2 2s2 2p6 del neon (Z = 10), quindi la configurazione elettronica del sodio, con Z = 11, che è 1s2 2s2 2p6 3s1, si scrive come 3s1
| Configurazione completa degli elettroni | Stenografia dei gas nobel | ||
| Neon | Z = 10 | Ne: 1s2 2s2 2p6 | Ne: 2s2 2p6 |
| Sodio | Z = 11 |
Na: 1s2 2s2 2p6 3s1 |
Na: 3s1 |
Gli elettroni negli orbitali interni pieni sono più vicini al nucleo e più strettamente legati ad esso, e quindi sono raramente coinvolti nelle reazioni chimiche. Chiameremo questi elettroni del nucleo. Per gli elementi rappresentativi (colonne 1, 2 e 13-18 della tavola periodica), gli elettroni del nucleo sono tutti gli elettroni con un valore n inferiore al valore n massimo nella configurazione elettronica. Per esempio, nell’atomo di sodio il valore n più alto è 3. Quindi, gli elettroni del nucleo sono quelli negli orbitali atomici con n < 3, cioè quelli negli orbitali 1s, 2s e 2p. Quindi, il sodio ha 10 elettroni di nucleo. Rivedremo questa definizione di elettroni del nucleo più tardi per i metalli di transizione.
Questo significa che la chimica di un atomo dipende principalmente dagli elettroni del suo guscio più esterno, quelli con il valore n più alto, che sono chiamati elettroni di valenza. La notazione semplificata ci permette di vedere più facilmente la configurazione degli elettroni di valenza. Usando questa notazione per confrontare le configurazioni elettroniche del sodio e del litio, abbiamo:
| Sodio | 1s2 2s2 2p6 3s1 | 3s1 |
| Litio | 1s2 2s1 | 2s1 |
È evidente che sia il sodio che il litio hanno un elettrone s nel loro guscio di valenza. Prevediamo quindi che il sodio e il litio hanno una chimica molto simile, il che è effettivamente il caso.
Continuando a costruire gli otto elementi del periodo 3, gli orbitali 3s e 3p sono riempiti, un elettrone alla volta. Questa fila si conclude con il gas nobile argon, che ha la configurazione elettronica 3s2 3p6, corrispondente a un guscio di valenza pieno.
Esempio 2.2.2
Disegna un diagramma orbitale e usalo per ricavare la configurazione elettronica del fosforo, Z = 15. Qual è la sua configurazione elettronica di valenza?
Dato: numero atomico
Chiesto: diagramma orbitale e configurazione elettronica di valenza per il fosforo
Strategia:
- Cerca il gas nobile più vicino al fosforo nella tavola periodica. Poi sottrai il suo numero di elettroni da quelli del fosforo per ottenere il numero di elettroni di valenza nel fosforo.
- Riferendosi alla figura 2.1.1, disegna un diagramma orbitale per rappresentare questi orbitali di valenza. Seguendo la regola di Hund, metti gli elettroni di valenza negli orbitali disponibili, iniziando dall’orbitale che ha l’energia più bassa. Scrivi la configurazione degli elettroni dal tuo diagramma orbitale.
- Ignora gli orbitali interni (quelli che corrispondono alla configurazione elettronica del gas nobile più vicino) e scrivi la configurazione degli elettroni di valenza per il fosforo.
Soluzione:
A Poiché il fosforo è nella terza fila della tavola periodica, sappiamo che ha un guscio chiuso con 10 elettroni. Cominciamo a sottrarre 10 elettroni dai 15 del fosforo.
B I cinque elettroni aggiuntivi sono messi nei prossimi orbitali disponibili, che la figura 2.1.1 ci dice che sono gli orbitali 3s e 3p:
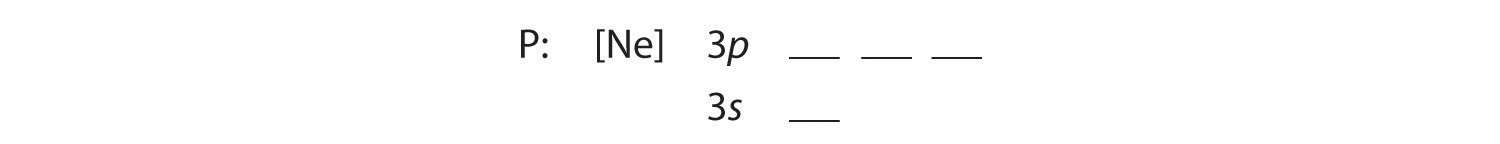
Perché l’orbitale 3s ha un’energia inferiore a quella degli orbitali 3p, lo riempiamo prima:
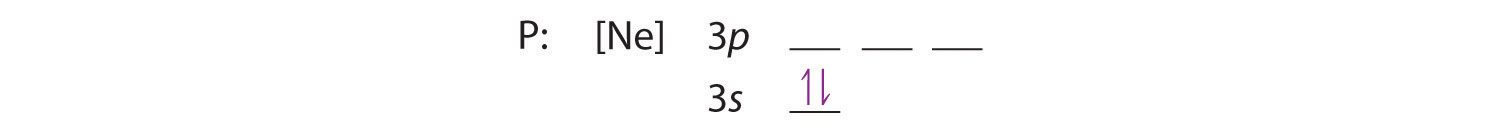
La regola di Hund ci dice che i tre elettroni rimanenti occuperanno gli orbitali 3p degeneri separatamente ma con i loro spin allineati:
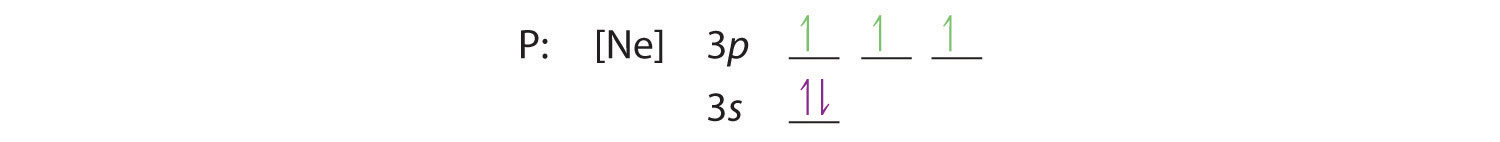
La configurazione elettronica è 3s2 3p3.
C Otteniamo la configurazione degli elettroni di valenza ignorando gli orbitali interni, che per il fosforo significa che ignoriamo il guscio chiuso. Questo dà una configurazione degli elettroni di valenza di 3s2 3p3.
Esercizio 2.2.2
Disegna un diagramma orbitale e usalo per ricavare la configurazione elettronica del cloro, Z = 17. Qual è la sua configurazione elettronica di valenza?
Risposta: 3s2 3p5
Configurazione elettronica di valenza: 3s23p5
L’ordine generale in cui gli orbitali sono riempiti è rappresentato nella figura 2.2.1. I sottogusci corrispondenti ad ogni valore di n sono scritti da sinistra a destra su linee orizzontali successive, dove ogni riga rappresenta una riga della tavola periodica. L’ordine in cui gli orbitali sono riempiti è indicato dalle linee diagonali che corrono da destra in alto a sinistra in basso. Di conseguenza, l’orbitale 4s è riempito prima dell’orbitale 3d a causa degli effetti di schermatura e penetrazione. Di conseguenza, la configurazione elettronica del potassio, che inizia il quarto periodo, è 4s1, e la configurazione del calcio è 4s2. Cinque orbitali 3d sono riempiti dai prossimi 10 elementi, i metalli di transizione, seguiti da tre orbitali 4p. Notate che l’ultimo membro di questa fila è il gas nobile krypton (Z = 36), Kr: 4s2 3d10 4p6, che ha orbitali 4s, 3d e 4p riempiti. La quinta fila della tavola periodica è essenzialmente la stessa della quarta, eccetto che gli orbitali 5s, 4d e 5p sono riempiti in modo sequenziale.
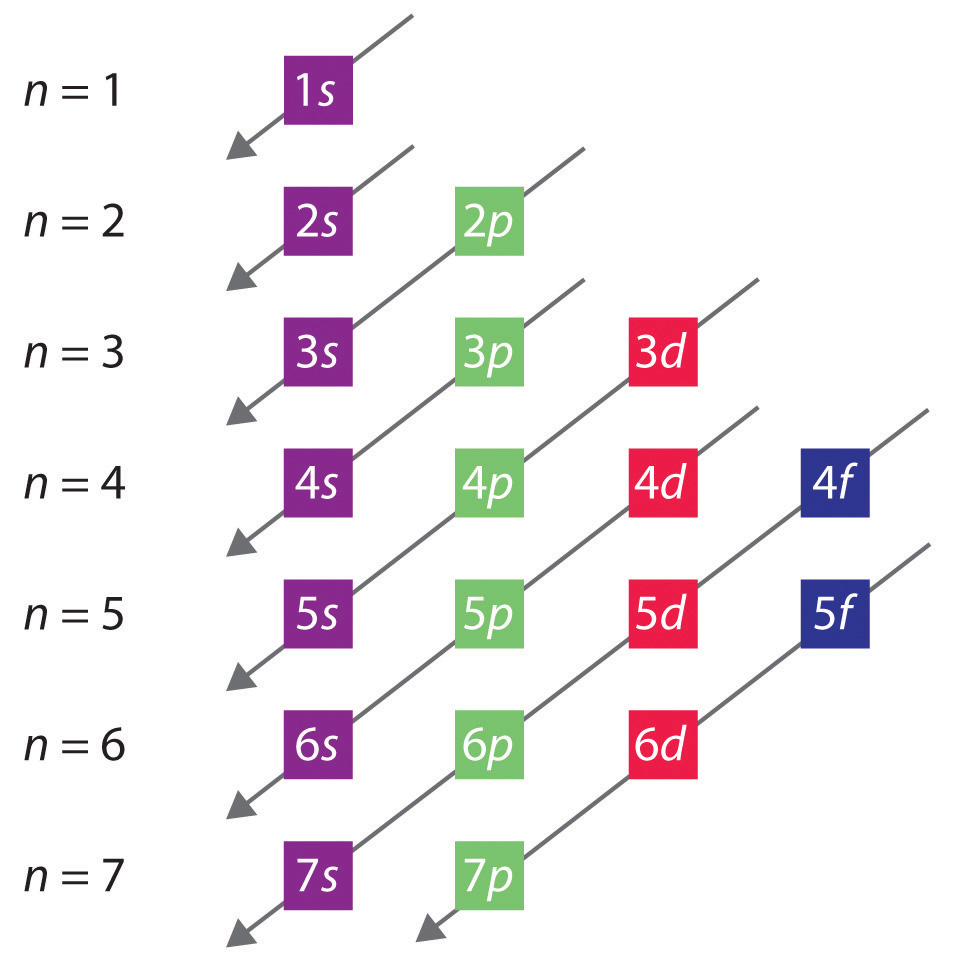
Figura 2.2.1 Predire l’ordine in cui gli orbitali sono riempiti negli atomi multielettronici. Se si scrivono i sottogusci per ogni valore del numero quantico principale su linee successive, l’ordine osservato in cui sono riempiti è indicato da una serie di linee diagonali che vanno dall’alto a destra al basso a sinistra.
La sesta riga della tavola periodica sarà diversa dalle due precedenti perché gli orbitali 4f, che possono contenere 14 elettroni, sono riempiti tra gli orbitali 6s e 5d. Gli elementi che contengono orbitali 4f nel loro guscio di valenza sono i lantanidi. Quando gli orbitali 6p sono finalmente riempiti, abbiamo raggiunto il prossimo (e ultimo gas nobile conosciuto), il radon (Z = 86), Rn: 6s2 4f14 5d10 6p6. Nell’ultima riga, gli orbitali 5f sono riempiti tra gli orbitali 7s e 6d, il che dà i 14 elementi attinidi. Poiché il gran numero di protoni rende i loro nuclei instabili, tutti gli attinidi sono radioattivi.
Esempio 2.2.3
Scrivi la configurazione elettronica del mercurio (Z = 80), mostrando tutti gli orbitali interni.
Dato: numero atomico
Chiesto: configurazione elettronica completa
Strategia:
Utilizzando il diagramma degli orbitali in Figura 2.2.1 e la tavola periodica come guida, riempi gli orbitali fino a quando tutti gli 80 elettroni sono stati posizionati.
Soluzione:
Posizionando gli elettroni negli orbitali seguendo l’ordine mostrato in Figura 2.2.1 e usando la tavola periodica come guida, otteniamo
| 1s2 | fila 1 | 2 elettroni |
| 2s22p6 | fila 2 | 8 elettroni |
| 3s23p6 | fila 3 | 8 elettroni |
| 4s23d104p6 | fila 4 | 18 elettroni |
| 5s24d105p6 | fila 5 | 18 elettroni |
| fila 1-5 | 54 elettroni |
Dopo aver riempito le prime cinque file, abbiamo ancora 80 – 54 = 26 elettroni in più da ospitare. Secondo la figura 2.2.2, dobbiamo riempire gli orbitali 6s (2 elettroni), 4f (14 elettroni) e 5d (10 elettroni). Il risultato è la configurazione elettronica del mercurio:
Hg: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10
Hg: 6s2 4f14 5d10
con un sottoguscio 5d pieno, una configurazione del guscio di valenza 6s2 4f14 5d10 e un totale di 80 elettroni. (Dovresti sempre controllare per essere sicuro che il numero totale di elettroni sia uguale al numero atomico.)
Esercizio 2.2.3
Anche se l’elemento 114 non è abbastanza stabile da essere presente in natura, due isotopi dell’elemento 114 furono creati per la prima volta in un reattore nucleare nel 1999 da un team di scienziati russi e americani. Scrivi la configurazione elettronica completa per l’elemento 114.
Risposta: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p2
Le configurazioni elettroniche degli elementi sono presentate nella figura 2.2.3, che elenca gli orbitali nell’ordine in cui sono riempiti. In diversi casi, le configurazioni degli elettroni dello stato fondamentale sono diverse da quelle previste dalla figura 2.2.1. Alcune di queste anomalie si verificano quando gli orbitali 3d sono riempiti. Per esempio, la configurazione elettronica osservata allo stato fondamentale del cromo è 4s1 3d5 piuttosto che quella prevista 4s2 3d4. Allo stesso modo, la configurazione elettronica osservata del rame è 4s1 3d10 invece di s2 3d9. L’attuale configurazione elettronica può essere razionalizzata in termini di una stabilità aggiunta associata ad un sottoguscio mezzo pieno (ns1, np3, nd5, nf7) o pieno (ns2, np6, nd10, nf14). Date le piccole differenze tra i livelli di energia più alti, questa stabilità aggiunta è sufficiente per spostare un elettrone da un orbitale all’altro. Negli elementi più pesanti, altri effetti più complessi possono essere importanti, portando ad alcune delle anomalie aggiuntive indicate nella figura 2.2.3. Per esempio, il cerio ha una configurazione elettronica di 6s2 4f1 5d1, che è impossibile da razionalizzare in termini semplici. Nella maggior parte dei casi, comunque, queste apparenti anomalie non hanno importanti conseguenze chimiche.
Nota
Un’ulteriore stabilità è associata a sottogusci semipieni o pieni.