Az atomok elektronokat nyerhetnek vagy veszíthetnek, hogy ionokat képezzenek az ionizációnak nevezett folyamat során (az így keletkezett vegyületeket ionos vegyületeknek nevezzük). Amikor az ionos vegyületek vízben oldódnak, ionjaik a disszociációnak nevezett folyamat során elválnak egymástól. A víz és sok más kovalens vegyület egyik érdekes tulajdonsága, hogy ezek is képesek ionokra disszociálni. Az ionos vegyületekkel ellentétben, mint például a nátrium-klorid, ezek nem ionizálódnak, mielőtt disszociálnának; az ionizációt és a disszociációt egyszerre hajtják végre.
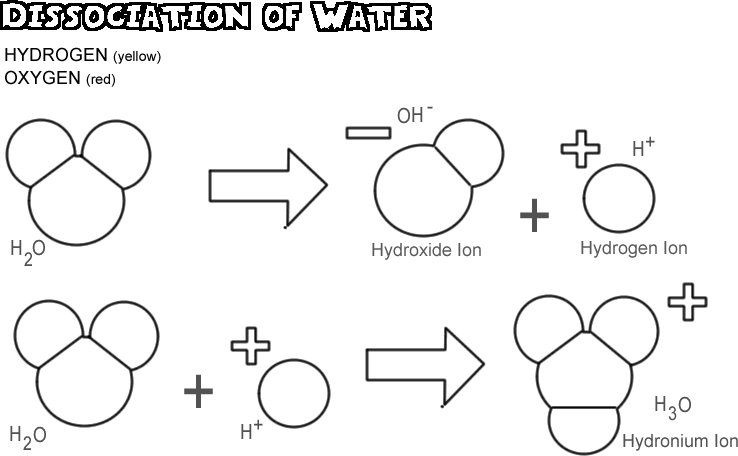
Víz disszociációja
A víz disszociációjakor az egyik hidrogénmag elektronját az oxigénatommal együtt hátrahagyva hidrogénionná alakul, míg az oxigén és a többi hidrogénatom hidroxidionná válik. Mivel a hidrogénionnak nincs elektronja, amely semlegesítené a protonjának pozitív töltését, egy teljes egységnyi pozitív töltéssel rendelkezik, és H+ -ként jelölik. A hidroxidion megtartja a hátrahagyott elektront, és így egy teljes egységnyi negatív töltéssel rendelkezik, amelyet OH- jelképez. A hidrogénion (proton) nem vándorol sokáig önmagában, mielőtt egy második, ionizálatlan vízmolekula oxigénatomjához kapcsolódva hidróniumiont (H3O +)
Bármely vízmintában egyszerre nagyon kevés molekula disszociál: valójában 550 millióból csak körülbelül egy. Van azonban egy állandó változás; ahogy egy hidrogénion újra kapcsolódik egy hidroxidionhoz, hogy vízmolekulát alkosson, egy másik vízmolekula disszociál, hogy az oldatban a hidrogénion és a hidroxidion helyébe lépjen.
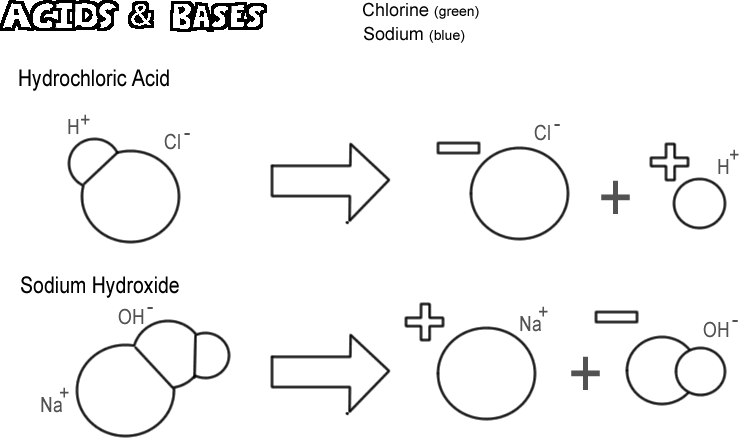
Sósav
Egy bizonyos molekula, ionos és kovalens, úgy disszociál, hogy hidrogéniont bocsát ki anélkül, hogy hidroxidiont bocsátana ki. Ezeket az anyagokat savaknak nevezzük. Mivel a hidrogénion a legtöbb esetben valójában csak egyetlen proton, a kémiai definíció szerint a sav “protondonor”. Ha nagyon sok proton (hidrogénion) “adományozódik”, a hatás nagyon mélyreható lehet, például megégetheti a bőrt vagy feloldhatja a fémet. Az ábrázolt sav a sósav. A tiszta sósav gáz, de vízben könnyen oldódik, és hidrogénionokból és kloridionokból álló oldatot képez. Mivel szinte teljes egészében disszociálódik a vízben, erős savnak nevezik. Azokat a savakat, amelyek nem disszociálnak teljesen, gyenge savaknak nevezzük.
Nátrium-hidroxid
A sav ellentéte a bázis, más néven lúg. Tipikus erős bázis a nátrium-hidroxid, a lúg fő összetevője. A nátrium-hidroxid egy nátriumiont és egy hidroxidiont alkotva disszociál. A bázis definíciója szerint “protonakceptor”. A leggyakoribb bázisok disszociációjuk során hidroxidion keletkezik, és a hidroxidion az, amely a protont befogadja. Egy erős bázis sokkal rosszabb égési sérülést okozhat a bőrnek, mint egy sav.
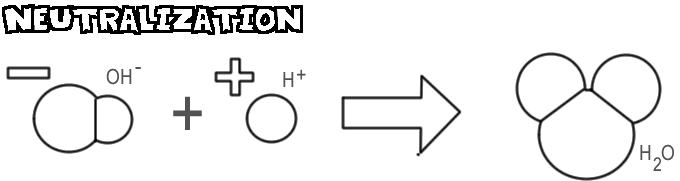
Neutralizáció
Mikor egy bázis és egy sav keveredik, a hidroxidion és a bázis egyesül a sav hidrogénionjával, és víz keletkezik. Ezt a folyamatot nevezzük semlegesítésnek.
Kérdések:
1. Mi történik, amikor egy atom elektronokat nyer vagy veszít?