J Cancer 2020; 11(6):1341-1350. doi:10.7150/jca.40817.
Kutatási közlemény
Amy C. Moreno1, Yan Heather Lin2, Isabelle Bedrosian3, Yu Shen2, Gildy V. Babiera3, Simona F. Shaitelman1 ![]()
![]()
1. Sugáronkológiai Osztály, The University of Texas MD Anderson Cancer Center, Houston, TX.
2. Biostatisztikai Osztály, The University of Texas MD Anderson Cancer Center, Houston, TX.
3. Sebészeti Onkológiai Osztály, The University of Texas MD Anderson Cancer Center, Houston, TX.
Moreno AC, Lin YH, Bedrosian I, Shen Y, Babiera GV, Shaitelman SF. A metaplasztikus versus más emlőrák altípusok kezelését követő kimenetel. J Cancer 2020; 11(6):1341-1350. doi:10.7150/jca.40817. Elérhető: https://www.jcancer.org/v11p1341.htm
Cél: A metaplasztikus emlőrák (BC) a BC egy ritka, de agresszív szövettani altípusa. Arra törekedtünk, hogy azonosítsuk a diagnózisával kapcsolatos tényezőket, és összehasonlítsuk a metaplasztikus BC kezelését és kimenetelét más BC-kkel és különösen a triplanegatív invazív duktális karcinómával, tekintettel arra, hogy milyen gyakran rendelkezik triplanegatív fenotípussal.
Betegek és módszerek: A Nemzeti Rákadatbázisban azonosítottuk a 2010-2014 között invazív BC-vel diagnosztizált nőket, és egyváltozós elemzéssel hasonlítottuk össze a kiindulási beteg- és tumorjellemzőket BC altípusonként. A teljes túlélést (OS) Kaplan-Meier-módszerrel becsültük, és többváltozós Cox-féle arányos kockázati modelleket használtunk az OS független előrejelzőinek azonosítására.
Eredmények: A 247 355 esetből 2084 (0,8%) metaplasztikus BC, 55 998 (23%) tripla negatív BC és 77% egyéb BC volt. A nem metaplasztikus BC-hez képest a metaplasztikus BC-ben szenvedő nők nagyobb valószínűséggel voltak idősebbek a diagnózis felállításakor (medián életkor 62 vs. 59 év), ≥1 társbetegségben szenvedtek (22% vs. 18%) és Medicare-ellátásban részesültek (41% vs. 33%; P<0,001). A metaplasztikus BC-k inkább bazális jellegűek voltak (77%), és a tripla-negatív vagy egyéb BC-khez képest a metaplasztikus BC magasabb klinikai T-státusszal (cT3-4, 18% vs. 11%, 8%), klinikai csomóérintettség hiányával (cN0, 86%, 77%, 80%), nyirokér-invazió hiányával (72%, 65%, 62%) és magas fokú tumorral (71%, 77%, 35%) társult (P<0,001). A legtöbb metaplasztikus BC-t mastectomiával (58%), sentinel nyirokcsomó disszekcióval (65%), mellfal- vagy emlősugárzással (74%) és kemoterápiával (75%) kezelték adjuváns terápiaként (60%). A 44,5 hónapos medián követési idő alatt az OS arány alacsonyabb volt a metaplasztikus BC esetében, mint a tripla-negatív vagy egyéb BC esetében minden klinikai stádiumban 5 év alatt (I. stádium 85%, 87%, 91%, II. 73%, 77%, 87%, III. 43%, 53%, 75%) és 3 év alatt (IV. stádium 15%, 22%, 64%; P<0,001). A többváltozós elemzés során a növekvő életkor, az előrehaladott klinikai stádium, a lymphovascularis invázió, az axillaris (vs. sentinel) csomópont-disszekció, valamint a sugárkezelés vagy kemoterápia mellőzése rosszabb kimenetelhez társult metaplasztikus BC esetén. A műtét kiterjedtsége befolyásolta a túlélést a tripla-negatív és egyéb BC esetében, de a metaplasztikus BC esetében nem.
Következtetés: A metaplasztikus BC kimenetele a modern kezelések ellenére továbbra is rosszabb, mint a többi BC altípusé. A szisztémás terápiás lehetőségek optimalizálása, amely jelentős prediktora volt a túlélésnek, prioritást kell, hogy élvezzen a metaplasztikus BC kezelésében.
Kulcsszavak: metaplasztikus emlőrák, hármas negatív emlőrák, emlőrák kimenetele, sugárkezelés, kemoterápia.
Bevezetés
Bár az emlőrák a nőket érintő leggyakoribb rákdiagnózis, évente több mint 268 000 esetet dokumentálnak, a metaplasztikus emlőrák (BC) az összes emlőrákos eset kevesebb mint 1-2%-át teszi ki. Klinikai szempontból a metaplasztikus BC ultrahangvizsgálaton gyorsan növekvő, összetett echogenitású (azaz szilárd és cisztás komponensekből álló) emlőtömegként, mammográfián pedig nagy sűrűségű tömegként jelentkezik. Histológiailag a metaplasztikus BC a tumorok heterogén populációjából áll, amely a nem mirigyes vagy mesenchymális sejttípusok jelenléte alapján osztályozható, vagy tovább kategorizálható altípusokra a különböző jellemzők, például az osteoclastos óriássejtek vagy orsósejtek jelenléte alapján.
A megjelenéskor a klinikai nyirokcsomó érintettség aránya a metaplasztikus BC-ben jellemzően alacsony. A metaplasztikus BC-t azonban más BC-khez képest nagyobb primer tumorok miatt gyakrabban diagnosztizálják előrehaladott klinikai stádiumban, és nagyobb arányban jár együtt kemorezisztenciával, távoli áttétképződéssel és rosszabb teljes túléléssel (OS). A metaplasztikus BC-ben különösen gyakori a tripla-negatív receptorstátusz vagy az ösztrogénreceptor, a progeszteronreceptor és a humán epidermális növekedési faktor receptor 2 (HER2) amplifikációjának hiánya. Célzott fehérjék nélkül a metaplasztikus BC kezelése továbbra is kihívást jelent. A prospektív adatok korlátozottak a metaplasztikus BC legjobb kezelésének kiválasztásához, tekintettel a diagnózis ritkaságára. Ehelyett a metaplasztikus BC jelenlegi kezelési standardjainak nagy részét egyetlen intézmény kis sorozataiból vagy esetjelentésekből extrapolálták. Ezért a National Cancer Data Base (NCDB) adatbázist használtuk, amely az Egyesült Államokban diagnosztizált összes rákos eset mintegy 70%-át tartalmazza, hogy értékeljük a metaplasztikus BC-ben szenvedő betegek jellemzőit, kezelését és kimenetelét a kezelés és a tumor jellemzői alapján, összehasonlítva a tripla-negatív BC-ben és az összes többi BC altípusban szenvedő betegekkel. Többváltozós elemzést is alkalmaztunk a metaplasztikus BC-ben szenvedő nők túlélésének független előrejelzőinek azonosítására.
Adatok forrása és a kohorsz kiválasztása
Az Amerikai Sebészkollégium Rákbizottsága és az Amerikai Rák Társaság által 1989-ben létrehozott közös projekt, az NCDB az Egyesült Államok mintegy 1500 akkreditált intézményéből gyűjtött onkológiai adatokat, összesen több mint 34 millió rekordot. A rendelkezésre álló betegadatok nem azonosítottak, ezért mentesülnek az intézményi felülvizsgálati bizottság embervédelmi felügyelete alól.
A vizsgálathoz használt kiválasztási kritériumokat az 1. ábra vázolja. A vizsgálatba olyan 18 éves és idősebb nőket vontak be, akiknél 2010 és 2014 között invazív emlőrákot diagnosztizáltak. Az ismeretlen hormon (ösztrogén és progeszteron) receptor (HR) státuszú betegeket kizárták. A kizárás további okai voltak a műtétre, kemoterápiára vagy az American Joint Committee On Cancer (AJCC) 6. vagy 7. kiadása szerinti klinikai stádiumbeosztásra vonatkozó információk hiánya. A betegeket ezután három csoportba sorolták: 1-metaplasztikus BC (8575 vagy 8573 szövettani kóddal), 2- tripla-negatív BC (TNBC, amely csak a nem-metaplasztikus szövettani típusokat tartalmazta), és 3-az összes többi BC-típus. A “nem-metaplasztikus BC” kifejezést a tripla-negatív BC-re és az egyéb BC-re együttesen használtuk.
CONSORT diagram. BC, emlőrák.
 (Kattintson a képre a nagyításhoz.)
(Kattintson a képre a nagyításhoz.)
Változók
Az NCDB-ből nyert és elemzett információk között szerepelt a betegek életkora a diagnózis felállításakor, a diagnózis éve, a faj, a Charlson/Deyo komorbiditási index, az egészségbiztosítási státusz, a háztartás medián jövedelme és a kezelő intézmény típusa (kettéválasztva akadémiai/kutatási és nem akadémiai intézményre). A klinikopatológiai jellemzők közé tartozott az AJCC klinikai T és N (nodális) megjelölés, a teljes AJCC klinikai stádiumcsoport, a HR-státusz, a HER2-receptor-státusz, a tumor fokozat és a lymphovascularis invázió (LVSI). A molekuláris altípusokat HR(+)/HER2(-), HER2(+), hármas negatív (ösztrogénreceptor(-), progeszteronreceptor(-), HER2(-)) vagy ismeretlenként határozták meg. A tripla-negatív receptorstátuszú metaplasztikus BC-ben szenvedő betegeket tn-metaplasztikus BC-ként jelöltük, hogy megkülönböztessük őket a nem-metaplasztikus TNBC-től. Az elsődleges kezelés magában foglalta a műtétet (mellkímélő, masztektómia vagy semmi), a sugárterápiát regionális csomóponti besugárzással vagy anélkül, a kemoterápia alkalmazását (neoadjuváns, adjuváns vagy semmi) és a hormonterápiát. A hónalj sebészi kezelése vagy hónaljcsomó-disszekciónak (ALND) minősült, amikor 10 vagy több nyirokcsomót távolítottak el, vagy őrszem-nyirokcsomó-disszekciónak (SLND), amikor <10 nyirokcsomót távolítottak el.
Statisztikai elemzés
A demográfiai, tumoros és klinikai jellemzők és a metaplasztikus BC diagnózisa közötti lehetséges összefüggések értékelésére univariáns elemzést alkalmaztak, a kategorikus változók esetében chi-négyzet teszteket, a folytonos változók esetében pedig t-tesztet/variációelemzést vagy a nem parametrikus megközelítések megfelelőit (Wilcoxon rank-sum vagy Kruskal-Wallis) használva. Az OS-t a diagnózis felállításának időpontjától a halál időpontjáig tartó időszakként határozták meg. A túlélő betegek OS idejét az utolsó kapcsolatfelvétel időpontjában jobbra cenzúráztuk. Az OS eloszlását a Kaplan-Meier-módszerrel becsültük. A log-rank tesztet használták a csoportok közötti túlélésbeli különbség vizsgálatára. A túlélési adatok regressziós elemzését a Cox-féle arányos kockázati modell alapján végeztük el az OS-re vonatkozóan. A többváltozós Cox-féle arányos veszélyességi modellt úgy kaptuk meg, hogy először bevontuk az egyváltozós elemzésben < 0,05 P-értékkel rendelkező prediktorjelölt változók kezdeti csoportját. Ezután lépésenkénti visszafelé történő eliminációt alkalmaztunk, ahol a Wald chi-négyzet szignifikancia szintje 0,05 volt ahhoz, hogy egy hatás a modellben maradjon.
A túlélési elemzéseket az egyes ráktípusokon belül külön-külön végeztük el.
A metaplasztikus BC modell kiválasztási folyamatába nem vontuk be a létesítmény helyét és típusát, mivel egyik tényező sem volt statisztikailag szignifikáns erre a csoportra az egyváltozós beállításban, és a 40 évnél fiatalabb betegekről nem állt teljes mértékben rendelkezésre adat. Annak feltárása érdekében, hogy a szisztémás terápia és a sugárkezelés részletei befolyásolják-e a metaplasztikus BC-ben szenvedő betegek kimenetelét, részhalmaz-elemzéseket végeztünk ezen a kohorszon, hogy értékeljük a kemoterápia szekvenciájának és a sugárzási célpontok kiterjedésének lehetséges hatását az OS-re. Minden tesztet kétféleképpen végeztünk, és a statisztikai szignifikanciát <0,05 P-értéknek tekintettük. A SAS 9.4-es verziója (SAS Institute, Cary, NC) és az S-Plus 8.2-es verziója (TIBCO Software Inc, Palo Alto, CA) segítségével végeztük el a számításokat minden elemzéshez.
Kohorsz és tumor jellemzői
A 2010-2014 közötti időszakban 247 355 invazív emlőrákot diagnosztizáló nőt azonosítottunk, akiknek 0,8%-a (n=2 084) metaplasztikus BC, 23%-a (n=55 998) TNBC, 77%-a (n=189 273) pedig egyéb BC volt. A betegek szociodemográfiai, klinikai és patológiai tumorjellemzőit és a kezelés jellemzőit BC-típusonként az 1. táblázat mutatja. A medián életkor 63 év (22-90 év közötti tartomány) volt a metaplasztikus BC-ben szenvedő nők esetében és 59 év (18-90 év közötti tartomány) mind a TNBC, mind az egyéb BC esetében. A metaplasztikus BC-ben szenvedő nők gyakrabban rendelkeztek ≥1-es komorbiditási pontszámmal (22% vs. 18% TNBC vs. 16% egyéb BC) és állami biztosítással (50% vs. 42% TNBC vs. 41% egyéb BC) (mindegyik P<0,001). A metaplasztikus BC vagy TNBC diagnózisa gyakrabban járt együtt a fekete bőrszínnel, mint az egyéb BC (18% vs. 21% vs. 11%, P<0,001).
A klinikai betegség stádiumában és a tumor jellemzőiben jelentős különbségek mutatkoztak a rák típusa szerint. A metaplasztikus BC-t gyakran diagnosztizálták előrehaladottabb stádiumban, a metaplasztikus BC-ben szenvedő betegek mindössze 31%-ának volt I. klinikai stádiumú a betegsége, szemben a TNBC 46%-ával és az egyéb BC 54%-ával (P<0,001). Ez a minta korrelálni látszott a nagyobb tumorok magasabb arányával a metaplasztikus BC csoportban (cT3-4, 18% vs. 11% vs. 8%, illetve), de a klinikai csomóérintettség jelenléte a metaplasztikus BC esetében volt a legalacsonyabb (cN1-3, 14% vs. 23% vs. 20%, illetve) (mindegyik P<0,001). A klinikai csomóponti státusszal ellentétben a patológiai csomóponti érintettség aránya kissé alacsonyabb volt a metaplasztikus BC és a TNBC esetében, de megduplázódott az egyéb BC esetében (pN1-3, 18% vs. 26% vs. 40%, illetve, P<0,001). A receptorstátusz tekintetében a metaplasztikus BC csoport 77%-a tn-metaplasztikus BC volt, ami 3,4-szer magasabb, mint a nem-metaplasztikus BC csoporté (23%), amelyből a HR(+)/HER2(-) volt a leggyakoribb molekuláris altípus 59%-kal (P<0,001). Ezenkívül a metaplasztikus BC-nek csak 5%-a volt HER2(+), szemben a nem-metaplasztikus BC 16%-ával. Mind a metaplasztikus BC-ben, mind a TNBC-ben közel kétszer nagyobb volt a 3-as fokozatú daganatok aránya a többi BC-hez képest (71%, 77%, illetve 35%, P<0,001), és a metaplasztikus BC-ben alacsonyabb volt az LVSI aránya a TNBC-hez és a többi BC-hez képest (13%, 20%, illetve 24%, P<0,001).
Betegek és kezelés jellemzői.
| Jellemző | Metaplasztikus BC, No. (%) | Triplán negatív BC, No. (%) | Más BC, No. (%) | Más BC, No. (%) | P Value | |
|---|---|---|---|---|---|---|
| Átlagéletkor, év (tartomány) | 62 (22-90) | 59 (18-90) | 59 (18-90) | <0.001 | ||
| Fajta | ||||||
| Fehér | 1623 (77.9) | 41791 (74.6) | 158406 (83.7) | <0.001 | ||
| Fekete | 368 (17.7) | 11771 (21) | 20722 (10.9) | |||
| Egyéb | 80 (3.8) | 2041 (3.6) | 8507 (4.5) | |||
| Ismeretlen | 13 (0.6) | 395 (0.7) | 1638 (0.9) | |||
| Komorbiditási pontszám | ||||||
| 0 | 1635 (78.5) | 45882 (81.9) | 158177 (83.6) | <0.001 | ||
| 1 | 349 (16.7) | 8107 (14.5) | 25524 (13.5) | |||
| >=2 | 100 (4.8) | 2009 (3.6) | 5572 (2.9) | |||
| Általános jövedelem | ||||||
| <30,000$ | 251 (12) | 7110 (12.7) | 19154 (10.) | <0.001 | ||
| $30,000-$34,999 | 332 (15.9) | 9081 (16.2) | 28472 (15) | |||
| $35,000-$45,999 | 580 (27.8) | 15084 (26.9) | 48845 (25.8) | |||
| $46,000+ | 858 (41.2) | 23050 (41.2) | 86637 (45.8) | |||
| Ismeretlen | 63 (3) | 1673 (3) | 6165 (3.3) | |||
| Kórházi biztosítás | ||||||
| Magán | 975 (46.8) | 30263 (54) | 105839 (55.9) | <0.001 | ||
| Medicaid | 154 (7.4) | 4716 (8.4) | 13267 (7) | |||
| Medicare | 862 (41.4) | 18355 (32.8) | 61535 (32.5) | |||
| Egyéb | 19 (0.9) | 665 (1.2) | 2212 (1.2) | |||
| Nem biztosított | 43 (2.1) | 1422 (2.5) | 4163 (2.2) | |||
| Ismeretlen | 31 (1.5) | 577 (1) | 2257 (1.2) | |||
| Megyei típus | ||||||
| Metropolitan | 1720 (82.5) | 46252 (82.6) | 157058 (83) | 0.152 | ||
| Városi | 271 (13) | 7456 (13.3) | 24367 (12.9) | |||
| Vidéki | 43 (2.1) | 951 (1.7) | 3219 (1.7) | |||
| Ismeretlen | 50 (2.4) | 1339 (2.4) | 4629 (2.4) | |||
| Facility type | ||||||
| Academic | 668 (32.1) | 16117 (28.8) | 52120 (27.5) | <0.001 | ||
| Nem akadémiai | 1318 (63.2) | 35472 (63.3) | 126101 (66.6) | |||
| Ismeretlen | 98 (4.7) | 4409 (7.9) | 11052 (5.8) | |||
| Műhely helye | ||||||
| Középnyugat | 614 (29.5) | 14132 (25.2) | 46644 (24.6) | <0.001 | ||
| Északkelet | 410 (19.7) | 10411 (18.6) | 37787 (20) | |||
| Dél | 716 (34.4) | 20595 (36.8) | 66519 (35.1) | |||
| Nyugat | 246 (11.8) | 6451 (11.5) | 27271 (14.4) | |||
| Ismeretlen | 98 (4.7) | 4409 (7.9) | 11052 (5.8) | |||
| Klinikai betegség stádium | ||||||
| I | 639 (30.7) | 25843 (46.1) | 102257 (54) | <0.001 | ||
| II | 1215 (58.3) | 23912 (42.7) | 70846 (37.4) | |||
| III | 201 (9.6) | 5579 (10) | 14283 (7.5) | |||
| IV | 29 (1.4) | 664 (1.2) | 1887 (1) | |||
| Klinikai T-státusz | ||||||
| cT0 | 5 (0.2) | 131 (0.2) | 341 (0.2) | <0.001 | ||
| cT1 | 674 (32.3) | 28452 (50.8) | 113113113 (59.8) | |||
| cT2 | 1026 (49.2) | 21530 (38.4) | 61145 (32.3) | |||
| cT3 | 252 (12.1) | 3702 (6.6) | 10061 (5.3) | |||
| cT4 | 127 (6.1) | 2183 (3.9) | 4613 (2.4) | |||
| Klinikai N státusz | ||||||
| cN0 | 1787 (85.7) | 43357 (77.4) | 150890 (79.7) | <0.001 | ||
| cN1 | 224 (10.7) | 9659 (17.2) | 30427 (16.1) | |||
| cN2 | 51 (2.4) | 1804 (3.2) | 5414 (2.9) | |||
| cN3 | 22 (1.1) | 1178 (2.1) | 2542 (1.3) | |||
| Patológiai stádium | ||||||
| 0 | 45 (2.2) | 4314 (7.7) | 5361 (2.8) | <0.001 | ||
| 1 | 582 (27.9) | 24787 (44.3) | 81680 (43.2) | |||
| 2 | 1223 (58.7) | 20790 (37.1) | 72445 (38.3) | |||
| 3 | 210 (10.1) | 5675( 10.1) | 28323 (15) | |||
| 4 | 24 (1.2) | 432 (0.8) | 1464 (0.8) | |||
| Patológiai T-státusz | ||||||
| pTis | 7 (0.3) | 432 (0.8) | 1862 (1) | <0.001 | ||
| pT0 | 42 (2) | 4250 (7.6) | 3972 (2.1) | |||
| pT1 | 634 (30.4) | 29055 (51.9) | 106130 (56.1) | |||
| pT2 | 1017 (48.8) | 18530 (33.1) | 63484 (33.5) | |||
| pT3 | 290 (13.9) | 2540 (4.5) | 10588 (5.6) | |||
| pT4 | 93 (4.5) | 1097 (2) | 2892 (1.5) | |||
| pTX | 1 (0) | 94 (0.2) | 345 (0.2) | |||
| Patológiai N státusz | ||||||
| pN0 | 1705 (81.9) | 41587 (74.3) | 113787 (60.2) | <0.001 | ||
| pN1 | 284 (13.6) | 9725 (17.4) | 51483 (27.2) | |||
| pN2 | 66 (3.2) | 3031 (5.4) | 16111 (8.5) | |||
| pN3 | 27 (1.3) | 1607 (2.9) | 7685 (4.1) | |||
| Receptorcsoportosítás | ||||||
| HR(+)/HER2(-) | 334 (16) | 0 (0) | 143687 (75.9) | <0.001 | ||
| Triplán negatív | 1604 (77) | 55998 (100) | 0 (0) | |||
| HER2(+) | 97 (4.7) | 0 (0) | 38726 (20.5) | |||
| Ismeretlen | 49 (2.4) | 0 (0) | 6860 (3.6) | |||
| Tumorfok | ||||||
| 1 | 41 (2) | 988 (1.8) | 32015 (16.9) | <0.001 | ||
| 2 | 237 (11.4) | 9050 (16.2) | 80590 (42.6) | |||
| 3 | 1485 (71.3) | 42930 (76.7) | 65482 (34.6) | |||
| 4 | 37 (1.8) | 286 (0.5) | 438 (0.2) | |||
| Ismeretlen | 284 (13.6) | 3030 (5.4) | 11186 (5.9) | |||
| LVSI | ||||||
| Nincs jelen | 1505 (72.2) | 36400 (65) | 118082 (62.4) | <0.001 | ||
| Jelen | 263 (12.6) | 11091 (19.8) | 45681 (24.1) | |||
| Ismeretlen | 316 (15.2) | 8507 (15.1) | 25510 (13.4) | |||
| Műtét típusa | ||||||
| BCS | 876 (42) | 29142 (52) | 92022 (48.6) | <0.001 | ||
| Masztektómia | 1200 (57.6) | 26561 (47.4) | 95910 (50.7) | |||
| Nincs műtét | 8 (0.4) | 295 (0.5) | 1341 (0.7) | |||
| Axilláris műtét | ||||||
| Nincs műtét | 47 (2.3) | 1034 (1.8) | 4433 (2.3) | <.001 | ||
| SLND | 1353 (64.9) | 34880 (62.3) | 109718 (58) | |||
| ALND | 666 (32) | 19229 (34.3) | 73181 (38.7) | |||
| Ismeretlen | 18 (0.9) | 855 (1.5) | 1941 (1) | |||
| Sugárkezelés | ||||||
| Igen | 1087 (52.2) | 33938 (60.6) | 109268 (57.7) | <.001 | ||
| Nem | 989 (47.5) | 21860 (39) | 79375 (41.9) | |||
| Ismeretlen | 8 (0.4) | 200 (0.4) | 630 (0.3) | |||
| Sugárzási célpontok | ||||||
| Csak emlő/CW | 803 (73.9) | 24704 (72.8) | 72410 (66.3) | <0.001 | ||
| Mell/CW + Regionális csomópontok | 284 (26.1) | 9234 (27.2) | 36858 (33.7) | |||
| Kemoterápia | ||||||
| Igen | 1571 (75.4) | 44321 (79.1) | 133965 (70.8) | <0.001 | ||
| Nem | 499 (23.9) | 11195 (20) | 53062 (28) | |||
| Ismeretlen | 14 (0.7) | 482 (0.9) | 2246 (1.2) | |||
| Kémoterápia-műtét szekvencia | ||||||
| Adjuváns | 1241 (59.5) | 31519 (56.3) | 116645 (61.6) | <0.001 | ||
| Neoadjuváns | 324 (15.5) | 12581 (22.5) | 16717 (8.8) | |||
| Nincs | 519 (24.9) | 11898 (21.2) | 55911 (29.5) | |||
| Hormonterápia | ||||||
| Igen | 220 (10.6) | 1178 (2.1) | 103906 (54.9) | <0.001 | ||
| Nem | 1798 (86.3) | 53274 (95.1) | 76820 (40.6) | |||
| Ismeretlen | 66 (3.2) | 1546 (2.8) | 8547 (4.5) | |||
| A diagnózis éve | ||||||
| 2010 | 309 (14.8) | 9605 (17.2) | 36712 (19.4) | <0.001 | ||
| 2011 | 393 (18.9) | 11163 (19.9) | 38815 (20.5) | |||
| 2012 | 458 (22) | 11205 (20) | 39364 (20.8) | |||
| 2013 | 463 (22.2) | 11992 (21.4) | 37764 (20) | |||
| 2014 | 461 (22.1) | 12033 (21.5) | 36618 (19.3) |
Rövidítések:
Abröv: BC, emlőrák; ALND, axillaris nyirokcsomó disszekció; BCS, emlő konzerváló műtét; CW, mellkasfal; HER2, humán epidermális növekedési faktor receptor; HR, hormonreceptor; LVSI, lymphovascularis invázió; SLND, sentinel nyirokcsomó disszekció.
A kezelés az emlőrák típusa szerint
A legtöbb beteg (99%) onkológiai emlőműtéten esett át, beleértve az axilla sebészi értékelését is (97%). A masztektómiát gyakrabban alkalmazták a metaplasztikus BC csoportban (58% vs. 47% TNBC vs. 51% egyéb BC, P<0,001), akárcsak az SLND-t (65% vs. 62% TNBC vs. 58% egyéb BC; P<0,001). A regionális csomóponti besugárzást gyakrabban alkalmazták a kezelés részeként egyéb BC esetében, mint metaplasztikus BC és TNBC esetében (26%, 27%, illetve 34%; P<0,001).
A szisztémás terápia tekintetében a neoadjuváns kemoterápiát majdnem kétszer olyan gyakran alkalmazták metaplasztikus BC és TNBC esetében, mint egyéb BC esetében (16%, 23%, 9%; P<0,001), és a nők körülbelül egynegyede nem kapott kemoterápiát. Hormonterápiát a TNBC esetében alkalmaztak a legritkábban (2%), de a metaplasztikus BC 11%-ánál és az egyéb BC esetek 55%-ánál a kezelési paradigma részét képezte.
Túlélési elemzés
A követési idő mediánja 44,5 hónap volt. A metaplasztikus BC-ben szenvedő betegeknek klinikai stádiumtól függetlenül szignifikánsan rosszabb volt a korrigálatlan OS (2. ábra). A metaplasztikus BC, TNBC és egyéb BC betegek 5 éves OS becsült értékei az I. stádiumú betegség esetén 85%, 87% és 91%, a II. stádiumúaké 73%, 77% és 87%, a III. stádiumúaké pedig 43%, 53% és 75% volt (P<0,001). A metasztatikus betegségben szenvedő betegek 3 éves OS-aránya 2-4-szer magasabb volt a TNBC és az egyéb BC csoportokban, 30% és 64%, szemben a metaplasztikus BC 15%-ával (P<0,001). A túlélést molekuláris altípusok szerint is elemezték (3. ábra). A metaplasztikus BC-ben szenvedő betegek körében a molekuláris altípus (HR(+)/HER2(-), HER2(+) vagy tn-metaplasztikus BC) szerint nem mutatkozott különbség az OS-ben (P=0,778). Ezzel szemben a nem-metaplasztikus BC esetében a tripla-negatív altípus rosszabb OS-hez társult, mint a HER+ és a HR(+)/HER2(-) altípusok (P<0,001). A metaplasztikus BC-ben szenvedő betegek körében a faji hovatartozás szintén nem tűnt összefüggésbe hozhatónak a túléléssel (5 éves OS arány 73% a fehéreknél vs. 74% a feketéknél, P=0,876), míg a TNBC (P<0,001) és az egyéb BC csoportokban (P<0,001; 4. ábra).
A mellrák típusok összesített túlélési görbéi klinikai stádium szerint, a metaplasztikus, tripla negatív és egyéb emlőrákokat vizsgálva. Rövidítés:
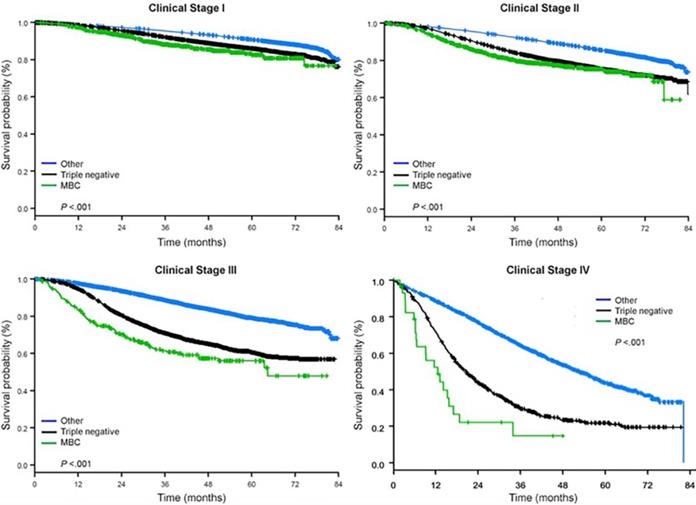 (Kattintson a képre a nagyításhoz.)
(Kattintson a képre a nagyításhoz.)
A metaplasztikus és nem metaplasztikus emlőrákos betegek teljes túlélési görbéi receptorstátusz szerint rétegezve. Abbreviations:
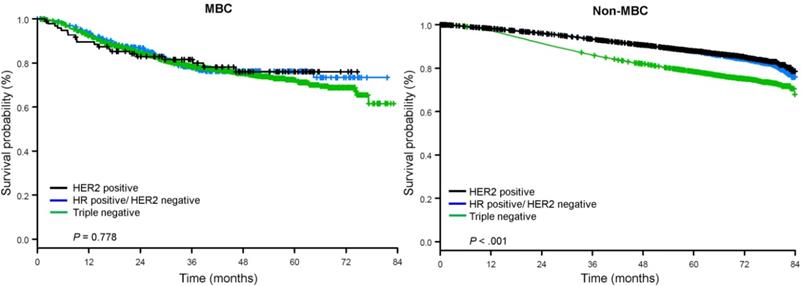 (Kattintson a képre a nagyításhoz.)
(Kattintson a képre a nagyításhoz.)
A metaplasztikus, tripla negatív és egyéb emlőrákos betegek összesített túlélési görbéi faj szerint rétegezve. Rövidítések:
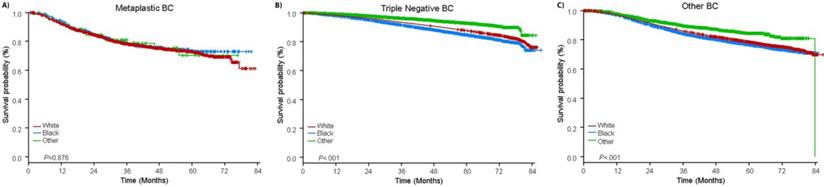 (Kattintson a képre a nagyításhoz.)
(Kattintson a képre a nagyításhoz.)
A metaplasztikus BC-ben szenvedő betegek teljes túlélésével összefüggő tényezők többváltozós elemzése.
| A teljes túléléssel összefüggő tényezők metaplasztikus BC-ben | ||||
|---|---|---|---|---|
| Változó (referencia) | Veszélyességi arány (95%-os konfidenciaintervallum) | P-érték | ||
| Kor | Egy év növekedés | 1.024 (1.015-1.033) | <0.0001 | |
| Lymphovascularis invázió (nincs) | Előfordul | 1.307 (1.017-1.679) | 0.0364 | |
| Klinikai N státusz (cN0) | cN+ | 1.758 (1.328-2.326) | <0.0001 | |
| Klinikai T-státusz (cT1) | cT0 | 2,226 (0,301-16).447) | <0,0001 | |
| cT2 | 1,454 (1,102-1).918) | |||
| cT3 | 3.029 (2.183-4.204) | |||
| cT4 | 3.145 (2.124-4.657) | |||
| Klinikai M státusz (cM0) | cM1 | 3.330 (2.020-5.488) | <0.0001 | |
| Axilláris sebészet (SLND) | ALND | 1.333 (1.065-1.670) | 0.0247 | |
| No Surgery | 1.538 (0.884-2.675) | |||
| Sugárzás (Nem) | Igen | 0.709 (0.572-0.878) | 0.0016 | |
| Kémoterápia (Nem) | Igen | 0.579 (0.446-0.752) | <0.0001 | |
Abröv:
A többváltozós elemzés során a növekvő életkor, a magasabb klinikai T besorolás, a klinikai csomóponti betegség vagy LVSI jelenléte és az ALND kezelés mind rosszabb kimenetellel korrelált a metaplasztikus BC, TNBC és egyéb BC betegek esetében (1. kiegészítő táblázat). A kemoterápia és a sugárkezelés kiegészítése függetlenül javította az OS-t, függetlenül az emlőrák típusától. A TNBC és egyéb BC esetében a túléléssel összefüggésbe hozott egyéb beteg- és tumorjellemzők, beleértve a rassz, a társbetegségek és a tumor fokozatát, a többváltozós elemzés során nem voltak kapcsolatban a metaplasztikus BC túlélési eredményeivel.
A metaplasztikus BC-ben szenvedő betegek viszonylag rossz kimenetele miatt alcsoportos elemzéseket végeztek a metaplasztikus BC csoporton annak felmérésére, hogy a kezelési módok összefüggésbe hozhatók-e a jobb kimenetellel. A csomóstátusz (cN0 vs. N+) szerinti korrekciót követően az agresszívabb axilláris műtéttel (ALND vs. SLND) történő kezelés rosszabb kimenetellel járt együtt, és ez a jelenség a TNBC és más BC esetében is megfigyelhető volt (2. táblázat). A sugárkezelésben részesülők közül a regionális csomóponti besugárzással vs. csak mell- vagy csak mellfal besugárzással történő kezelés nem befolyásolta szignifikánsan a kimeneteleket a metaplasztikus BC-ben szenvedő betegek körében (P=0,077 és 0,200 a klinikai N0 és N+ esetében). A neoadjuváns kemoterápia rosszabb kimenetellel járt, mint az adjuváns kemoterápia a klinikailag csomópont-negatív metaplasztikus BC-ben szenvedő betegek körében (HR 1,9, 95% CI 1,3-2,6, P<0.001), de nem a klinikailag csomópozitív metaplasztikus BC-ben szenvedők esetében (P=0,43).
Diszkusszió
A metaplasztikus emlőrák az emlőrák ritka, de különösen agresszív formája, különösen más emlőtumor-altípusokkal összehasonlítva. Ez a betegségentitás viszonylag alulreprezentált az irodalomban. Rayson és munkatársai 1966 és 1997 közötti publikációk átfogó keresése összesen csak 27 esetet tárt fel. Az olyan nagy nemzeti adatbázisok, mint az NCDB, előnyösek az olyan ritka rákos megbetegedések tanulmányozásához, mint a metaplasztikus BC. A metaplasztikus BC diagnózisának előfordulása azonban az Egyesült Államokban ezen adatbázisok szerint még mindig alacsony, évente kevesebb mint 500 eset. Tanulmányunkban azt találtuk, hogy a metaplasztikus BC-t leggyakrabban nagyméretű tumorként diagnosztizálták, olyan kedvezőtlen kockázati jellemzőkkel, mint a rosszul differenciált tumor fokozat és a tripla-negatív receptorstátusz. A metaplasztikus BC-ben szenvedő betegek túlélése a megjelenéskori stádiumtól függetlenül szignifikánsan rosszabb volt a tripla-negatív és egyéb BC-vel összehasonlítva. A kemoterápia és a sugárkezelés független előrejelzője volt a jobb OS-nek, de úgy tűnt, hogy a kemoterápia szekvenciája befolyásolja az eredményeket, különösen a metaplasztikus BC-ben szenvedő, klinikai csomóponti érintettség nélküli betegek esetében, elismerve, hogy e betegek egy részének patológiai csomóponti érintettsége volt. Eredményeink azonban tükrözhetik a mögöttes biológiai mechanizmusok lehetséges heterogenitását, amelyek a BC-betegek e speciális csoportjában a kezelésekre adott válaszokat irányítják, és rávilágítanak a jobb kockázati rétegzés és a szisztémás terápiás lehetőségek szükségességére az eredmények javítása érdekében.
Noha a legtöbb metaplasztikus BC triplán negatív fenotípusú, a metaplasztikus BC viselkedése egyedülállónak tűnik a többi TNBC-hez képest. A TNBC általában rosszabb prognózissal rendelkezik, mint a többi BC-típus, és azt az elképzelést, hogy a metaplasztikus BC agresszívabb, mint a TNBC, több kisebb, retrospektív vizsgálat is alátámasztotta. Az ilyen tanulmányok a metaplasztikus BC és a TNBC esetében az előrehaladott stádiumban történő diagnózis hasonló mintázatát mutatták ki, ami inkább a cT3-4-es betegség magasabb arányának, mint a csomópontok érintettségének köszönhető, és a metaplasztikus BC 46 esetének egyetlen intézményben történő áttekintése során a metaplasztikus BC-ben szenvedő betegeknél szignifikánsan nagyobb volt a betegség helyi kiújulásának kockázata (30% vs. 15%; P=0,004). Ezek a jellemzők végül rosszabb 5 éves betegségmentes túlélési rátával (30% vs. 90%; P<0,001) és OS rátával (65% vs. 87%; P=0,002) korreláltak a metaplasztikus BC-ben szenvedő betegek esetében a TNBC-hez képest. Egy 1112 metaplasztikus BC-s betegre kiterjedő Surveillance Epidemiology and End Results vizsgálat szintén rosszabb rák-specifikus túlélési arányt mutatott 3 év alatt a metaplasztikus BC esetében, mint a TNBC esetében (78% vs. 84%). A tn-metaplasztikus BC vizsgálatakor Li és munkatársai rosszabb betegségmentes túlélést (HR 1,48, 95% CI 1,19-1,84, P<0,01) és OS-t (HR 1,42 ; P<,01) találtak a tn-metaplasztikus BC esetében a TNBC-hez képest. Vizsgálatunk, amely a metaplasztikus BC-ben szenvedő betegek eddigi egyik legnagyobb csoportját foglalta magában (n=2 084), megerősíti ezeket az eredményeket, és kiemeli, hogy a receptorstátusz nem független előrejelzője a túlélésnek a metaplasztikus BC esetében (P=0.778), mint a nem metaplasztikus BC esetében.
A vizsgálatunkban szereplő valamennyi metaplasztikus BC-beteg esetében a kemoterápia alkalmazása (HR 0,58, 95% CI 0,45-0,75, P<0,001) kritikus terápiás komponens, amely a jobb kimenetelhez társult. Tudomásunk szerint jelentésünk az első, amely a kemoterápia szekvenciája alapján számol be a metaplasztikus BC kimeneteléről. Szembetűnő, hogy alelemzésünk szerint különösen a cN0 metaplasztikus BC-ben szenvedő betegek esetében a neoadjuváns kemoterápia rosszabb OS-sel járt az adjuváns kemoterápiához képest (HR 1,88, 95% CI 1,34-2,64, P<0,001), míg a kemoterápia szekvenálása nem volt hatással a klinikailag csomópozitív metaplasztikus BC-re. Ennek egyik lehetséges magyarázata az lehet, hogy metaplasztikus BC-ben szenvedő betegeinknek magasabb volt a klinikai T-státusuk, ami más jelentésekben a patológiai teljes válasz alacsonyabb arányával és az azt követő rosszabb túlélési eredményekkel hozható összefüggésbe. Ezenkívül a klinikai stádiumbeosztási módszerek (pl. csak fizikális vizsgálat, ultrahangvizsgálat beépítése) heterogenitást vezethetnek be a klinikai N0 populációban azáltal, hogy a valódi csomóponti betegségterhelés hiányzik, ami önmagában is rosszabb kimenetellel járhat. Összességében a metaplasztikus BC neoadjuváns kemoterápiára adott válasza a jelentések szerint mindössze 18%, ami jóval alacsonyabb, mint a TNBC esetében az antraciklin- és taxánalapú kemoterápiás kezelésekre adott válaszok ismert aránya.
A tanulmányunkban és más jelentésekben megfigyelt rosszabb túlélés és a távoli metasztatikus terjedés viszonylag gyors fejlődése alapján a metaplasztikus BC esetében egyértelműen nyilvánvaló a jobb szisztémás terápiás lehetőségek szükségessége más emlőrák altípusokhoz képest. A transzkripciós profilalkotás kimutatta, hogy ez a daganatos altípus tumorigén szignatúrát mutat őssejt-szerű jellemzőkkel, gyakori aberrációkkal a PI3K/AKT/mTOR útvonalban és a vaszkuláris endoteliális növekedési faktor (VEGF) túlzott expressziójával. Ezek a jellemzők hasonlóak a mesenchymális TNBC-kben találtakhoz. Ígéretes erőfeszítések folynak az alternatív szisztémás terápiás sémák azonosítására ezen betegek számára, beleértve egy nemrégiben végzett I. fázisú vizsgálatot, amely a liposzómás doxorubicin, a bevacizumab (VEGF-A elleni monoklonális antitest) és az everolimus (mTOR-gátló) jobb objektív válaszarányát mutatta ki a PI3K-útvonal-aberrációval rendelkező metaplasztikus TNBC-ben szenvedő betegeknél.
A helyi kezelések tekintetében vizsgálatunkban a masztektómiát gyakrabban alkalmazták metaplasztikus BC esetén, de ez nem járt jobb túléléssel a mellkímélő műtéthez képest. Szintén nem találtunk túlélési előnyt az ALND-t magában foglaló kezelésből az SLND-vel szemben. A sugárkezelés azonban jelentős túlélési előrejelző tényező volt, az adjuváns sugárkezeléssel kezelt metaplasztikus BC-s betegek 30%-kal kisebb valószínűséggel haltak meg, mint azok, akik nem kaptak sugárkezelést. A sugárterápiás elemzésünk releváns korlátai közé tartoznak a kezelés tervezésével, a kiválasztott modalitással, a minőségbiztosítással, illetve azzal kapcsolatos ismeretlen részletek, hogy alkalmaztak-e olyan technikákat, mint például a mély inspirációs légzéstartás. Bár az NCDB-ben a lokoregionális kiújulást nem lehet vizsgálni, egy 113 metaplasztikus BC-ben szenvedő (54%-ban sugárkezelésben részesült) betegből álló intézményi sorozat azt mutatta, hogy a sugárkezelés volt az egyetlen olyan tényező, amely korrelált a csökkent lokoregionális kiújulással (relatív kockázat sugárkezelés nélkül 3.1; 95% CI 1,13-9,88, P=0,027).
Eredményeinket óvatosan kell értelmezni, tekintettel azokra a jelentős korlátokra, hogy nem tudjuk, milyen kemoterápiás kezeléseket alkalmaztak, a kezelések időtartamát vagy a neoadjuváns kemoterápiára adott választ, mivel ezek az információk nem állnak rendelkezésre az NCDB-ben. Elismerjük továbbá az NCDB-ben rögzített klinikai-patológiai kockázati tényezők korlátait, amelyek nélkül nem biztos, hogy teljes mértékben jellemezhetőek azok a klinikai különbségek, amelyek az általunk talált kimenetelbeli különbségek némelyikének hátterében állnak, például az ALND rosszabb túlélési eredményei még a nyirokcsomó-státusz ellenőrzése esetén is. Bár a metaplasztikus BC-s betegekből álló mintánk mérete kicsi volt a nem metaplasztikus BC-s vizsgálatokhoz képest, paradox módon ez valószínűleg az eddigi legnagyobb létező tanulmány, amely ezt a kérdést vizsgálja, tekintettel az intézményi sorozatokban jelentett metaplasztikus BC-s betegek korlátozott számára. További vizsgálatokra van szükség a metaplasztikus BC metasztatikus terjedésének biológiai hajlamának megértéséhez, és megállapításaink validálásához a metaplasztikus BC-betegek külön adathalmazaiban.
A jelenlegi standard ellátásunk nyilvánvalóan nem megfelelő ennek az egyedülálló rákpopulációnak, és a metaplasztikus BC-re vonatkozó randomizált adatok megszerzése a jövőben a kis betegszám miatt együttműködési erőfeszítéseket igényel. Az NCDB figyelemre méltó erőssége, hogy egy ritka diagnózissal kapcsolatos kezelési mintákat és kimeneteleket tanulmányozhatunk. Azzal, hogy ebben a kohorszban 2084 metaplasztikus BC-ben szenvedő egyén szerepel, ez az egyik legnagyobb metaplasztikus BC-vizsgálat, amelyről a modern korban beszámoltak. Ezeknek a betegeknek a túlélése bármely más BC-típusban szenvedőkhöz képest rossz, és bár ez a tény valószínűleg az agresszív terápia beiktatására késztet, tanulmányunk azt sugallja, hogy a kiterjedtebb lokális-regionális kezelést (pl. ALND vagy regionális csomóponti besugárzás) esetről esetre gondosan meg kell fontolni. Összességében a metaplasztikus BC kezelésében a szisztémás terápia alkalmazása a csomóterheléstől függetlenül kulcsfontosságú, és a tumorgenomikai profilelemzésen alapuló hatékony célzott terápiák kifejlesztése ígéretesnek tűnik a jövőre nézve.
Kiegészítő anyag
![]()
Kiegészítő táblázat.
Köszönet
Külön köszönet Christine Wogannak a szerkesztői segítségért.
Finanszírozás
Részben a National Cancer Institute, National Institutes of Health által a The University of Texas MD Anderson Cancer Center részére nyújtott Cancer Center Support (Biostatistics Core) Grant CA016672 támogatással.
Competing Interests
A szerzők úgy nyilatkoztak, hogy nem állnak fenn konkurens érdekek.
1. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA Cancer J Clin. 2018;68(1):7-30
2. Yerushalmi R, Hayes MM, Gelmon KA. Mellkarcinóma-ritkaságok: az irodalom áttekintése. Ann Oncol. 2009;20(11):1763-1770
3. Günhan-Bilgen I, Memiş A, Ustün EE, Zekioglu O, Ozdemir N. Metaplastic carcinoma of the breast: clinical, mammographic, and sonographic findings with histopathologic correlation. AJR Am J Roentgenol. 2002;178(6):1421-1425
4. Jung S-Y, Kim HY, Nam B-H. et al. A metaplasztikus emlőrákos betegek rosszabb prognózisa, mint a többi tripla-negatív emlőrákos betegé. Breast Cancer Res Treat. 2010;120(3):627-637
5. Wargotz ES, Norris HJ. Az emlő metaplasztikus karcinómái: V. Metaplasztikus karcinóma oszteoklasztikus óriássejtekkel. Hum Pathol. 1990;21(11):1142-1150
6. Wargotz ES, Norris HJ. Az emlő metaplasztikus karcinómái. I. Mátrixot termelő karcinóma. Hum Pathol. 1989;20(7):628-635
7. Wargotz ES, Deos PH, Norris HJ. Az emlő metaplasztikus karcinómái. II. Orsósejtes karcinóma. Hum Pathol. 1989;20(8):732-740
8. Lee H, Jung S-Y, Ro JY. et al. Metaplasztikus emlőrák: klinikopatológiai jellemzők és prognózisa. J Clin Pathol. 2012;65(5):441-446
9. He X, Ji J, Dong R. et al. Prognosis in different subypes of metaplastic breast cancer: a population-based analysis. Breast Cancer Res Treat. Október. 2018
10. Nemzeti rákadatbázis.
11. Chagpar AB, Scoggins CR, Martin RCG. et al. Factors Determining Adequacy of Axillary Node Dissection in Breast Cancer Patients. Breast J. 2007;13(3):233-237
12. Breast J. 2007;13(3):233-237
. Bembenek A, Schlag PM. A nyirokcsomó-dissectio emlőrákban. Langenbeck’s Arch Surg. 2000;385(4):236-245
13. Langenbeck’s Arch Surg. 2000;385(4):236-245
. Woolson RF. Statistical Methods for the Analysis of Biomedical Data. New York, USA: John Wiley & Sons. 1987
14. Kaplan EL, Meier P. Nemparametrikus becslés hiányos megfigyelésekből NONPARAMETRIC ESTIMATION FROM INCOMPLETE OBSERVATIONS*. Forrás J Am Stat Assoc. 1958;53(282):457-481
15. J Am Stat Assoc. 1958;53(282):457-481
. Mantel N. Túlélési adatok kiértékelése és a figyelembevételük során felmerülő két új rangsor-statisztika. Cancer Chemother Rep. 1966;50(3):163-170
16. Cancer Chemother Rep. 1966;50(3):163-170
. D. R. C. Regressziós modellek és élettáblák. Cox élettáblák. 1972;2:187-220
17. Rayson D, Adjei AA, Suman VJ, Wold LE, Ingle JN. Metaplasztikus emlőrák: prognózis és válasz a szisztémás terápiára. Ann Oncol Off J Eur Soc Med Oncol. 1999;10(4):413-419
18. Bilimoria KY, Stewart AK, Winchester DP, Ko CY. A Nemzeti Rákadatbázis: erőteljes kezdeményezés a rákellátás javítására az Egyesült Államokban. Ann Surg Oncol. 2008;15(3):683-690
19. Ong CT, Campbell BM, Thomas SM. et al. Metaplasztikus emlőrák kezelése és kimenetele 2500 betegnél: A Retrospective Analysis of a National Oncology Database. Ann Surg Oncol. 2018;25(8):2249-2260
20. Dietze EC, Sistrunk C, Miranda-Carboni G, O’Regan R, Seewaldt VL. Hármas negatív emlőrák afroamerikai nőknél: egyenlőtlenségek kontra biológia. Nat Rev Cancer. 2015;15(4):248-254
21. Rakha EA, El-Sayed ME, Green AR, Lee AHS, Robertson JF, Ellis IO. Prognosztikai markerek tripla-negatív emlőrákban. Cancer. 2007;109(1):25-32
22. ROJAS K, STUCKEY A. Az emlőrák epidemiológiája és kockázati tényezői. Clin Obstet Gynecol. 2016;59(4):651-672
23. Liao H-Y, Zhang W-W, Sun J-Y, Li F-Y, He Z-Y, Wu S-G. A különböző szövettani altípusok klinikopatológiai jellemzői és túlélési eredményei a tripla-negatív emlőrákban. J Cancer. 2018;9(2):296-303
24. El Zein D, Hughes M, Kumar S. et al. Az emlő metaplasztikus karcinómája agresszívabb, mint a tripla-negatív emlőrák: A Study From a Single Institution and Review of Literature. Clin Breast Cancer. 2017;17(5):382-391
25. Liedtke C, Mazouni C, Hess KR. et al. A neoadjuváns terápiára adott válasz és a hosszú távú túlélés tripla-negatív emlőrákos betegeknél. J Clin Oncol. 2008;26(8):1275-1281
26. Cortazar P, Zhang L, Untch M. et al. Pathological complete response and long-term clinical benefit in breast cancer: the CTNeoBC pooled analysis. Lancet. 2014;384(9938):164-172
27. Fisher B, Brown A, Mamounas E. et al. Effect of preoperative chemotherapy on local-regional disease in women with operable breast cancer: findings from National Surgical Adjuvant Breast and Bowel Project B-18. J Clin Oncol. 1997;15(7):2483-2493
28. Chen IC, Lin CH, Huang CS. et al. A szisztémás kemoterápia hatékonyságának hiánya az emlő metaplasztikus karcinómájának kezelésében a modern korban. Breast Cancer Res Treat. 2011;130(1):345-351
29. Hennessy BT, Gonzalez-Angulo A-M, Stemke-Hale K. et al. Characterization of a naturally occurring breast cancer subset enriched in epithelial-to-mesenchymal transition and stem cell characteristics. Cancer Res. 2009;69(10):4116-4124
30. Cancer Res. 2009;69(10):4116-4124
. Prat A, Parker JS, Karginova O. et al. Az emlőrák claudin-alacsony intrinsic altípusának fenotípusos és molekuláris jellemzése. Breast Cancer Res. 2010;12(5):R68
31. Breast Cancer Res. 2010;12(5):R68
. Yu K-D, Zhu R, Zhan M. et al. Prognózis szempontjából releváns alcsoportok azonosítása kemorezisztens tripla-negatív emlőrákban szenvedő betegeknél. Clin Cancer Res. 2013;19(10):2723-2733
32. Clin Cancer Res. 2013;19(10):2723-2733
. Basho RK, Yam C, Gilcrease M. et al. Egy mTOR-alapú szisztémás terápiás séma összehasonlító hatékonysága előrehaladott, metaplasztikus és nem metaplasztikus tripla-negatív emlőrákban. Onkológus. 2018;23(11):1300-1309
33. Basho RK, Gilcrease M, Murthy RK. et al. Targeting the PI3K/AKT/mTOR Pathway for the Treatment of Mesenchymal Triple-Negative Breast Cancer. JAMA Oncol. 2017;3(4):509
34. Bergom C, Currey A, Desai N, Tai A, Strauss JB. Mély inspirációs légzésvisszatartás: technikák és előnyök a szív kímélésére az emlőrák besugárzása során. Front Oncol. 2018;8:87
35. Latty D, Stuart KE, Wang W, Ahern V. Az emlőrák kezelésében alkalmazott mély inspirációs légzés-visszatartási technikák áttekintése. J Med Radiat Sci. 2015;62(1):74-81
36. J Med Radiat Sci. 2015;62(1):74-81
. Leyrer CM, Berriochoa CA, Agrawal S. et al. Predictive factors on outcomes in metaplastic breast cancer. Breast Cancer Res Treat. 2017;165(3):499-504
37. Takala S, Heikkilä P, Nevanlinna H, Blomqvist C, Mattson J. Az emlő metaplasztikus karcinómája: Prognózis és a szisztémás kezelésre adott válasz metasztatikus betegségben. Breast J. 2019;25(3):418-424
38. Breast J. 2019;25(3):418-424
. Harper NW, Hodges KB, Stewart RL. et al. A tripla-negatív metaplasztikus emlőrák adjuváns kezelése heti paclitaxel és platina kemoterápiával: Retrospective Case Review From a Single Institution. Clin Breast Cancer. May. 2019