Tartalom
- 1 Funkció
- 2 Humán laktát-dehidrogenáz
- 2.1 Szerkezet
- 2.2 Katalízis
- 2.3 Kinetika
- 2.4 Szabályozás
- 3 A laktát-dehidrogenáz 3D szerkezete
Funkció
Az L-laktát-dehidrogenáz (L-LDH) katalizálja a piruvát és a NADH+ L-laktáttá és NAD+-vá történő átalakulását.
A H-laktát-dehidrogenáz (H-LDH) katalizálja a D-laktát és a ferricitokróm c interkonverzióját piruváttá és ferrocitokróm c-vé.
A laktát-dehidrogenáz (LDH) fontos enzim az emberben. A szervezet különböző régióiban fordul elő, és minden régióban különböző alegységek egyedi konformációjával rendelkezik. Az LDH kulcsfontosságú enzim az anaerob légzésben. Az anaerob légzés oxigén hiányában zajlik. Ez az útvonal két fő módon fontos a glikolízis szempontjából. Az első az, hogy ha a piruvát felhalmozódna a glikolízis és így az ATP-termelés lelassulna. A második, hogy az anaerob légzés lehetővé teszi a NAD+ regenerálódását a NADH-ból. NAD+-ra akkor van szükség, amikor a glikolízis során a gliceraldehid-3-foszfát-dehidrogenáz oxidálja a gliceraldehid-3-foszfátot, ami NADH-t generál. A laktát-dehidrogenáz felelős a NADH anaerob átalakításáért NAD+ -vá. a Cryptosporidium parvumból származó laktát-dehidrogenázban (4nd4).
A humán laktát-dehidrogenáz
Szerkezete
két alegység, az M és a H (Muscle és Heart) alegységek kombinációjából kialakult négy alegységből álló szerkezetű kvaterner fehérje. Az emberi szervezetben megtalálható különböző kombinációk a következők:
- (4H) Szív
- (3H1M) Reticuloendothelialis
- (2H2M) Tüdő
- (1H3M) Vese
- (4M) Izom és Máj
Az itt látható LDH 40%-ban alfa hélixekből és 23%-ban béta lapokból áll. A SCOP-adatok a laktát-dehidrogenáznak ezt a formáját vegyes béta-alfa-béta, főként párhuzamos béta-lapokkal rendelkező formának minősítik.
Vö. még
- Humán laktát-dehidrogenáz
- Jázmin laktát végleges
- Rossmann hajtás.
Katalízis
A vizsgálatok kimutatták, hogy az LDH reakciómechanizmusa egy rendezett sorrendet követ.
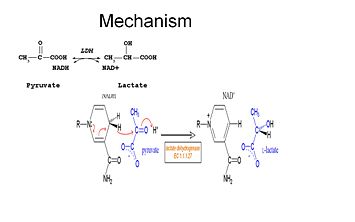
A laktát oxidációjához először a NADH-nak kell az enzimhez kötődnie, majd a laktátnak. . Miután a NADH az enzimhez kötődött, ezután lehetséges a laktát megkötése (a szubsztrát oxamát látható; a -CH3 csoportot -NH2 helyettesíti, így oxamát keletkezik). A laktát a nikotinamidgyűrű és több LDH-maradék között kötődik az enzimhez. Ezután egy hidridion átadása gyorsan megtörténik mindkét irányba, így a két harmadlagos komplex, az enzim-NAD+-laktát és az enzim-NADH-piruvát keveréke jön létre, végül a piruvát disszociál az enzimről, amelyet a NAD+ követ.
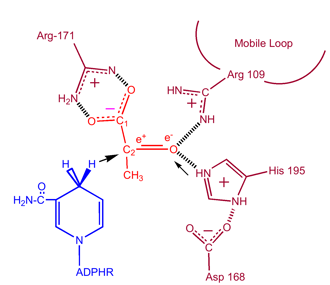
Kinetika
A laktát-dehidrogenáz kinetikai vizsgálatai oxaláttal és oxamáttal (a laktát és a piruvát szerkezeti analógjai)igazolták a fenti mechanizmust. A reakció sebességkorlátozó lépése a NAD+ és a NADH disszociációjának sebessége. A piruvát laktáttá történő átalakulása a NAD+ ezt követő regenerációjával nagyon kedvező.
Szabályozás
Mivel a mechanizmus egyensúlyi mechanizmusról van szó, úgy tűnik, nincs kifejezetten a laktát-dehidrogenázra tervezett szabályozás, ehelyett az anaerob reparáció aktiválásától és a piruvát és NADH, illetve a laktát és NAD+ jelenlététől függ.
A laktát-dehidrogenáz 3D szerkezetei
Laktát-dehidrogenáz 3D szerkezetei
.
