A pitvarfibrilláció (AF) a leggyakoribb tartós tachyarrhythmia, amely a lakosság 1-2%-ánál fordul elő. A pulmonális vénák izolálása (PVI) az AF ablációjának fő pillére.1 Bár ez az eljárás hatékony a ritmuszavar kiújulásának megelőzésében a paroxizmális AF-ben szenvedő betegeknél, ha önmagában végzik, csak korlátozott sikerrel alkalmazható a perzisztens AF-ben.1,2 A kezdeti adatok azt sugallták, hogy az aritmia kiújulása csökkenthető további vonalas ablációval vagy komplex frakcionált pitvari elektrogram ablációval. A PVI-n túli további abláció előnyét azonban a metaanalízisek3 és a randomizált, kontrollált vizsgálatok legújabb eredményei nem igazolták,4 hangsúlyozva a tartós PVI fontosságát, még perzisztens AF-ben is.
Az utóbbi néhány évben a krioballon abláció a rádiófrekvenciás (RF) abláció alternatív megközelítésévé vált, és legalább olyan hatásosnak bizonyult, mint a PVI paroxizmális AF-ben szenvedő betegeknél. A FIRE & ICE vizsgálat közelmúltbeli eredményei véglegesen eldöntötték a vitát ezen a területen.5 Ezen túlmenően, a relatív egyszerűség, a gyorsabb tanulási görbe -és ami talán még fontosabb- a figyelemre méltó reprodukálhatóság6 miatt ezt az eljárást széles körben elfogadták a klinikai gyakorlatban.6
Másrészről, a perzisztens AF intervenciós kezelése továbbra is kihívást jelent: ez a megközelítés nem standardizált vagy tökéletesített, és van hely az innovációra. Ebben a környezetben érdekes a krioabláció lehetséges szerepének kérdése.
KLINIKAI TÁMOGATÁS
Bár egyre nagyobb az érdeklődés az AF-abláció hatékonysága iránt a perzisztáló AF-ben szenvedő betegeknél, az új, 28 mm-es, második generációs krioballon-katéter (Arctic Front Advance, Medtronic Inc., Minneapolis, MN) alkalmazása utáni követési adatok még mindig korlátozottak. Eddig a perzisztens AF-ben a krioballon abláció utáni eredményeket metaanalízisek, nem randomizált összehasonlítások,7 és megfigyeléses vizsgálatok révén értékelték közvetve.8-10
Ciconte és munkatársai9 arról számoltak be, hogy a perzisztens AF-es betegek 60%-a mentes volt a pitvari tachyarrhythmiától az új krioballon katéterrel végzett kezelés után. A perzisztáló AF időtartama, amely független előrejelzője volt az aritmia kiújulásának a követés során, egyértelműen támogatja a betegség korábbi stádiumában történő ablációt.
A 48 perzisztáló AF-es beteg retrospektív vizsgálatában az 1 éves klinikai sikerességi arány 69% volt.10
Egy másik egykaros vizsgálatban a második generációs krioabláció hatékonyságát értékelték 100 perzisztáló AF-es betegcsoportban, mint indexeljárás (átlagos időtartam 5,5 ± 3,7 hónap).8 A 10,6 ± 6,3 hónapos átlagos követési idő után a betegek 67%-ánál nem volt pitvari tachyarrhythmia kiújulás a 3 hónapos kiiktatási időszakot követően. A kiújulás egyetlen szignifikáns független prediktora a pitvari tachyarrhythmia előfordulása volt az üresjárati időszak alatt.
Egy egyközpontú, nem prospektív, nem randomizált vizsgálatban szintén csak perzisztens AF-es betegeknél értékelték az RF-et a krioablációval összehasonlítva.7 Ebben a vizsgálatban az RF abláció (kontakt-erő ablációs katéterrel) és a krioabláció (28 mm-es második generációs krioballon használatával) eljárásbeli eredményét értékelték 100, gyógyszer-refrakter perzisztens AF-ben szenvedő betegcsoportban (az AF átlagos időtartama 7,2, illetve 7,6 hónap volt az RF ablációs és a krioablációs csoportban). Mind az eljárási, mind a fluoroszkópiás idő szignifikánsan rövidebb volt a krioablációs csoportban, de a pitvari aritmiától mentes betegek aránya hasonló volt a két csoportban a 12 hónapos követés után (60% a krioablációs csoportban vs. 56% az RF ablációs csoportban, P = .71). A többváltozós elemzés során a kudarc egyetlen független prediktora ismét a perzisztens AF időtartama és a kiiktatási időszak alatti kiújulások voltak.
Végezetül egy prospektív, multicentrikus, nem randomizált vizsgálatban egyetlen ablációs eljárás utáni eredményeket hasonlítottak össze, kizárólag PVI-t célzó első generációs krioballon ablációval és nyílt-irrigált RF ablációval, lépésenkénti megközelítéssel, egy, a hajlamhoz igazított, perzisztens AF-es betegekből álló kohorszban.11 Az eredmények, amelyek a pitvari ritmuszavaroktól való mintegy 55%-os mentességet mutattak a 15,6 ± 11,5 hónapos átlagos követési idő alatt az egyszeri ablációt követően, mind a cryoballonnal, mind az RF-vel végzett ablációt követően, hasonlóak voltak a rendelkezésre álló adatokhoz. Több megállapítás is figyelemre méltó volt:
- –
Először is, a klinikai eredmények hasonlóak voltak a két kezelési ágban, annak ellenére, hogy az RF-csoportban a PVI-n túl további és kiterjedtebb ablációra került sor.
- –
Másodszor, a szövődmények aránya hasonló volt a két technikánál.
- –
Harmadszor, az eljárás időtartama rövidebb volt a krioablációval.
A perzisztens AF abláció patofiziológiáját és optimális stratégiáját illetően még mindig bizonytalanság van, ezért a terápia alappillére továbbra is a tartós PVI elérése.4 Ennek eléréséhez a krioabláció az RF mellett érvényes alternatív terápiás megközelítésnek tűnik. A PVI-n felül további abláció elvégzése hosszabb eljárási idővel jár.4 Mivel az RF ablációs megközelítést nem standardizálták (az RF-karban a legtöbb betegnél további léziók alakultak ki), nem világos, hogy az eredmények az energiaforrásnak vagy az ablációs stratégiának köszönhetőek-e. Az eredmények az energiaforrásnak vagy az ablációs stratégiának köszönhetőek. Ráadásul úgy tűnik, hogy a középtávú eredményeket nem javítják szignifikánsan a PVI-n túli további biatriális léziók a perzisztens AF-es betegeknél.4
SHOOTING AT THE RIGHT TARGET?
A további ablációból származó fokozott előny hiányának okait még tisztázni kell. Az egyik lehetőség a kiterjedtebb ablációval járó szubsztrátmegközelítés iatrogén potenciálja, amely a hiányosan ablált szövetek vagy a vezetési blokk hiányos vonalai miatt kedvezhet az aritmogenezis új területeinek kialakulásának. Egy másik lehetőség, hogy a bűnös területet nem azonosítják rutinszerűen, és sem a komplex frakcionált pitvari elektrogramok, sem a lineáris léziók nem jelentenek optimális kiegészítő célpontot az ablációhoz.12 Ebben a hipotézisben továbbra is szükség van a vihar szemének pontos meghatározására (a rotorok vagy ganglionok megcélzásával)13 , esetleg újabb térképezési algoritmusok alkalmazásával. A rendelkezésre álló adatok alátámasztják az AF időtartamának és következésképpen az elektromos AF remodelling (AF begets AF) szerepét is, mivel a propensity-score összehasonlításban csak az AF időtartama volt az aritmia kiújulásának független előrejelzője,11 amint arról korábban Tilz és munkatársai beszámoltak.2
Más folyamatban lévő vizsgálatok segítenek majd tisztázni a krioabláció biztonságosságát és hatékonyságát a perzisztens AF-es betegeknél. A Cryoballoon Ablation for Early Persistent Atrial Fibrillation trial (Cryo4 Persistent AF – NCT02213731) egy európai multicentrikus, prospektív, egykarú kísérleti vizsgálat, amelynek célja a kizárólag krioablációval végzett PVI sikerességének értékelése 1 év elteltével olyan betegeknél, akiknél a perzisztens AF kevesebb mint 12 hónapos előzménye van. Ez a vizsgálat még a toborzási fázisban van, és az első eredmények 2017 végére várhatók. A következő cél az lesz, hogy egy randomizált vizsgálatban összehasonlítsuk az eredményeket az RF fokozatos megközelítés és a PVI krioabláció között a perzisztáló AF-ben szenvedő betegek homogén csoportjában. Ennek a nagyszabású randomizált vizsgálatnak az eredményeit nagy izgalommal várjuk.
HATÁRSASÁGOK ÉS HATÁRÉRTÉKEK
A perzisztens AF-es betegeknél még a legnagyobb maximális PV-átmérő (20 mm és 23 mm között) is lényegesen alacsonyabb, mint a kritikus 28 mm-es érték (a rutin klinikai gyakorlatban alkalmazott krioballon maximális átmérője).14 A ballon és a PV-k átmérője közötti ilyen eltérés miatt, amikor ezt az eszközt a PV-antrumhoz helyezik, annak hűtő része mind a PV-antrával, mind a szomszédos pitvari szövetekkel érintkezik, ami az eljárás fontos előnyének tűnik. Kenigsberg és munkatársai,15 a PV krioablációt követően a bal pitvar 3 dimenziós elektroanatómiai feszültségtérképezésével számították ki az ablált szívszövet területét a krioablációt követően. Ezzel a módszerrel ezek a szerzők szépen kimutatták, hogy a 28 mm-es cryoballoon eszközzel végzett krioablációt követően a bal pitvar hátsó falának elektromosan érintetlenül maradt felületének mindössze 27%-a volt.
Megjegyzendő, hogy bár a cryoballoon koncepcionálisan csak a PV-ket célozza, a bal pitvar hátsó falának jelentős elektromos debulkingját is elvégzi (ábra). A hűtési terület kerületének kiterjesztésével ez az eszköz járulékos előnyöket biztosíthat azáltal, hogy ablatálja az AF kiváltásában és fenntartásában szerepet játszó struktúrák, például a ganglion plexi és a rotorok helyi járulékos tényezőit, aminek valószínűleg jelentős terápiás következményei lehetnek a perzisztáló AF-ben szenvedő betegek esetében.13 Ez a tulajdonság legalább részben magyarázhatja a fent említett vizsgálatok eredményeit is.
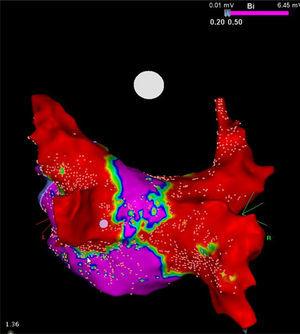
A hátsó fal nagy sűrűségű feszültségtérképe krioablációs eljárást követően egy perzisztáló pitvarfibrillációban szenvedő betegnél. Figyelje meg a 28 mm-es Artic Front Advance krioballonnal (Medtronic, Minneapolis, MN, Egyesült Államok) kapott két nagy heg (piros) között megmaradt keskeny folyosót (lila). Prof. Mario Oliveira, Santa Marta Kórház, Lisszabon, Portugália jóvoltából.
Bár a krioballon sikerességi aránya a perzisztáló AF-ben szenvedő betegek nem randomizált vizsgálataiban hasonló az RF-hez, az aritmia kiújulásának viszonylag magas aránya mindkét csoportban továbbra is megmagyarázatlan, és talán nem csak a PV-k vezetési helyreállításának tulajdonítható. Ezt a lehetőséget megemlítették azokban a tanulmányokban, amelyek aggályokat vetettek fel a relapszus mechanizmusát biztosító nem PVI-források szerepével kapcsolatban.9
A perzisztens AF-ben az invazív kezelés változatos patofiziológiája miatt továbbra is kihívást jelent. Új mechanisztikus felismerésekre van szükség ahhoz, hogy a perzisztáló AF egyénre szabott megközelítése lehetővé váljon, de amíg ilyen ismeretek nem állnak rendelkezésre, az első szándékú, önálló PVI elegendő lehet, legalábbis a kevésbé súlyos perzisztáló AF-ben szenvedő betegek esetében. E “kevesebb több” megközelítés alapján a krioballonos PVI megfelelő ablációs stratégiának bizonyulhat a perzisztáló AF-ben, lehetővé téve a megbízható PVI-t a szomszédos pitvari szívizom járulékos debulkingjával. Úgy tűnik, hogy a további szubsztrátmódosítás nem biztosít további előnyöket. Ez a “minimalista” eljárás elfogadható első lehetőség azoknál a betegeknél, akiknél a tünetekkel járó perzisztáló AF viszonylag új keletű, azaz “több a trigger, mint a szubsztrát” (vagy a PV-k ostiumai körül koncentrálódó szubsztrát…). A nagyméretű (28 mm-es) második generációs krioballon valóban hasonló eredményeket biztosít, mint a bonyolultabb, RF-energiát és kifinomult módszereket alkalmazó eljárások. Megjegyzendő, hogy a tanulási görbe, a reprodukálhatóság és a biztonság úgy tűnik, hogy kevésbé tapasztalt kezekben a cryoballon eszköz mellett szól. Ebben a környezetben és a fent említett betegalcsoportban a nagyméretű, második generációs krioballonnal végzett PVI ésszerű kezdeti megközelítésnek tűnik, amely a jelöltek több mint felénél jelentős javulást eredményez. Az AF-recidensben szenvedő betegek esetében ez az első eljárás nem lesz haszontalan. Sőt, a már kezelt szubsztrát jelentős részénél (a jobb és bal PV-antra körül) a második eljárás, ezúttal RF segítségével, elsősorban a PV-n kívüli fókuszokra, fragmentált potenciálokra, mikro- vagy makrorezentrikus áramkörökre stb. fog összpontosítani.
Véleményünk szerint ez a kétlépcsős stratégia összeegyeztethető a kis és közepes volumenű, elsősorban PVI-re összpontosító központok bevetésével, amelyek kéz a kézben dolgoznak a komplexebb eljárásokat végző tercier referenciaközpontokkal. Ez utóbbiaknak kell majd foglalkozniuk a betegek körülbelül 40%-ával, akiknél az első “cryo-debulking” után kiújul a betegség…
“A kevesebb több”, de ez még mindig nem elég…
KONFLIKTUSOK
S. Boveda tanácsadói díjakat kap a Medtronic-tól, a Boston Scientific-től és a Livanovától.